

(圖片來源:J. Am. Chem. Soc.)
正文
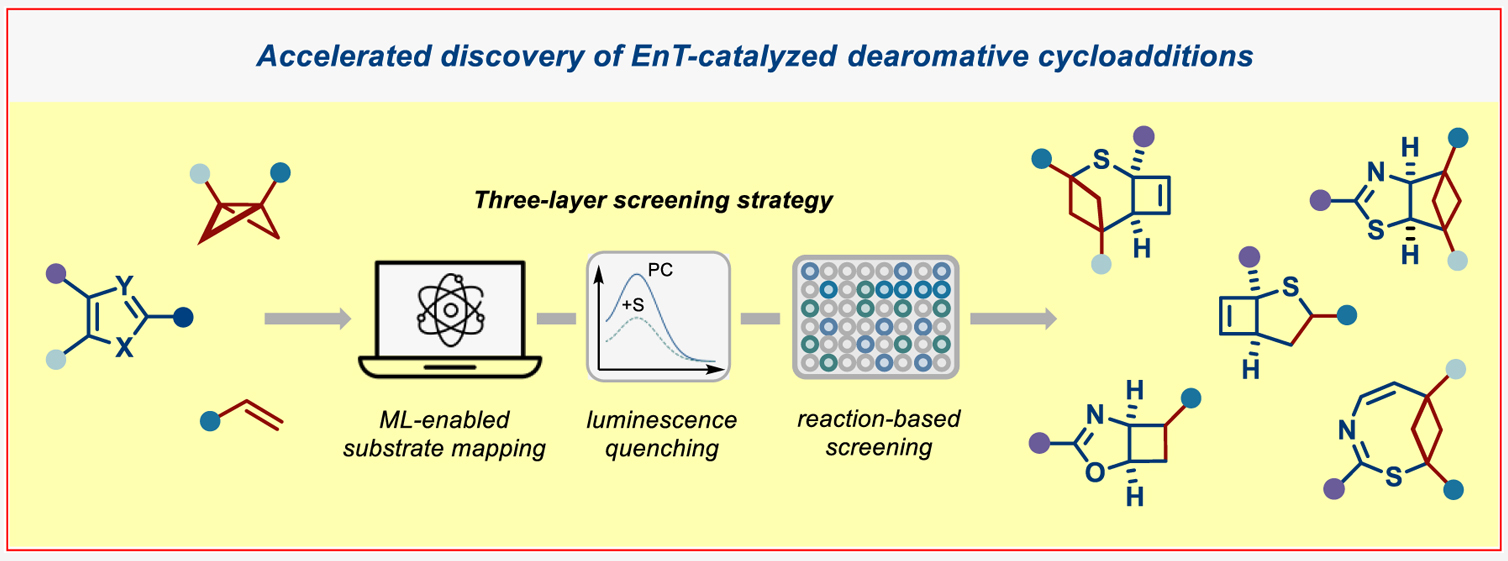
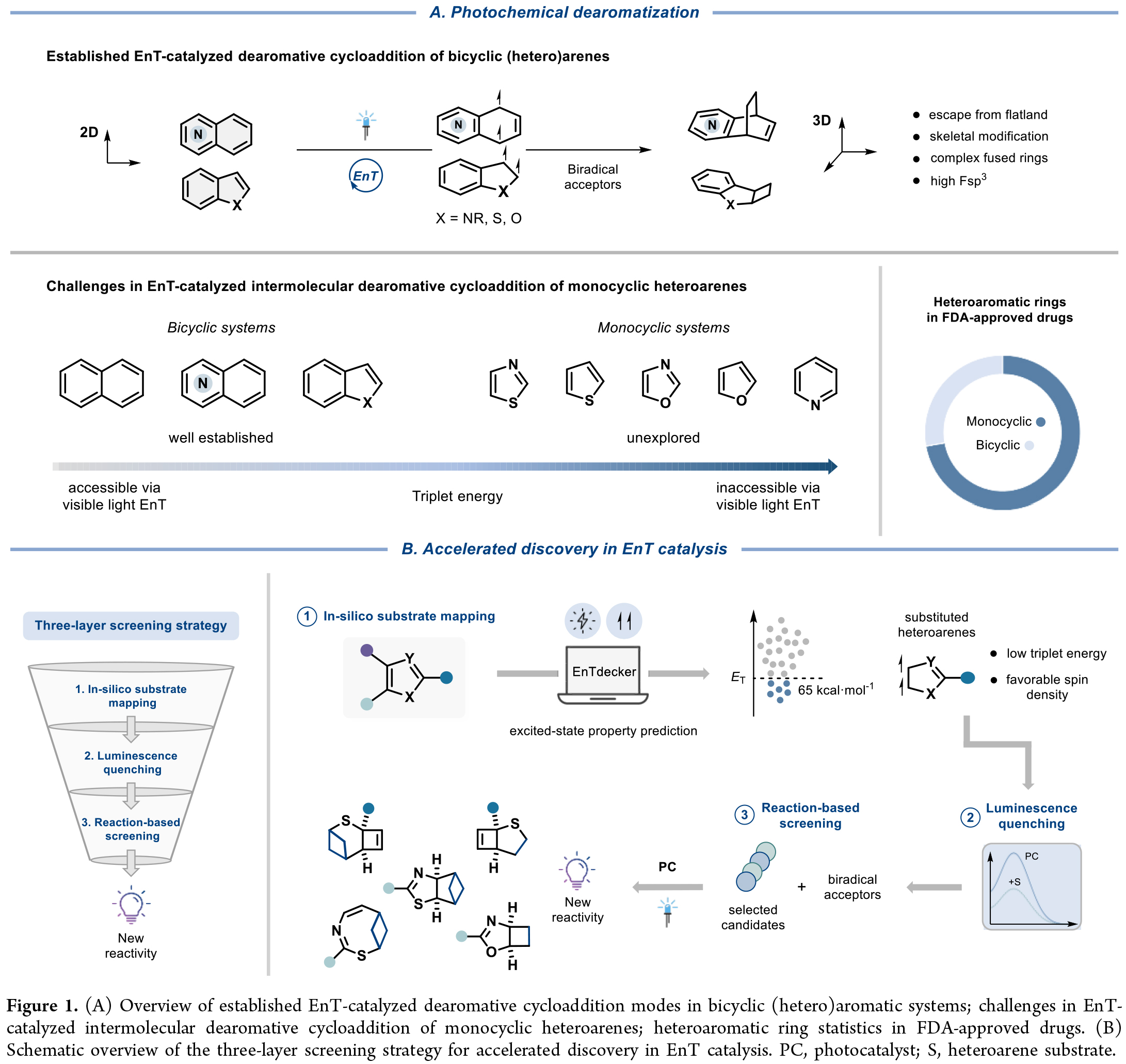
可見光介導的能量轉移(EnT)光催化已成為將平面(雜)芳烴轉化為復雜三維藥用分子的重要策略。然而,現有的分子間去芳構化光環加成反應僅適用于雙環(雜)芳烴體系,而儲量更豐富的單環(雜)芳烴卻鮮有研究,這主要源于其高三線態能壘所致。近日,德國明斯特大學Frank Glorius課題組報道了幾種由EnT催化單環雜芳烴與烯烴以及雙環[1.1.0]丁烷之間的分子間去芳構化環加成反應。為了克服三線態反應活性的固有限制并加速反應的發現過程,作者引入了一種基于數據驅動的三層篩選策略,該策略結合數據科學工具來描繪激發態性質與發光淬滅以及反應篩選。這種協同的三層篩選策略揭示了取代單環雜芳烴與雙自由基受體之間的結構-活性關系,有助于加速新反應性的發現。利用這種基于數據的方法,作者開發了EnT催化噻吩、噁唑和噻唑與烯烴/雙環[1.1.0]丁烷之間的分子間去芳構化環加成反應,從而得到了一系列前所未有的富含C(sp3)的三維分子骨架(Figure 1)。歡迎下載化學加APP到手機桌面,合成化學產業資源聚合服務平臺。
(圖片來源:J. Am. Chem. Soc.)
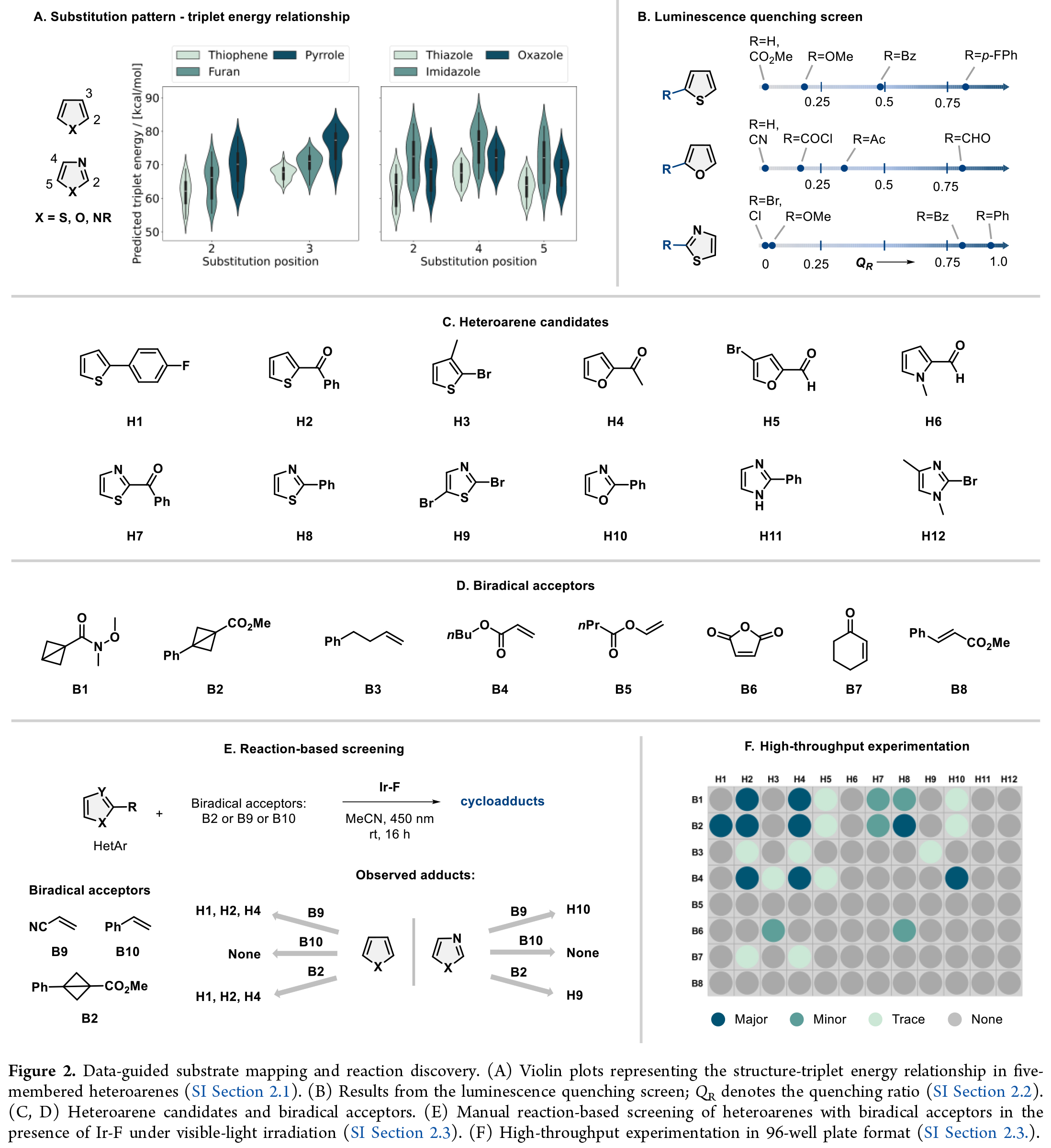
作者以五元雜芳烴(噻吩、呋喃、吡咯及1,3-氮唑類,ET > 70 kcal·mol-1)為研究起點。鑒于取代基模式與官能團特性對激發態行為的顯著影響,作者通過構建含單/雙/三取代的虛擬雜環化合物庫,采用機器學習工具EnTdecker系統預測了各取代雜芳烴的三線態能量與自旋布居,并得到以下結果:(1)噻吩、呋喃和吡咯的C2位取代比C3位更能有效降低三線態能量(Figure 2A);(2)1,3-氮唑中C2位取代效果優于C5位,而C4位無顯著作用;(3)羰基、芳基和鹵素為最優取代基。
基于預測結果,作者選用Ir(dF(CF3)ppy)2(dtbbpy)進行發光淬滅實驗,驗證低三線態能底物與光催化劑的相互作用(Figure 2B)。如預期所示,預測三線態能< 60 kcal·mol-1的底物大多能顯著淬滅催化劑熒光,這為后續反應篩選明確了候選底物。
在可見光照射下,作者選取雜芳烴(H1/H2/H4/H8/H10)與雙自由基受體(B2/B9/B10)進行反應篩選。令人振奮的是,五類雜芳烴與B2/B9成功生成環加成產物(Figure 2E)。作者進一步通過96孔板高通量篩選(12種雜芳烴×8種受體,Figure 2F),發現噻吩、呋喃、噁唑和噻唑體系具有獨特反應性,而預測結果良好的吡咯/咪唑類卻無產物生成。作者后續研究將聚焦兩大方向:(1)噻吩的級聯去芳構化環加成/重排反應;(2)氮唑類的去芳構化環加成。
(圖片來源:J. Am. Chem. Soc.)
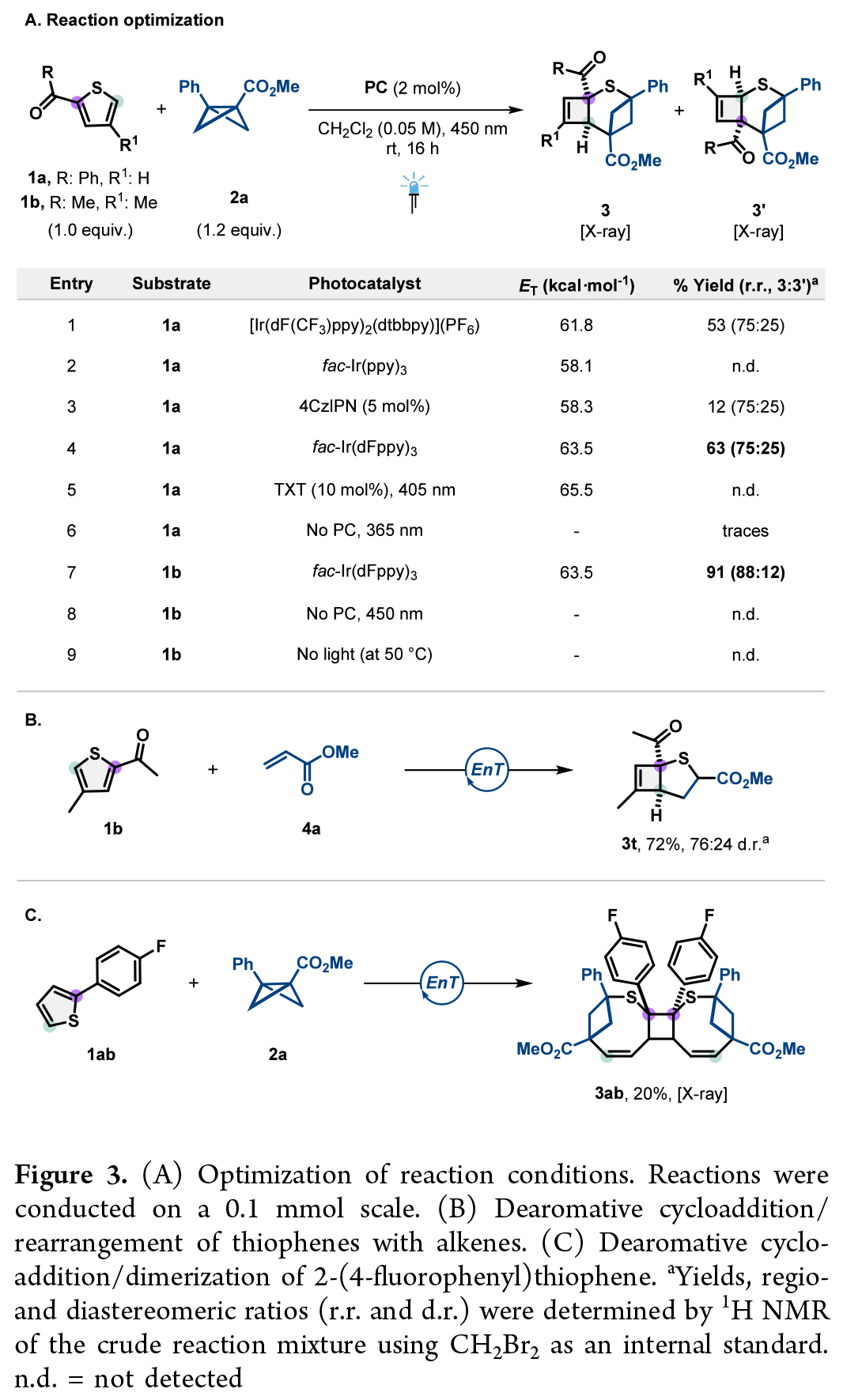
首先,作者使用苯甲酰基噻吩1a和BCB2a作為模板底物對此轉化進行了探索(Figure 3A)。反應可以以53%的收率生成產物3a和3a’,區域異構體比例為75:25。主產物3a源于BCB插入空間位阻較小的C5-S鍵,而次要異構體3a’則通過C2-S鍵插入形成。通過對不同光催化劑的考察,作者發現fac-Ir(dFppy)3效果最佳。值得注意的是,當在噻吩4-位引入甲基(1b)以增加空間位阻時,不僅反應收率提升至91%,區域選擇性也顯著改善(88:12)(entry 7)。作者通過研究噻吩與烯烴的反應發現,噻吩1b與丙烯酸酯4a反應以72%的產率生成2-硫雜雙環[3.2.0]庚-6-烯骨架3t(Figure 3B)。出人意料的是,2-(4-氟苯基)噻吩1ab與2a反應生成了二聚環加成產物3ab,而非預期的三環產物(Figure 3C)。
(圖片來源:J. Am. Chem. Soc.)
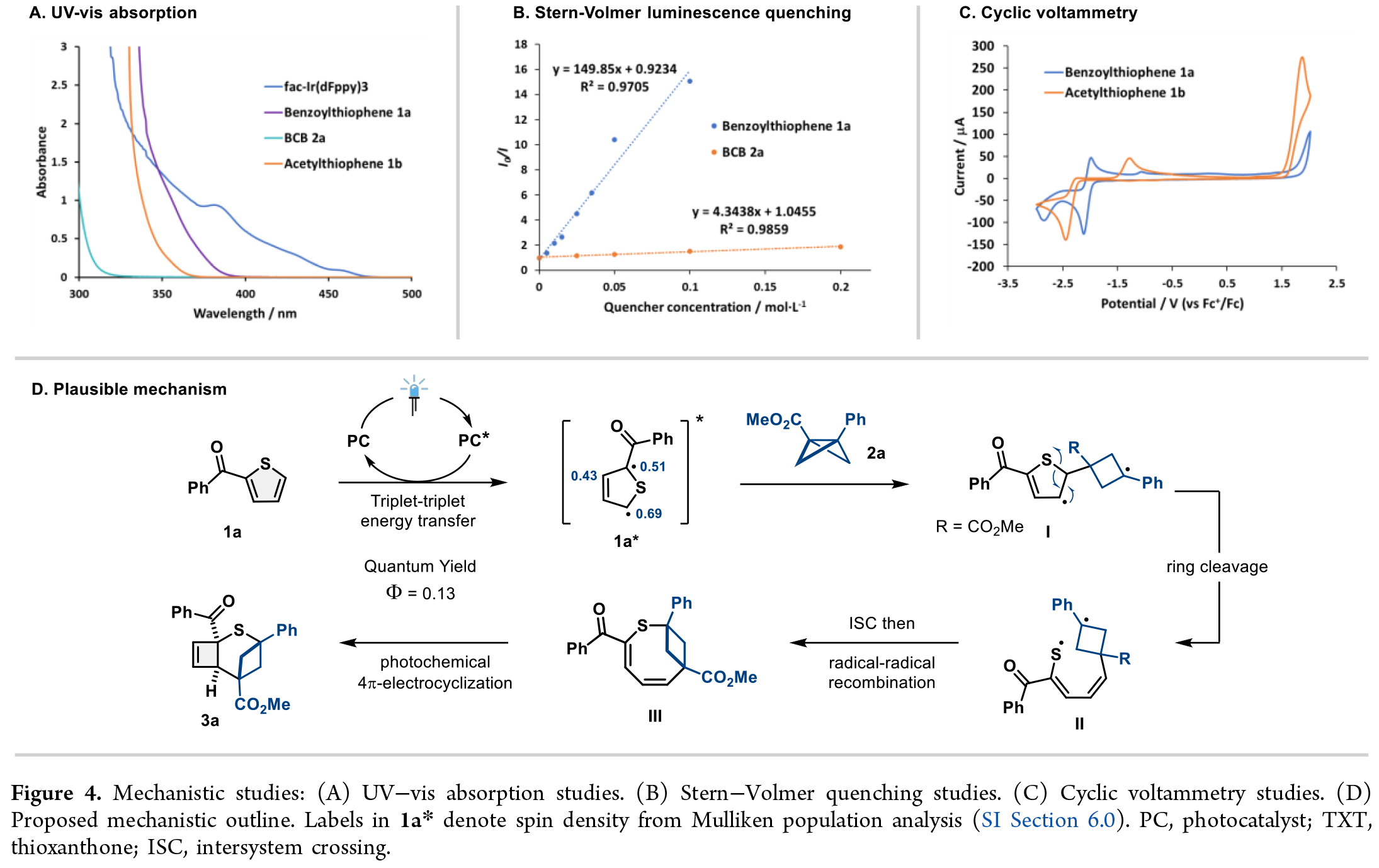
為了深入探究反應機制并驗證能量轉移催化模式,作者開展了一系列機理實驗(Figure 4)。紫外-可見吸收光譜表明在450 nm波長處僅有fac-Ir(dFppy)3存在特征吸收(Figure 4A);Stern-Volmer淬滅實驗證實1a是fac-Ir(dFppy)3激發態的主要淬滅劑(Figure 4B);反應量子產率測定值Φ = 0.13排除了自由基鏈式反應途徑;循環伏安(CV)測試表明激發態fac-Ir(dFppy)3難以氧化/還原1a或1b,從而排除了光氧化還原路徑的可能性(Figure 4C)。
基于上述結果,作者提出如下機制(Figure 4D):可見光激發產生的*fac-Ir(dFppy)3通過三線態-三線態能量轉移生成1a*,其自旋密度分析顯示C5位自旋布居最高,C2位次之。由于C5位空間位阻較小,1a*優先從此位點與2a加成形成三線態雙自由基中間體I。隨后噻吩環C4位自由基誘導環裂解產生中間體II,經系間竄越和自由基重組形成二烯中間體III。在光化學條件下,III發生對旋4π-電環化反應最終生成產物3a。該二烯中間體的存在可通過4-氟苯基噻吩1ab反應中二聚產物3ab的生成得到佐證(Figure 3C)
(圖片來源:J. Am. Chem. Soc.)
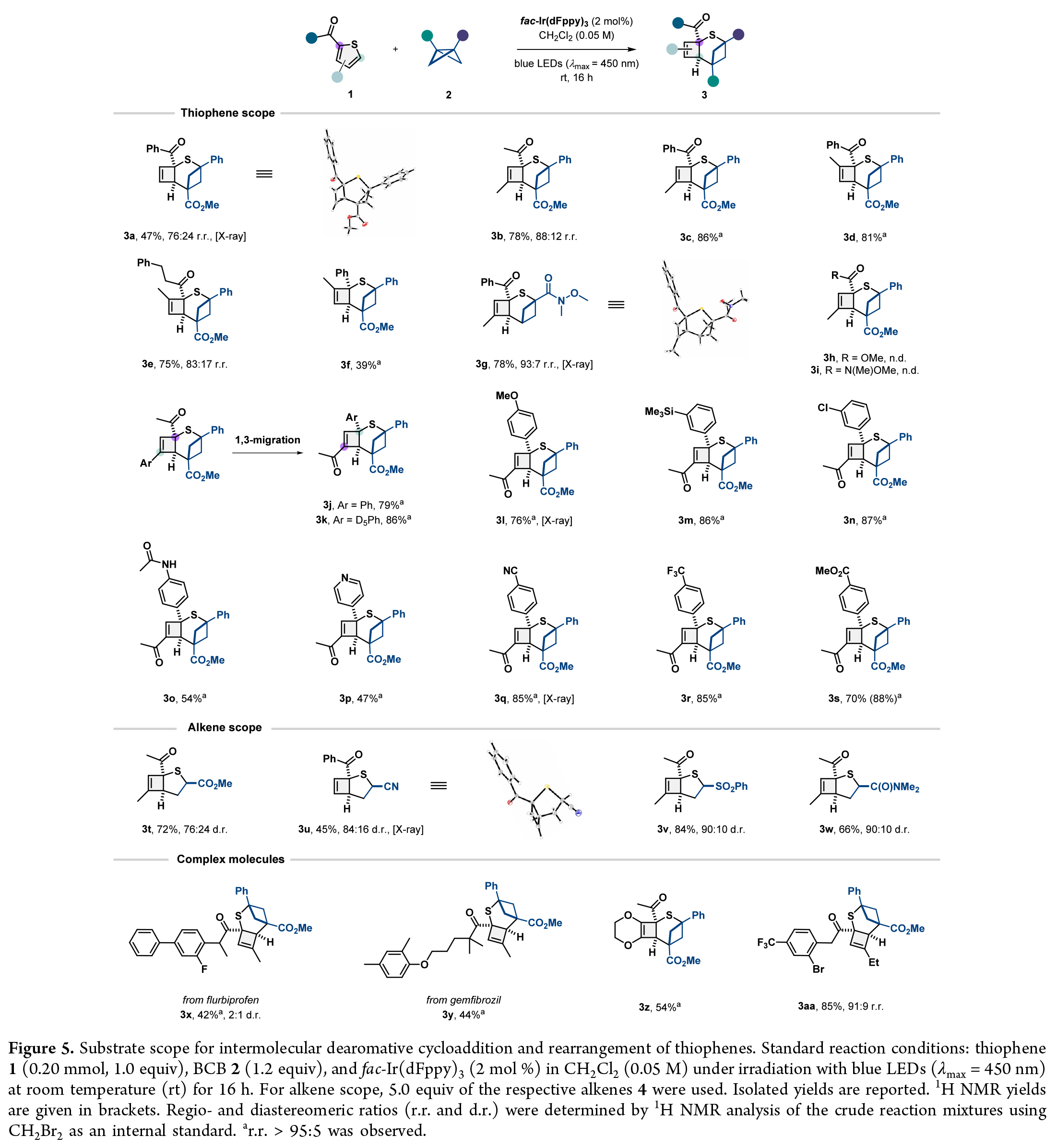
在得到了最優反應條件后,作者對此轉化的底物范圍進行了考察(Figure5)。實驗結果表明,一系列不同取代的噻吩均可順利兼容此轉化,以39-87%的產率得到相應的產物3a-3s。此外,除了BCB外,烯烴也可以作為偶聯配偶體實現轉化,以45-84%的產率得到相應的產物3t-3w。值得注意的是,復雜生物活性分子flurbiprofen和gemfibrozil等均可兼容,證明了此轉化的實用性。
(圖片來源:J. Am. Chem. Soc.)
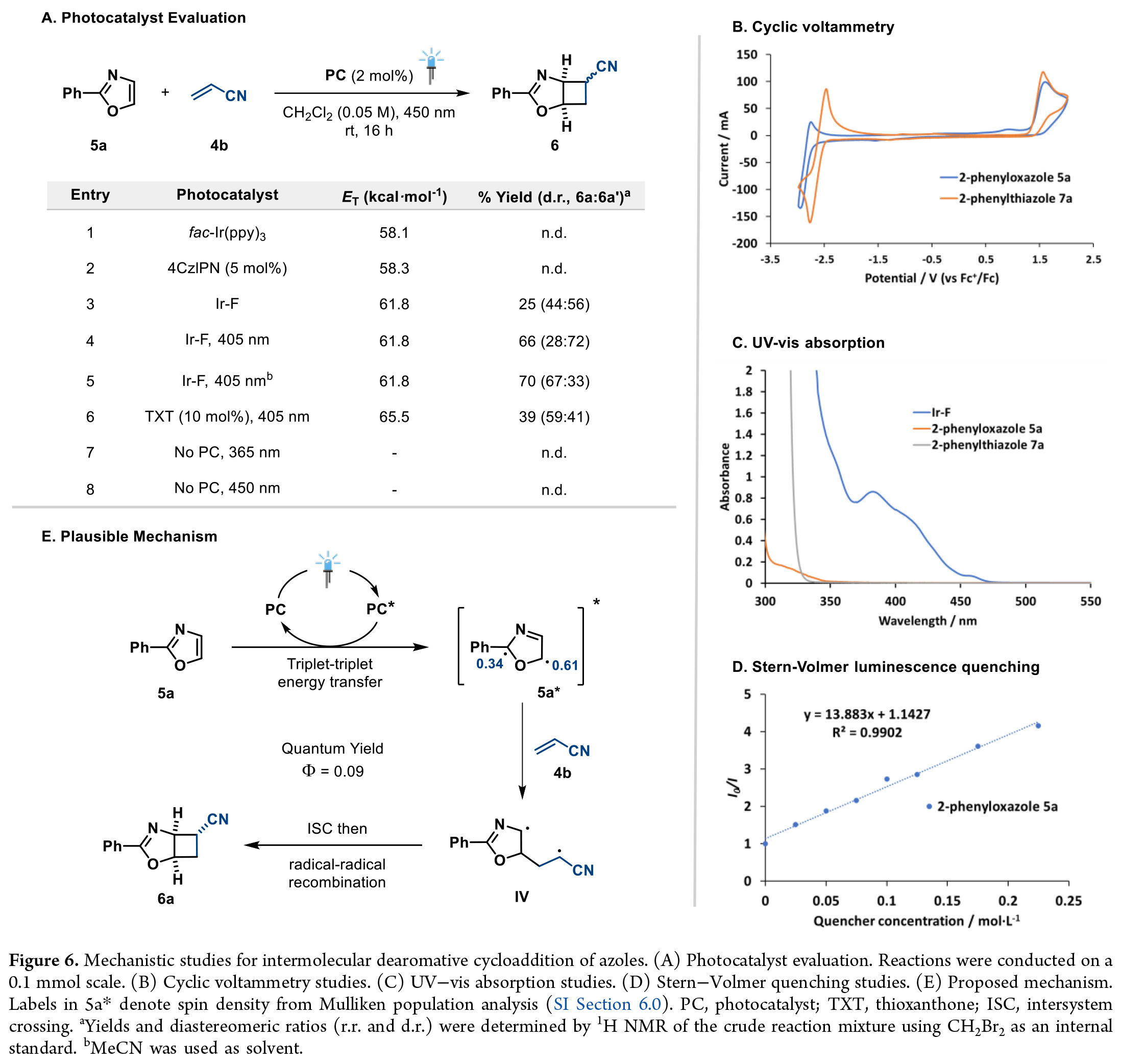
部分飽和的氮雜環化合物廣泛存在于多種生物活性分子及藥效團中。而利用氮雜環的去芳構化環環加成反應為一步構建這類結構提供了直接途徑。基于前期研究結果,作者得出2-苯基噁唑(5a)和2-苯基噻唑(7a)能與丙烯酸酯及雙環[1.1.0]丁烷形成潛在的環加成產物。通過進一步的反應條件優化作者得出最優條件為:乙腈溶劑中,405 nm光照下使用Ir-F催化劑,以70%收率(非對映選擇性67:33)獲得環加成產物6(Figure 6A, entry 5)。
為了驗證能量轉移催化機制,作者開展了一系列機理實驗:循環伏安測試表明5a的氧化半峰電位為1.90 V,還原電位為-2.36 V(Figure6B)。而所用光催化劑Ir(dF(CF3)ppy)2(dtbbpy)的氧化還原電位表明,無論是氧化還是還原過程在熱力學上均難以實現,從而排除了光氧化還原路徑的可能性。紫外-可見吸收光譜顯示,在405 nm波長處Ir-F是主要吸光物種,而5a在350 nm以上基本無吸收(Figure 6C)。值得注意的是,直接激發實驗未檢測到產物生成,進一步證實了可見光介導的三線態反應活性的獨特性。坐著通過Stern-Volmer淬滅實驗證實, 5a能高效淬滅光催化劑激發態(Figure 6D),而文獻報道丙烯腈(4b)的淬滅效率較低。該反應的量子產率為0.09,排除了自由基鏈式反應機制的可能性。基于這些發現,作者提出如下反應機理(Figure 6E):在光激發條件下,Ir-F與5a發生三線態-三線態能量轉移,生成三線態激發物種5a。自旋密度分析顯示,其自旋布居主要集中于C5位,促使5a的C5中心自由基與4b發生區域選擇性加成,形成中間體IV。該中間體經歷系間竄越后,通過自由基-自由基重組生成環加成產物6a,其中空間位阻較小的exo-非對映異構體為主要產物。
(圖片來源:J. Am. Chem. Soc.)
接下來,作者研究了噁唑環加成反應的適用范圍(Figure 7)。實驗結果表明將丙烯腈替換為缺電子烯烴、苯乙烯型烯烴、未活化烯烴以及含雜原子的烯烴時均可實現轉化。此外,多種取代的噁唑均能良好兼容。整體以35-71%的產率得到相應的產物6a-6t。
對于噻唑,2-苯基噻唑(7a)與2a反應得到了[2π+2σ]環加成產物(8a,41%)和去芳構化插入產物(8a’,17%),且兩者易于分離。此外,當苯環上含有甲氧基(8b)或溴(8c)取代基以及苯甲酰基取代的噻唑(8d)也均成功進行了環加成反應。

總結
Frank Glorius課題組報道了一種由EnT催化的單環雜芳烴與烯烴和BCBs的分子間脫芳香環加成反應。其利用三層篩選策略,整合了激發態性質的數據驅動預測、發光淬滅研究和反應篩選。這一策略使得在不同取代的單環雜芳烴中系統地探索結構-活性關系成為可能,并促進了反應性雜芳烴-雙自由基受體組合的識別,從而加速了新型去芳構化轉化的發現。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn