

(圖片來源:Org. Lett.)
正文
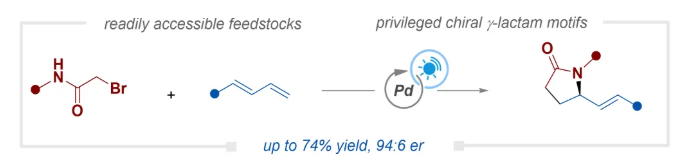
氮雜環是有機化學和藥物化學中不可或缺的結構單元。在這些結構單元中,γ-內酰胺在天然產物和藥物中廣泛存在,并具有多種生物活性(Scheme 1A)。盡管人們已經付出了巨大努力來開發高效且選擇性的方法來構建此類結構單元,但γ-內酰胺的對映選擇性合成仍然無疑具有挑戰性。近年來,一系列直接引入手性中心的不對稱方法已被開發出來(Scheme 1B)。代表性例子包括手性選擇性原子轉移自由基環化、手性選擇性分子內C?H酰胺化、不飽和內酰胺的氫化以及烯烴的手性選擇性羰基化環化。然而,這些方法主要基于分子內過程,需要在底物中預先引入多個官能團,從而在一定程度上降低了原子經濟性和成本效益。這使得難以實現手性內酰胺骨架的復雜性和多樣性。過去十年間,烯烴1,2-官能團化已成為直接合成γ-內酰胺的強大創新策略。該方法采用易于獲得的2-鹵代酰胺作為雙官能團試劑,兼具操作簡便性和合成效率(Scheme 1B)。然而,快速的分子內環化反應在動力學上對手性控制提出了重大挑戰,使得不對稱合成在當前階段難以實現,因此需要開發新的催化體系來實現這種手性選擇性轉化。針對這一挑戰,中南大學陽華課題組受前期工作(ACS Catal. 2025, 15, 4384–4393;ACS Catal. 2024, 14, 3725–3732;Org. Lett.2024, 26, 8762–8767;Org. Lett.2022, 24, 5407–5411;Org. Lett.2022, 24, 924–928)啟發,利用可見光誘導的鈀催化策略,通過1,3-二烯與2-溴酰胺的對映選擇性環化反應,實現了γ-內酰胺的不對稱合成,該方法可實現良好的區域選擇性和對映選擇性(Scheme 1C)。
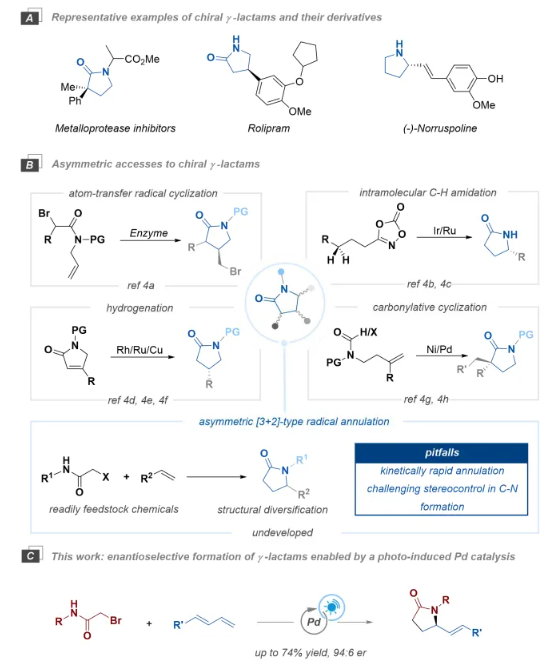
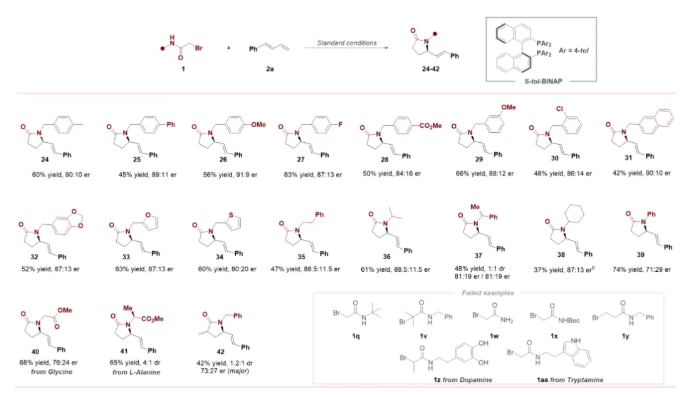
首先,作者以N-芐基-2-溴乙酰胺(1a),1-苯基-1,3-丁二烯(2a)作為模型反應底物進行了相關反應條件的篩選(Table 1),當以Pd(PPh3)4(10 mol%)作為催化劑,S-tol-BINAP(15 mol%)作為配體,K2CO3(2.0 equiv)作為堿,Toluene(1.5 mL)為溶劑,在30 W 450 nm LED照射下,5 ℃反應48小時后,可以65%的分離產率,91:9的er獲得了相應手性γ-內酰胺產物3(Table 1, entry 11)。控制實驗表明,鈀催化劑、配體、堿和光照對該過程均至關重要(Table 1, entry 12-15)。
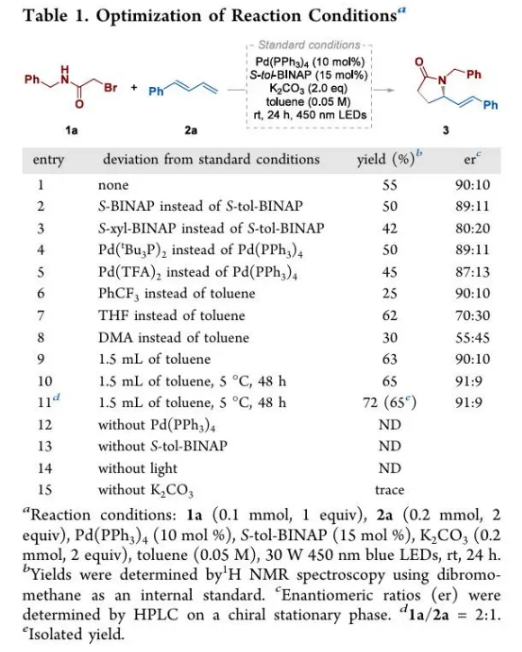
在獲得上述最優反應條件后,作者對1,3-二烯的適應性進行了考察(Scheme 2)。結果表明,一系列吸電子、供電子基團取代的1-芳基-1,3-二烯均能有效參與該反應。此外,芳雜環取代的1,3-二烯,也是該轉化反應的合適底物。值得注意的是,脂肪族1,3-二烯和缺電子1,3-二烯也能夠進行此轉化,然而產物的收率以及對映選擇性相對較低。大宗化學品1,3-丁二烯和其他常見脂肪族1,3-二烯,如2,3-二甲基丁二烯2w和環己二烯2x不太適用于該體系,表現出較差的對映選擇性。
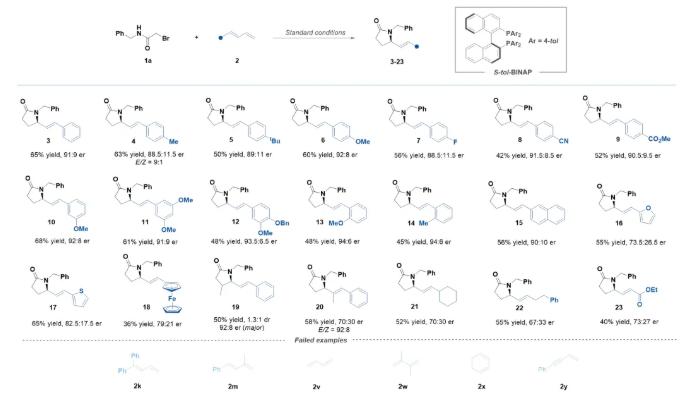
緊接著,作者進一步考察了2-溴酰胺的適用范圍(Scheme 3)。結果表明,一系列帶有不同電子效應取代基(包括甲氧基、甲基、氟、氯和酯基等)的N-芐基-2-溴乙酰胺化合物,均顯示出良好的反應性及對映選擇性。將 N-芐基-2-溴乙酰胺化合物的苯環替換為萘環、呋喃環、噻吩環也是可行的。值得注意的是,當氮原子上帶有較大位阻取代基如環己基時反應效果較差,收率較低。特別地,對于N-叔丁基取代的2-溴乙酰胺,幾乎監測不到目標產物。此外,氨基酸衍生的2-溴酰胺也順利反應。值得強調的是,2-溴乙酰胺氮原子上的取代基對該反應至關重要,在測試無取代基或吸電子取代基的底物時,幾乎無法檢測到目標產物。此外,使用3-溴丙酰胺(1y)也未能成功實現手性六元內酰胺的構建。
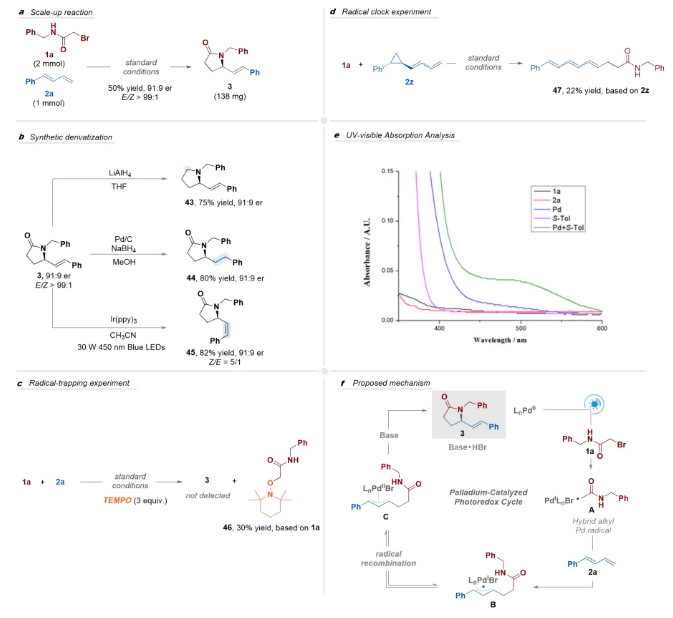
隨后,作者開展了反應應用研究及機理實驗(Scheme 4)。γ-內酰胺3在氫化鋁鋰(LiAlH4)的還原下,可以75%的產率獲得相應手性吡咯烷產物,對映選擇性可以很好的保留;隨后作者對γ-內酰胺3結構中雙鍵分別進行了還原、異構化反應,也可以很好地保留其對映選擇性,展現了該方法良好的應用前景。自由基捕獲實驗和自由基鐘實驗表明反應可能經歷自由基途徑;開/關燈實驗一定程度上排除了自由基鏈式反應的可能性;當使用S-tol-BINAP作為手性配體時,吸收光譜中觀察到明顯的紅移現象,這表明Pd/S-tol-BINAP復合物在藍光區域具有增強的光吸收能力。基于以上實驗結果和已有的報道,作者提出了可能的反應機理。首先,光激發的LnPd0通過單電子轉移(SET)還原N-芐基-2-溴乙酰胺1a,生成雜化烷基鈀自由基物種A,自由基A加成至1,3-二烯2a的末端位置,生成相應的雜化烯丙基鈀自由基復合物B,隨后通過自由基重組形成π-烯丙基鈀復合物C。最后,在堿存在下,π-烯丙基鈀復合物C進行分子內區域選擇性和立體選擇性的親核取代反應,生成手性γ-內酰胺3并再生鈀催化劑。
(圖片來源:Org. Lett.)
總結
總之,中南大學陽華/陳凱課題組開發了一種光誘導鈀催化1,3-二烯與2-溴酰胺的對映選擇性和區域選擇性級聯環化反應,為快速構建結構多樣化的手性γ-內酰胺提供了新途徑。該研究不僅拓展了光激發鈀催化在手性選擇性轉化中的應用前沿,還顯著豐富了手性γ-內酰胺的化學空間。
作者簡介

陽華教授,中南大學“升華學者”特聘教授,博士生導師,化學化工學院副院長。1998年獲得四川大學有機化學專業碩士學位后,赴美留學深造。2011年回國后加入中南大學化學化工學院制藥工程系開展研究工作。多年來,陽華教授一直致力于有機合成,不對稱催化,可見光催化及手性藥物分子的全合成研究工作,主持國家自然科學基金,湖南省科技廳重點項目,參與多項美國NSF以及NIH的基金研究工作。研發出具有優異性能的有機催化劑“Hua Cat”,通過精細化學品公司-- Sigma-Aldrich公司已實現商品化,在全球銷售。近年來,以第一作者/通信作者身份在J. Am. Chem. Soc., Angew. Chem. Int. Ed., ACS Catal., Org. Lett., Chem. Comm., J. Org. Chem.等世界一流期刊上發表學術論文100余篇。

陳凱副教授,男,博士,博士生導師。2009年本科畢業于南開大學,2014年博士畢業于北京大學化學與分子工程學院。致力于計算化學與有機化學結合研究催化反應機制及新反應設計,在過渡金屬催化烯炔環異構化反應,可見光誘導的胺化、氟化及硼化反應,有機催化環加成反應研究中取得系列進展。近年來先后主持國家自然科學基金面上項目、國家自然科學基金青年項目、湖南省自然科學基金面上項目、廣東省自然科學基金博士啟動項目、博士后基金面上項目和特殊資助項目等。以第一作者或通訊作者(包括共同通訊)在J. Am. Chem. Soc., Angew. Chem. Int. Ed., ACS Catal, Chem, Org. Lett.,《中國科學化學》等期刊發表論文100余篇。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn