

正文
氫酶是一類能夠催化氫分子可逆生成和裂解的生物催化劑,目前已知的氫酶根據其活性中心金屬不同可以分為三大類:鎳鐵氫酶、鐵鐵氫酶和單鐵氫酶。發現最晚的單鐵氫酶在催化中心結構和催化機制上與其他兩類氫酶具有明顯區別。首先,在結構上,單鐵氫酶的金屬活性中心只有一個二價鐵離子,而且不含有傳遞電子的鐵硫簇。其次,單鐵氫酶的單金屬活性中心可以直接異裂氫氣生成Fe-H中間體,進而轉移氫負離子到底物上,該過程與傳統貴金屬氫化催化劑類似。這樣的催化機理使其有望應用于不對稱氫化領域。
然而,天然單鐵氫酶僅存在于產甲烷古菌中,需要通過厭氧發酵,并在無氧條件下經過分離純化得到。這個過程復雜且低效。此外,由于來源于古菌,對該酶進行突變和定向進化的基因操作也極具挑戰。以上這些因素導致單鐵氫酶的大規模培養和改造困難,嚴重限制了該酶的研究與應用發展。
人工半合成策略通過將大腸桿菌 (E. coli) 異源表達的脫輔酶(apoenzyme)與有機合成的金屬輔因子仿生配合物(model complex)體外重組,得到具有催化活性的半合成單鐵氫酶(semisynthetic [Fe]-Hydrogenase),這一策略為解決該酶的大規模制備和改造困難帶來希望。然而,目前合成的金屬輔因子仿生配合物與天然金屬輔因子(FeGP)的結構相去甚遠,經過重組得到的半合成單鐵氫酶活性不足天然單鐵氫酶的1%。因此,亟須合成結構上更接近天然金屬輔因子的仿生配合物,以得到重組后活性更高、更穩定的人工半合成單鐵氫酶。
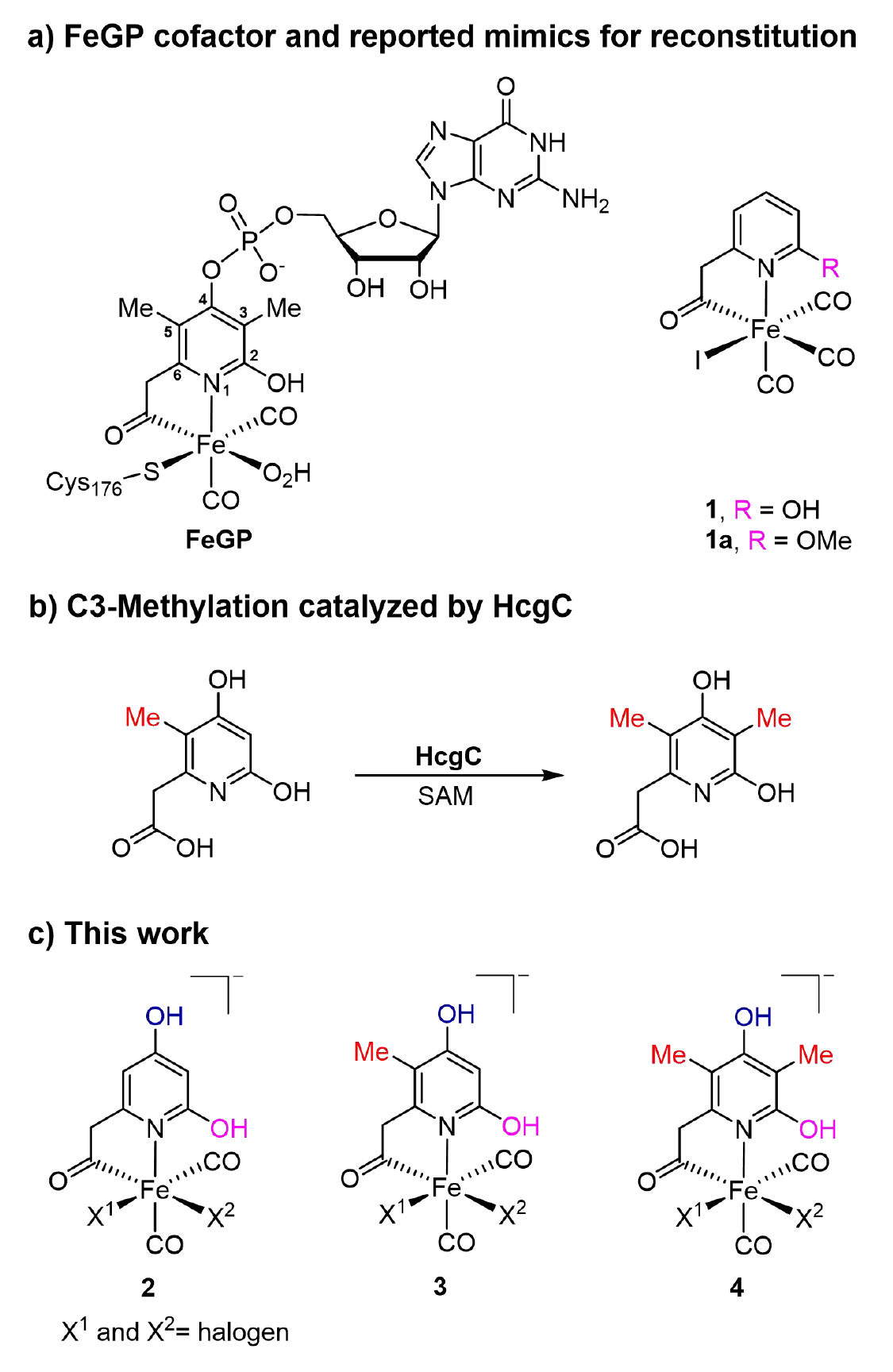
圖1. a) FeGP輔因子的結構和過去報道的仿生配合物結構;b) 生物體內天然金屬輔因子合成過程中的甲基化過程;c) 本文中合成的仿生配合物。(圖片來源:J. Am. Chem. Soc.)
針對天然FeGP 輔因子的吡啶配體結構,通過合成路線的優化,保護基團及脫保護條件的篩選,成功制備高純度仿生配合物2a-4a和2-4,并通過核磁、高分辨質譜、紅外和XRD等手段鑒定了結構。其中仿生配合物4 的結構與天然輔因子最為接近(僅缺失 GMP 基團)。(圖2)
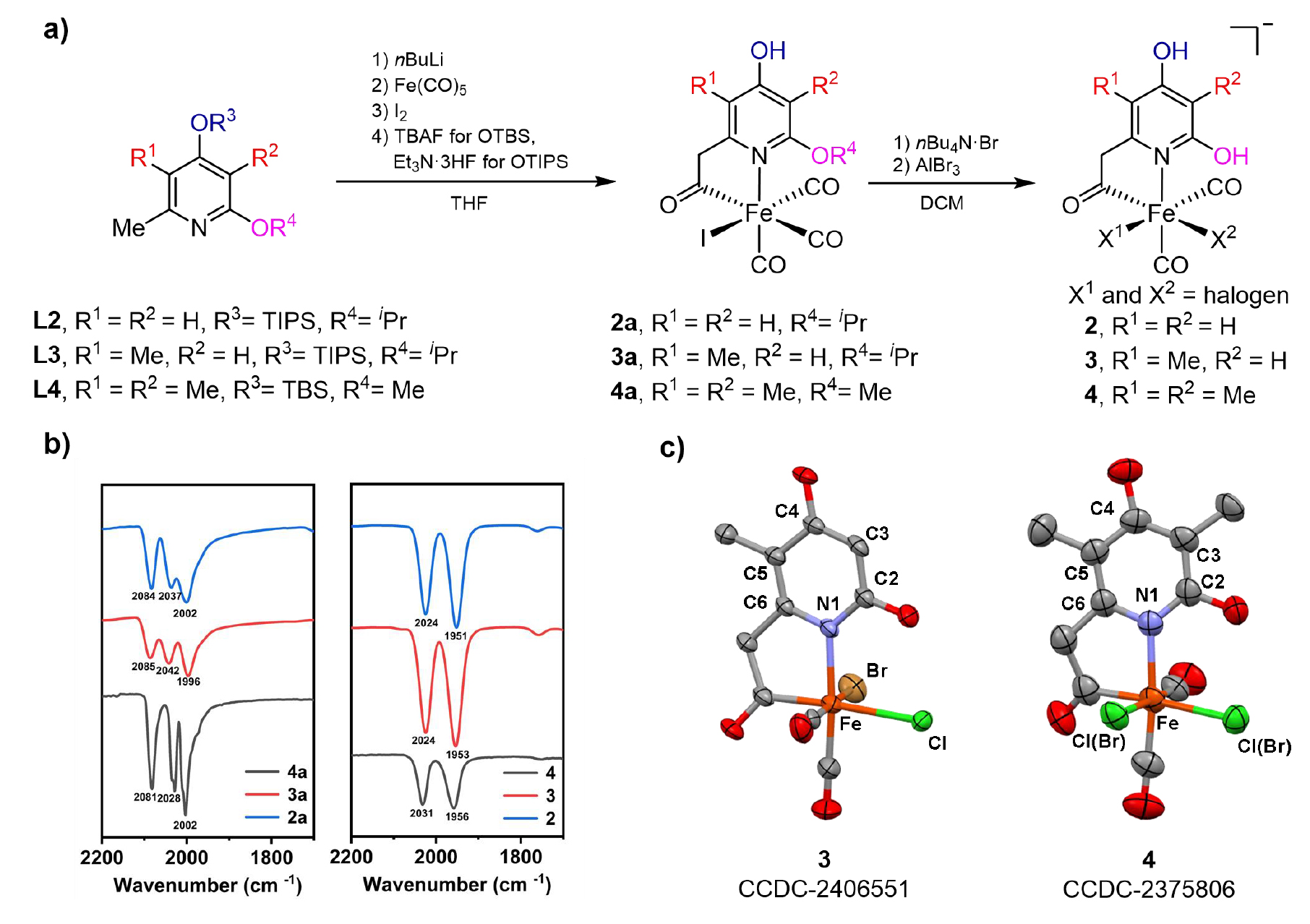
圖2. a) 仿生配合物的合成路線;b) 仿生配合物的紅外光譜;c) 仿生配合物3-4的晶體結構。(圖片來源:J. Am. Chem. Soc.)
合成了仿生配合物1-4后(其中仿生配合物1為對照,參考Nature Chemistry 7, 995–1002 (2015)), 與大腸桿菌表達的脫輔酶經過重組得到了一系列半合成單鐵氫酶,并分別測定了他們的正向(氫化)與反向(脫氫)反應活性、重組速率、空氣穩定性及反應動力學參數。結果顯示,引入3-甲基后,半合成單鐵氫酶 jHmd-4 的催化活性較無3-甲基類似物jHmd-3提升了約35倍,正向/反向反應活性分別達 38.5和33.5 U?mg?1,是目前半合成單鐵氫酶最高紀錄(表1)。此外,3-甲基的存在加速了模型配合物與脫輔酶的重組速度,在重組5分鐘內便達到了其終活性的90%以上,這一速度接近天然FeGP輔因子于脫輔酶的重組速度(圖3c)。相較于jHmd-1, 吡啶上引入4-羥基后重組得到的jHmd-2活性明顯下降,其活性不足jHmd-1的一半。而在引入5-甲基后,活性從jHmd-2的0.7 ± 0.2 U?mg?1(正向)與0.3 ± 0.1 U?mg?1(反向)提升至1.1 ± 0.2 U?mg?1(正向)和1.1 ± 0.1 U?mg?1(反向)(表1)。有意思的是,5-甲基雖然未大幅提升半合成單鐵氫酶的活性,但卻給半合成酶的空氣穩定性帶來了顯著提升—— 暴露于空氣中 30 分鐘后,jHmd-3和jHmd-4仍保留了約 65% 活性,而jHmd-1和jHmd-2的活性已降至初始活性的40%左右(圖3d)。
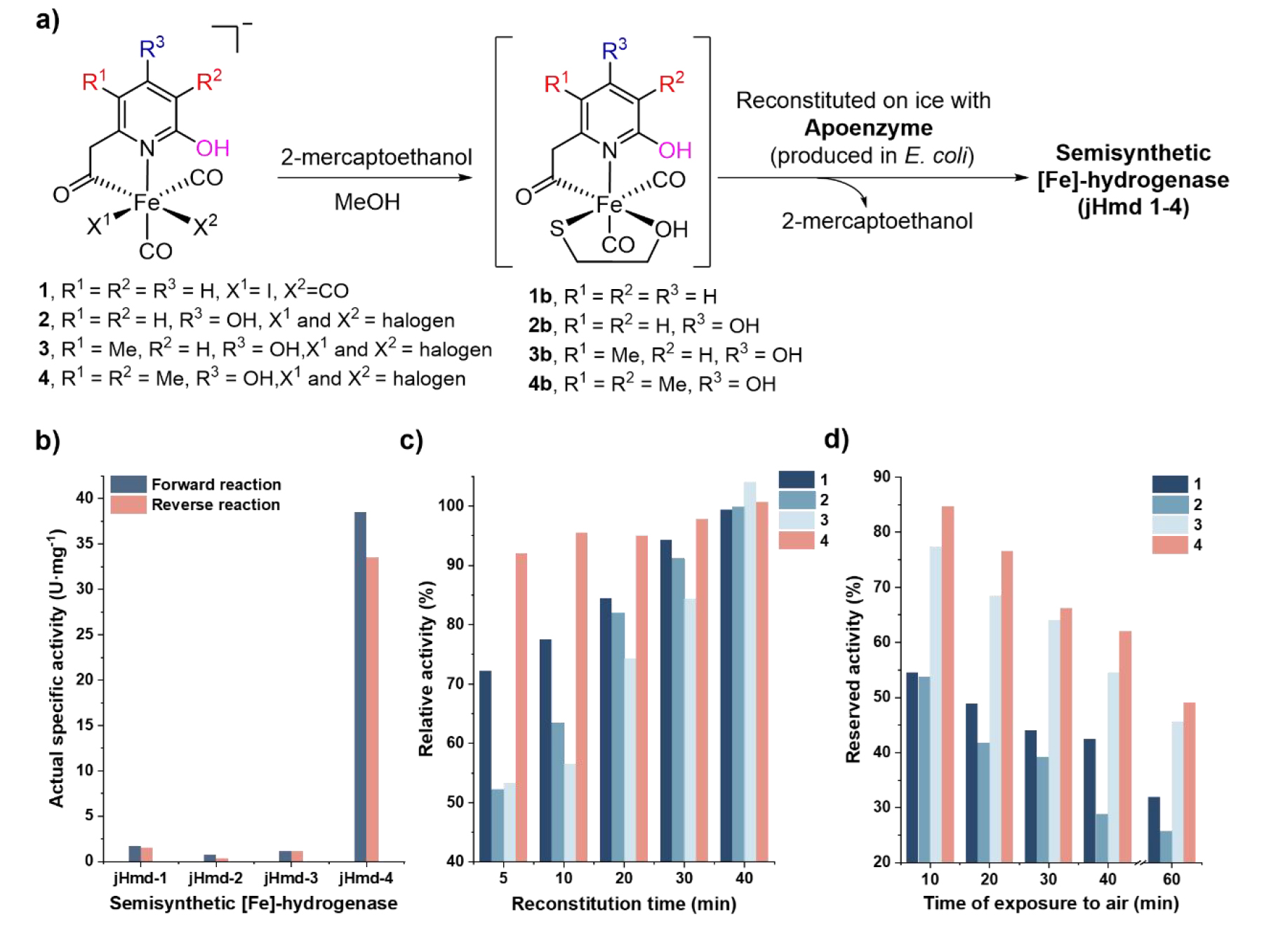
圖3. a) 重組過程示意;b) 重組酶的活性柱狀圖;c) 重組酶的活性隨重組時間的變化;d) 重組酶的活性隨暴露于空氣時間的變化。(圖片來源:J. Am. Chem. Soc.)
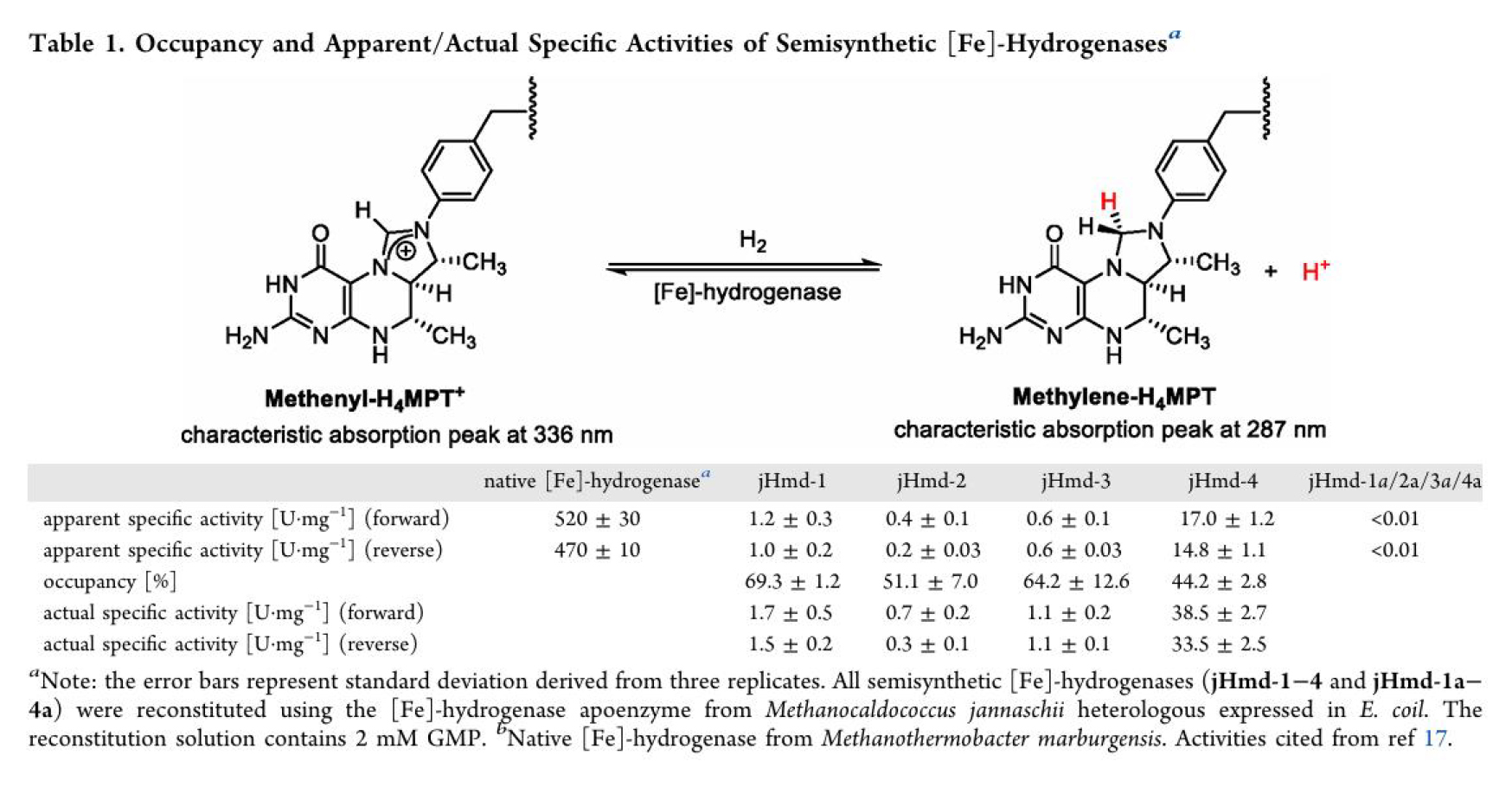
表1. 人工半合成單鐵氫酶的活性。(圖片來源:J. Am. Chem. Soc.)
隨后通過對單鐵氫酶晶體結構的分析發現,3-甲基通過范德華作用與底物(methenyl-H?MPT?)上的苯環作用,限制了金屬輔因子和底物的運動,促進了氫化物轉移。5-甲基與蛋白中 Thr177 和 Trp148 殘基形成緊密的空間相互作用,穩定了輔因子在蛋白腔中的構象,最終給活性和穩定性帶來了提升(圖4)。而4-OH 基團與鳥苷的磷酸基團存在空間排斥,最終導致了穩定性和活性的下降。
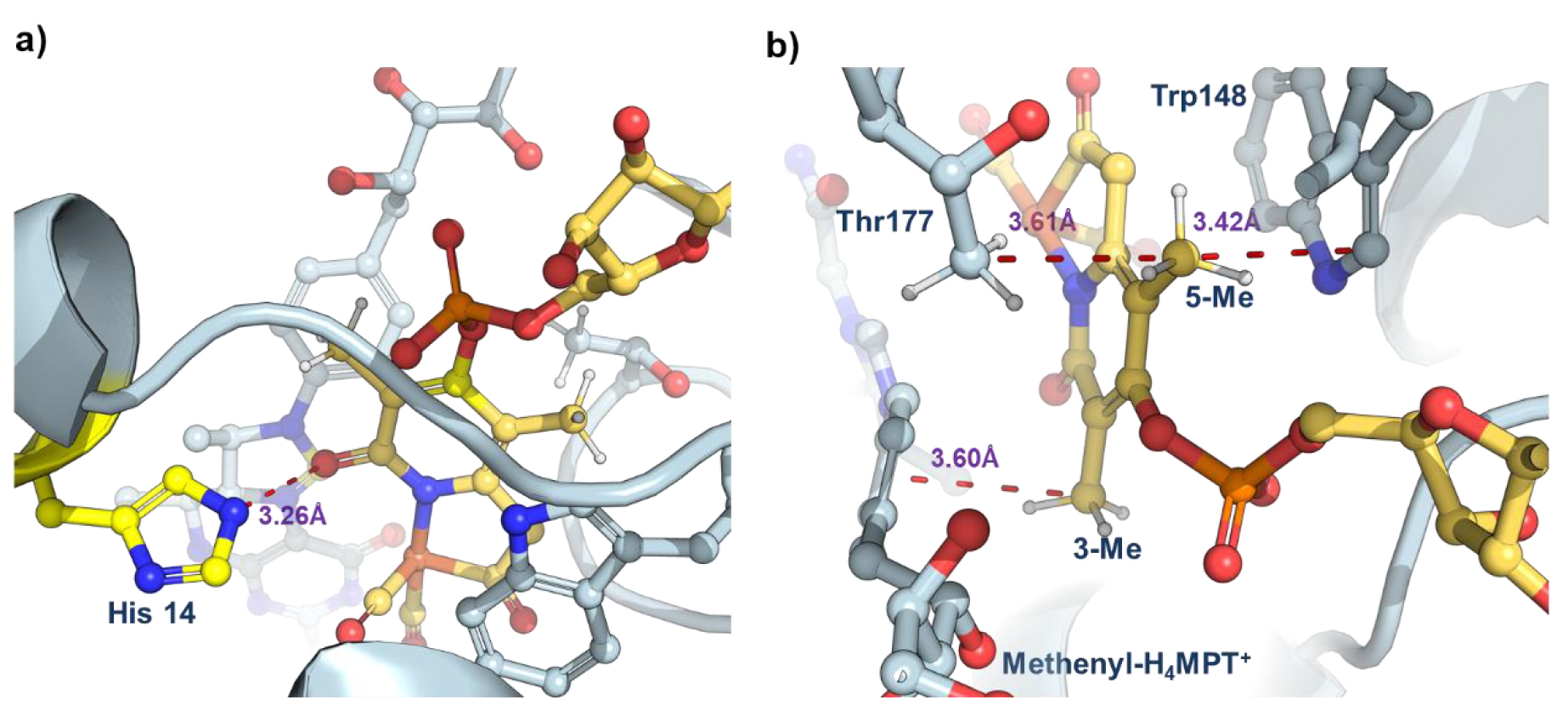
圖4. 天然單鐵氫酶的晶體結構,PDB:6HAV。(圖片來源:J. Am. Chem. Soc.)
總結
本文針對天然 FeGP 輔因子的吡啶配體,通過精準設計金屬輔因子仿生配合物的結構,首次明確了 FeGP 輔因子中兩個甲基取代基的功能分工,揭示了它們的微觀調控作用,進一步完善了天然單鐵氫酶的結構功能關系。通過人工半合成策略得到了迄今為止活性最高、穩定性最高的人工半合成單鐵氫酶,為該類酶的應用開發奠定了良好基礎。
這一成果近期發表在Journal of the American Chemical Society 上,文章第一作者為南京大學23級博士生王超,通訊作者為南京大學潘惠杰特聘研究員和西安交通大學黃鋼鋒教授。
潘惠杰特聘研究員 https://www.x-mol.com/groups/pan_huijie
黃鋼鋒教授https://gr.xjtu.edu.cn/zh/web/gangfeng.huang
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn