

(圖片來源:Nat. Chem.)
正文
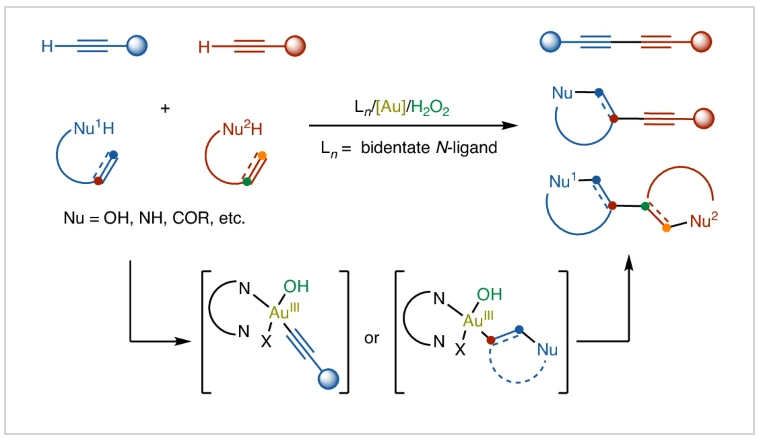
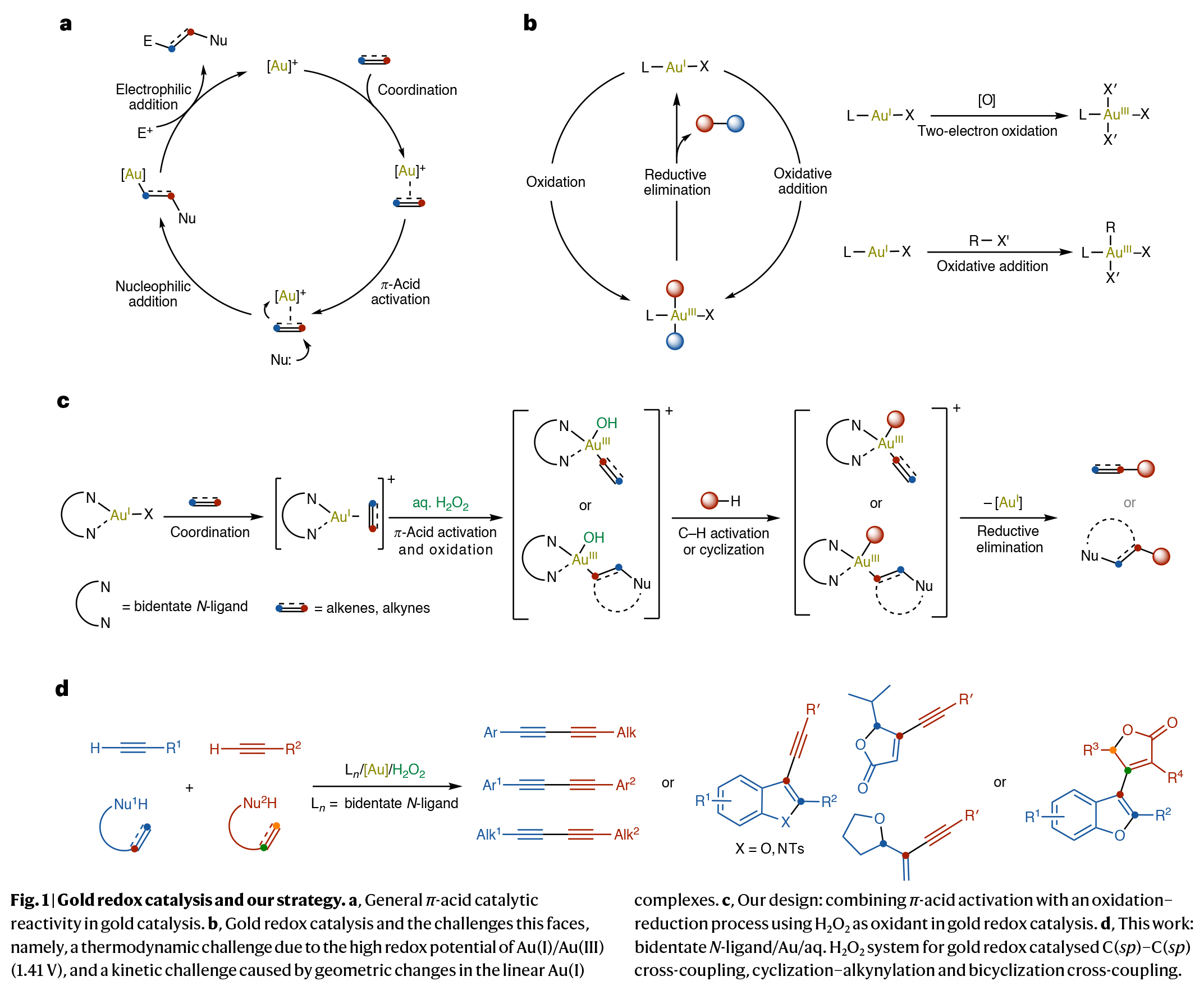
金氧化還原催化通過結合強π-酸活化與氧化還原反應,展現出相較于其他過渡金屬的獨特反應性,目前已成為極具吸引力的合成策略。然而,金氧化還原化學面臨的核心挑戰在于需克服Au(I)/Au(III)的高氧化還原電位(1.41 V)。傳統金催化氧化策略依賴強化學氧化劑,不可避免地導致原子經濟性低下及底物官能團兼容性受限。近日,德國海德堡大學A. Stephen K. Hashmi課題組與北京大學焦寧課題組聯合報道了一種利用雙齒氮配體輔助,以H2O2為氧化劑的金氧化還原催化體系,實現了多種偶聯反應,包括首次實現了C(sp2)-C(sp2)雙環化偶聯(Fig. 1)。歡迎下載化學加APP到手機桌面,合成化學產業資源聚合服務平臺。
(圖片來源:Nat. Chem.)
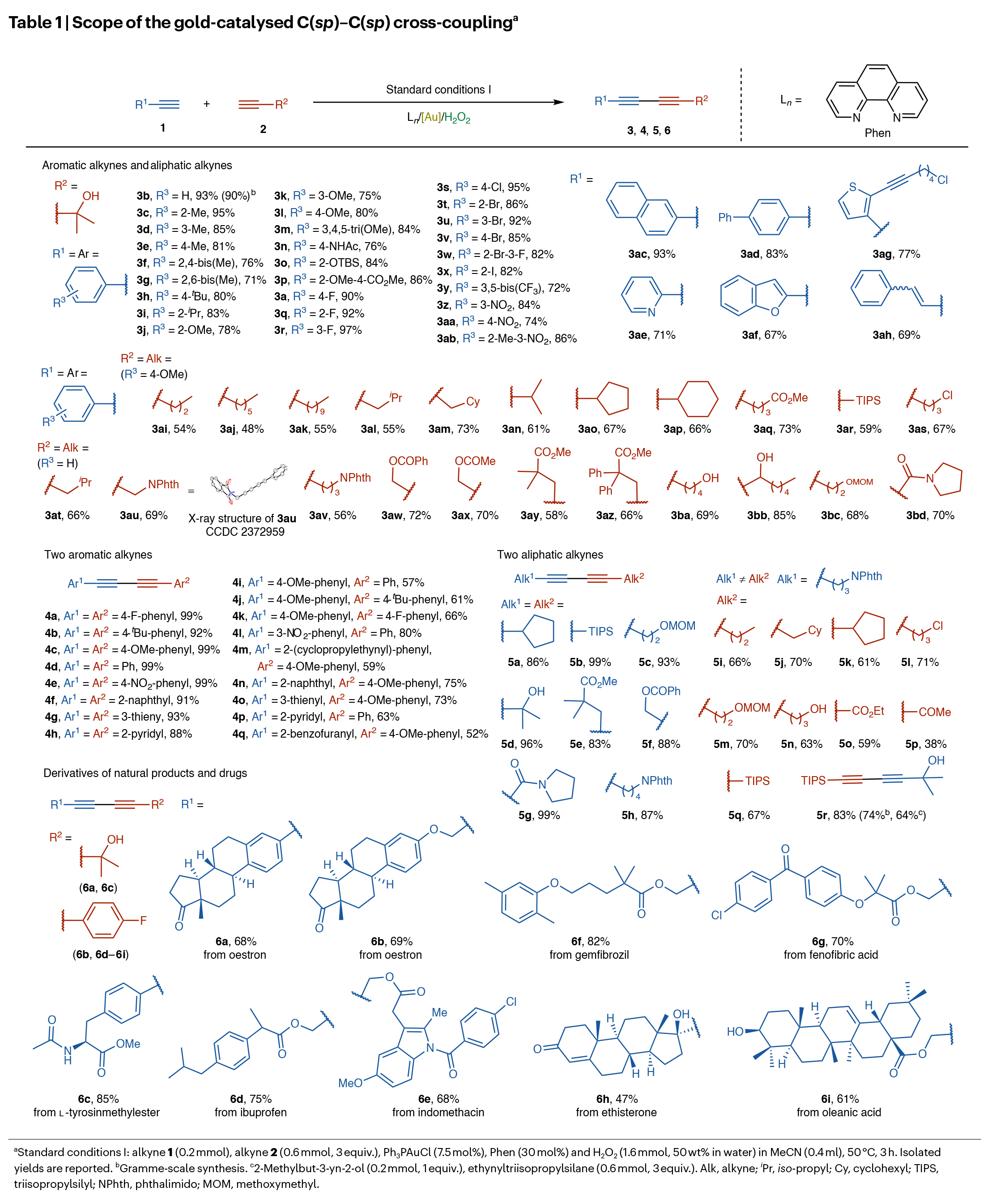
首先,作者以1-乙炔基-4-氟苯1a和2-甲基-3-丁炔-2-醇2a作為模板底物對金催化的C(sp)–C(sp)偶聯反應進行探索。通過一系列條件篩選,作者確定1a (0.2 mmol), 2a (0.6 mmol, 3 equiv), Ph3PAuCl (7.5 mol%), Phen (30 mol%)和H2O2 (1.6 mmol, 50 wt% in water),在MeCN (0.4 ml)中50 °C反應3 h為最佳反應條件。隨后,作者對此轉化的底物范圍進行了考察(Table 1)。實驗結果表明一系列不同取代的芳香炔和脂肪炔均可順利兼容并實現轉化,以48-99%的產率得到相應的偶聯產物3a-3z, 3aa-3az, 3ba-3bd, 4a-4q, 5a-5r。此外,當將此轉化放大至克級規模時,仍可以以90%的產率得到產物3b,證明了此轉化的實用性。值得注意的是,一系列天然產物或藥物如oestron、gemfibrozil、fenofibric acid、L-tyrosinmethylester、ibuprofen、indomethacin、ethisterone、oleanic acid等均可兼容此轉化,以47-85%的產率得到相應的活性分子衍生物6a-6i。
(圖片來源:Nat. Chem.)
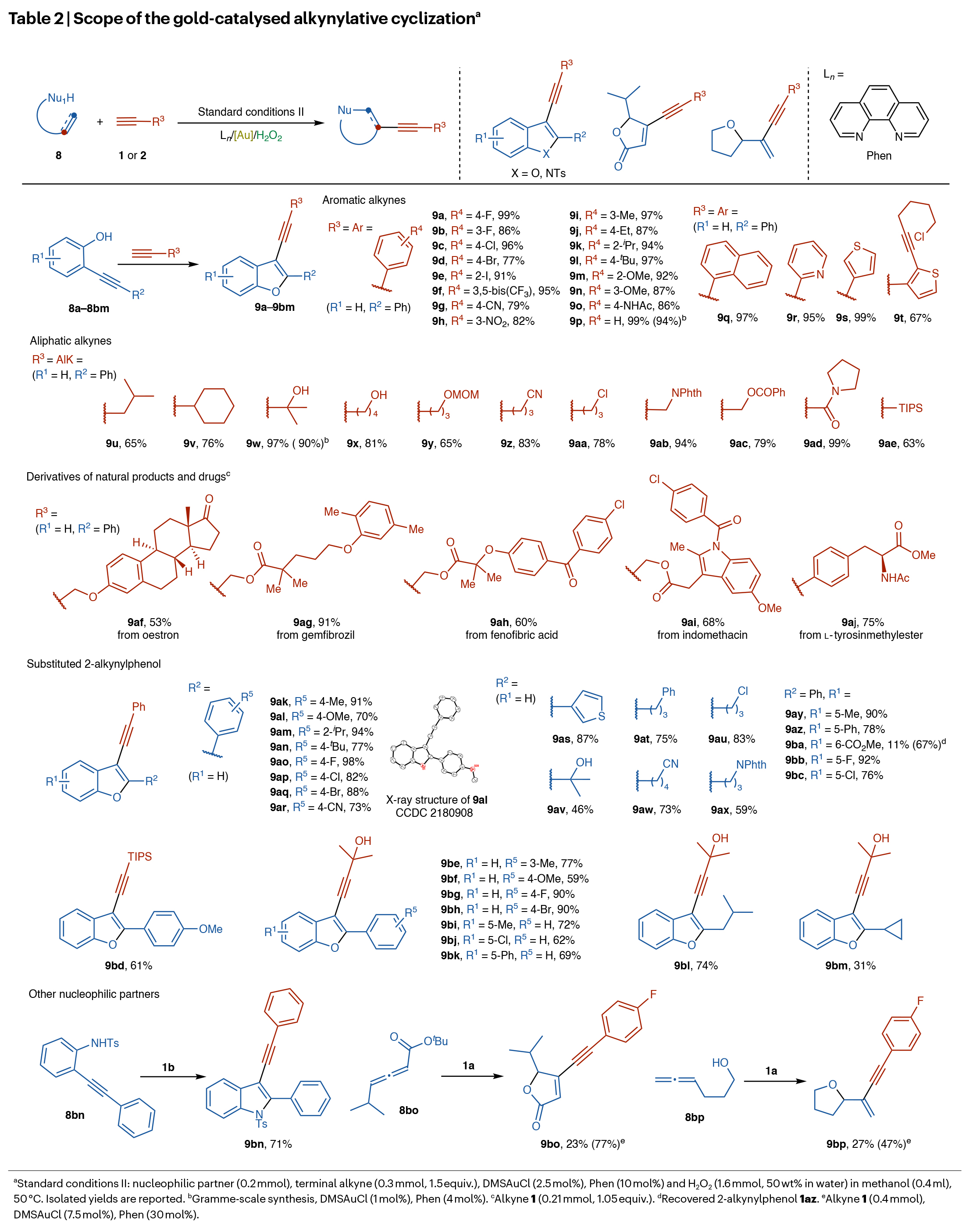
相較于其他過渡金屬,金氧化還原催化不僅能夠實現直接的C-C交叉偶聯,更能將C-C π-鍵活化與氧化還原化學相結合,從而構建具有更高合成價值的復雜分子。為驗證雙齒氮配體/Au/H2O2體系在金催化氧化還原π-鍵活化-環化-官能團化中的可行性,并證明該體系并非傳統化學氧化劑金催化策略的簡單替代方案,作者選擇末端炔烴的炔基化環化反應作為模板反應,因為該反應無法通過傳統氧化劑實現。首先,作者以2-(苯乙炔基)苯酚8a和1-乙炔基-4-氟苯1a作為模板底物對金催化的環化炔基化反應進行探索(Table 2)。通過一系列條件篩選,作者確定8 (0.2 mmol), 1a (0.3 mmol, 1.5 equiv.), DMSAuCl (2.5 mol%), Phen (10 mol%), H2O2 (1.6 mmol, 50 wt% in water),在甲醇(0.4 ml)中50 °C反應為最佳反應條件。此外,一系列芳香炔、脂肪炔以及取代的2-炔基苯酚均可順利兼容,以23-99%的產率得到相應的產物9a-9z,9aa-9bm。值得注意的是,天然產物和藥物分子同樣可以兼容,證明了此轉化的實用性。為進一步驗證雙齒氮配體/Au/H2O2體系在金催化氧化還原環化-官能團化中的普適性,作者還測試了其他親核試劑。在標準條件下,2-炔基對甲苯磺酰苯胺、聯烯酸叔丁酯及聯烯基醇作為親核試劑,成功生成相應的炔基化環化產物(9bn-9bp)。此外,作者還考察了氮、氧及碳基親核試劑,但均未檢測到炔基化環化產物的生成。
(圖片來源:Nat. Chem.)
金催化的雙環化偶聯可以顯著提升合成效率,為構建更復雜分子提供新途徑。然而,金中間體的質子化與自偶聯等競爭反應使該過程極具挑戰性,目前尚未見金催化選擇性雙環化/交叉偶聯的報道。為驗證雙齒氮配體/Au/H2O2體系的高反應活性,作者將其成功應用于更具挑戰性的雙環化偶聯反應,且同樣具有良好的普適性(Table 3)。
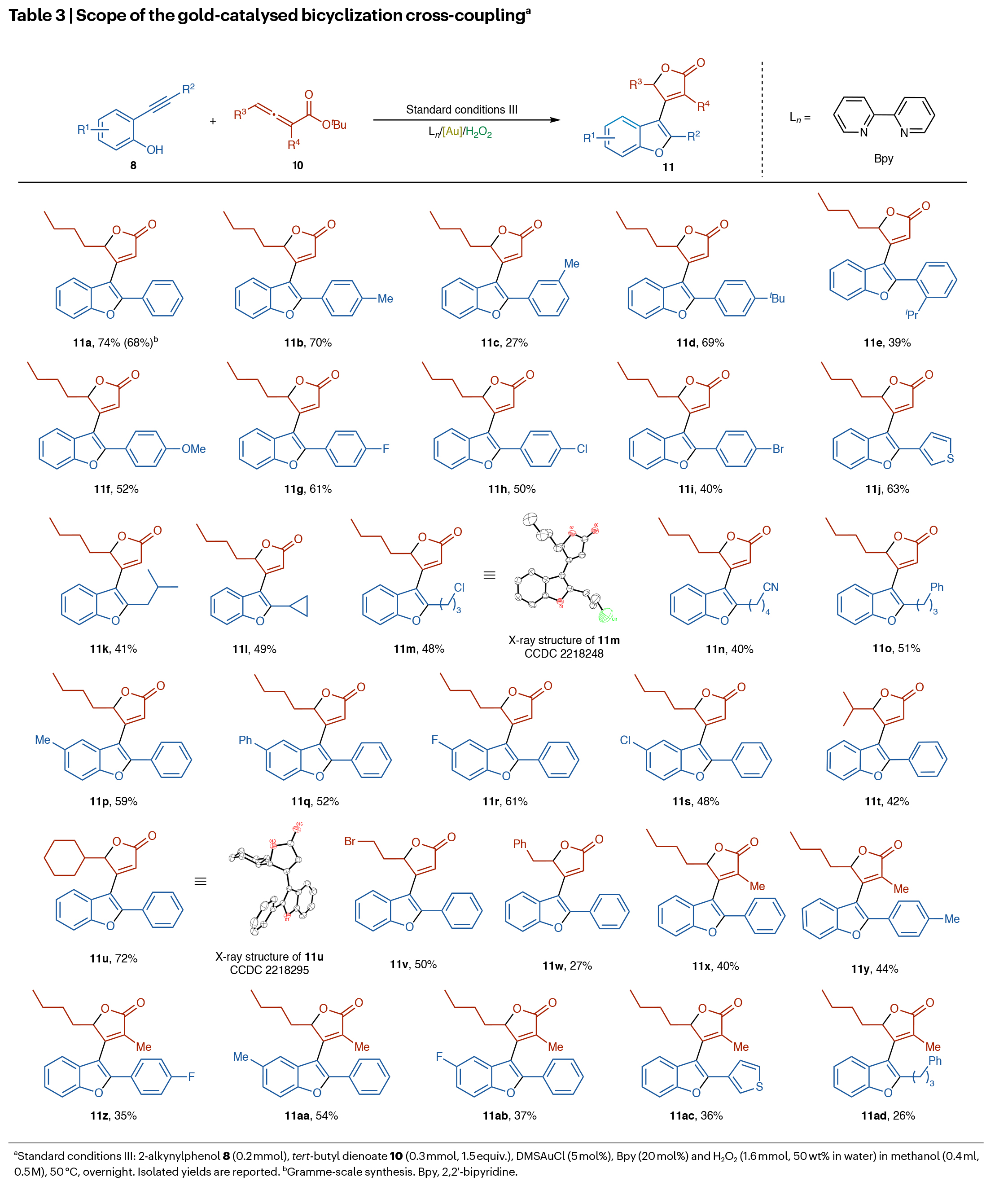
(圖片來源:Nat. Chem.)
接下來,為了證明此轉化的實用性,作者進行了一系列合成應用(Fig. 2)。首先,利用該體系可高效應用于多炔類化合物的合成(Fig. 2a)。此外,利用金催化的環化炔基化反應所引入的炔基官能團可以為苯并呋喃骨架的后續結構改造提供了便捷,極大拓展了其應用潛力(Fig. 2b)。此外,產物的1,3-二炔結構展現出卓越的衍生潛力,其可以與不同親核試劑發生環加成制得呋喃、噻吩、吡咯及吡啶等雜環,還可以與羥胺鹽酸鹽或水合肼反應則生成1H-吡唑和異噁唑(Fig. 2c)。最后,作者對產物11a進行了一系列后期修飾,進一步證明了此轉化的實用性(Fig. 2d)。
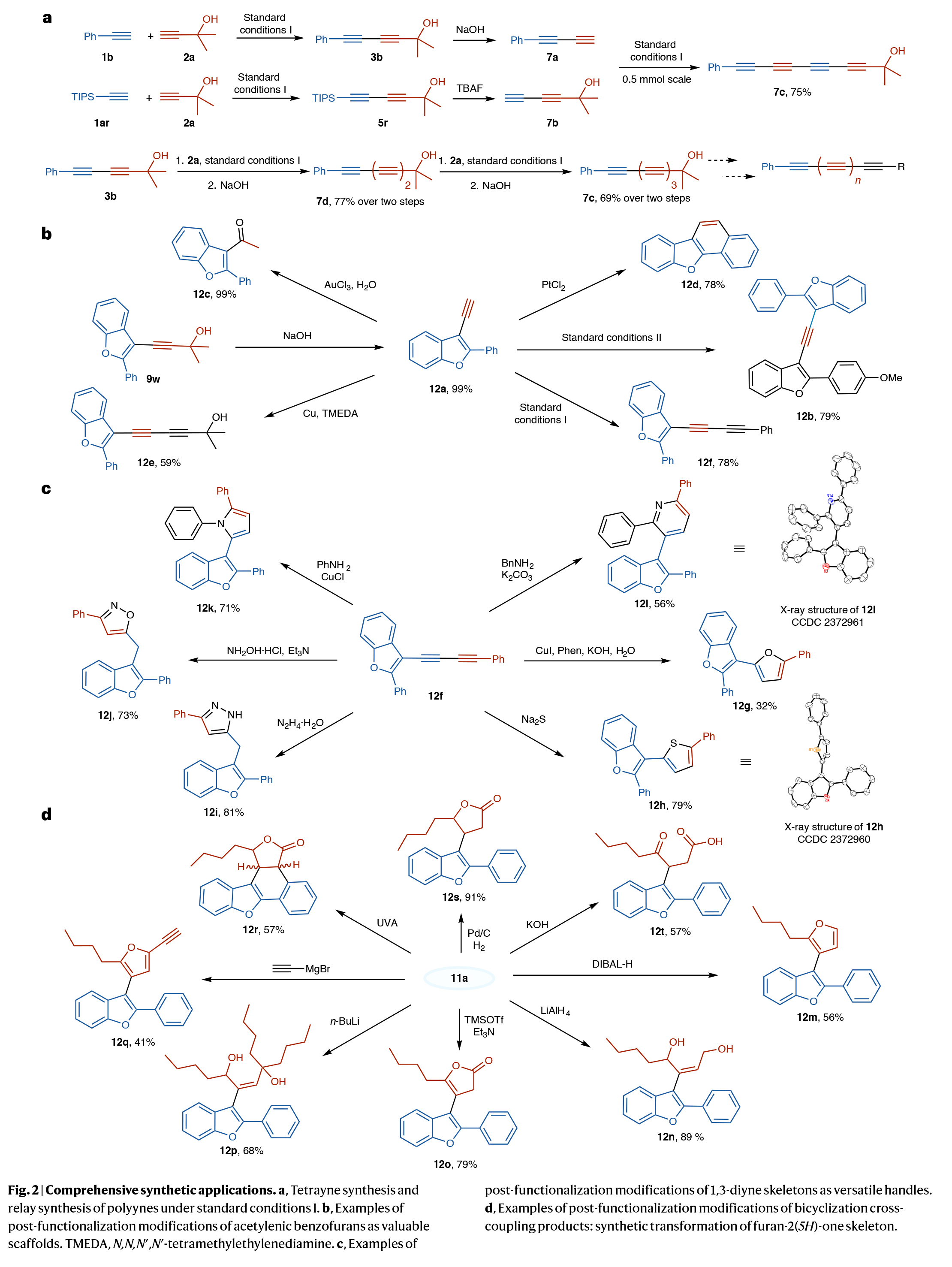
(圖片來源:Nat. Chem.)
為了探究金催化H2O2氧化還原反應機制,作者開展了系統的機理研究(Fig. 3)。在金催化炔基化環化反應中,存在生成烯基-Au(III)與炔基-Au(III)中間體的雙路徑。如Fig.3a所示,當僅添加DMSAuCl時,僅檢測到微量13a;在標準條件II下,可以以92%的產率得到苯并呋喃產物7a;而用H2O代替H2O2則反應效率顯著降低,表明反應經由烯基-Au(III)中間體進行,且質子化速率遠低于炔基化速率。
雖然Au(I)炔化物在弱堿性條件下易形成,但考慮到本體系使用4當量吡啶類配體可能發揮堿的作用,作者通過對照實驗排除了炔基- Au(I)中間體路徑:如Fig. 3b所示,標準條件II下化學計量的炔基-Au(I) 13e與底物8a和1r反應,產物9b(78%)遠多于9a(6%),證實反應不涉及炔基-Au (I)的原位生成(路徑A)。ESI-MS直接檢測到金物種I-VIII,揭示炔基- Au (III) III與烯基- Au (III) VI的形成包含π-鍵活化與Au(I)氧化的協同過程,而關鍵Au(III)物種VIII連接了炔基化/環化與還原消除步驟。該體系中金中心與C-C π-鍵的弱配位是關鍵步驟。
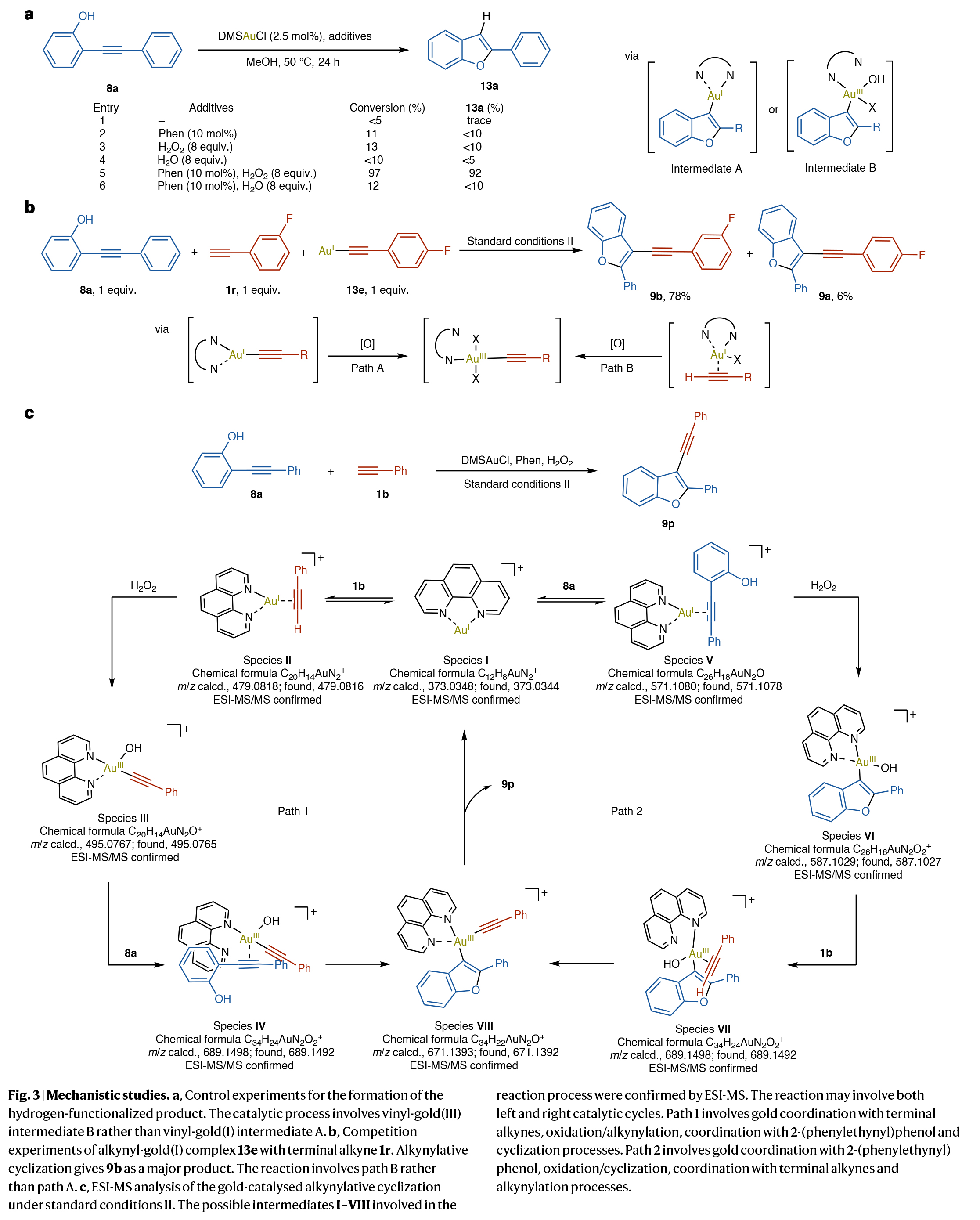
(圖片來源:Nat. Chem.)
基于上述機理研究,作者提出了可能的催化循環(Fig. 4):金催化環化炔基化反應始于Au(I)物種I與炔烴的弱配位,形成Au(I)中間體II或V,隨后被H2O2氧化為炔基-Au(III)物種III或烯基-Au(III)物種VI。Au(III)中心進一步與炔烴配位生成Au(III)物種IV或VII,經炔基化或環化得到Au(III)物種VIII,最終通過還原消除得到炔基化產物9并再生催化劑。
對于金催化的C(sp)-C(sp)交叉偶聯,由Au(I)物種I形成的Au(III)物種III通過與另一分子炔烴配位產生中間體IX,經炔基化形成Au(III)物種X后還原消除生成1,3-二炔。值得注意的是,金物種IX和X已通過ESI-MS得到驗證。不同末端炔烴(如芳香炔、脂肪炔)形成Au(III)物種III的速率各異,但反應選擇性無顯著差異。
在金催化雙環化交叉偶聯中,Au(I)物種I經環化與氧化生成Au(III)物種VI,其金(III)中心與另一環化配偶體經過弱配位形成Au(III)物種XI,后經二次環化產生Au(III)物種XII,最終還原消除得到雙環化偶聯產物11。此外,Au(I)物種I與另一環化配偶體也可通過環化/氧化過程直接生成Au(III)物種VIII,繼而經相同途徑轉化為XII。
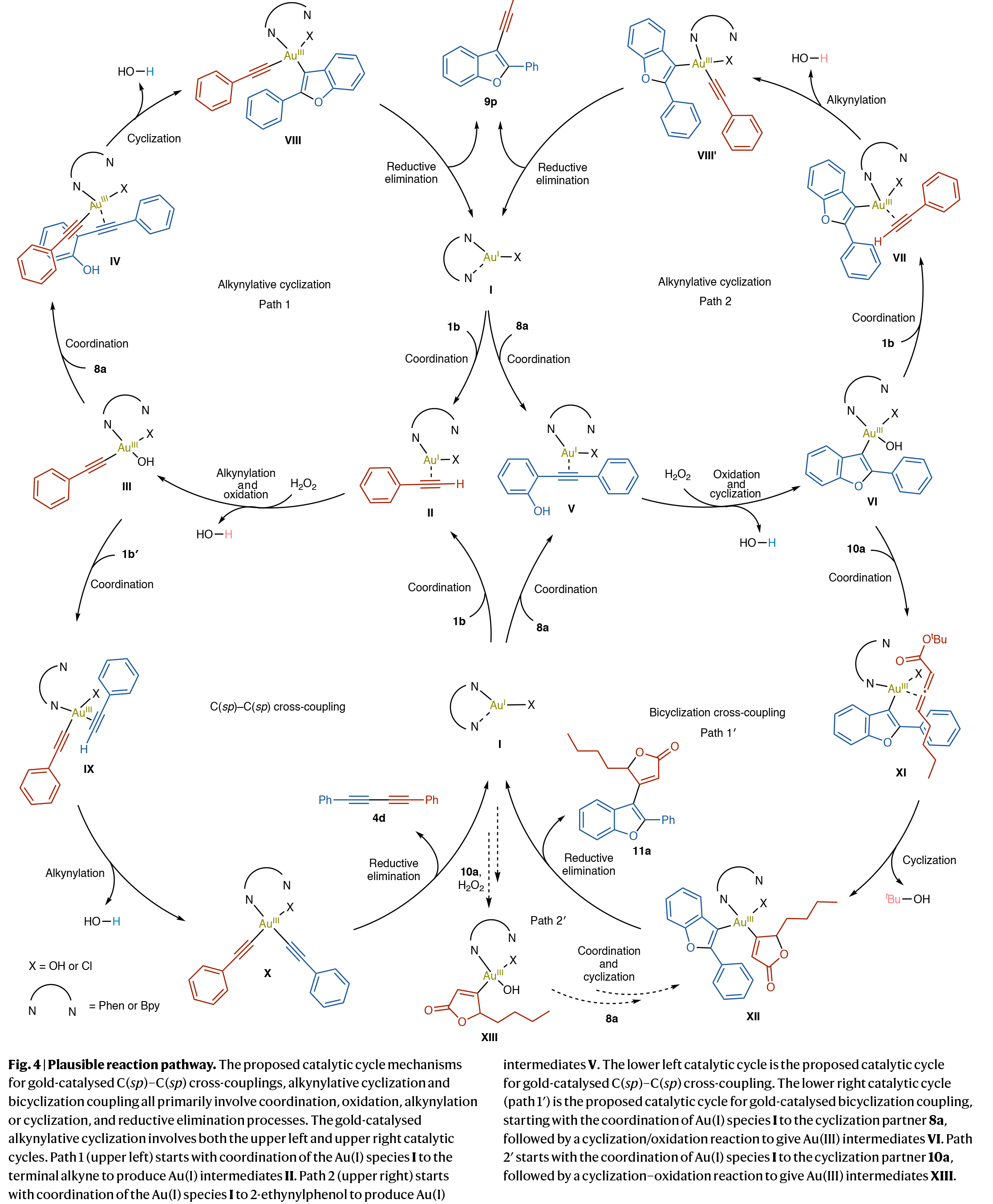
(圖片來源:Nat. Chem.)
總結
A. Stephen K. Hashmi課題組與焦寧課題組聯合發展了一種雙齒N-配體/Au/H2O2體系用于金氧化還原催化,它不僅是常見方法的替代方法,而且為金催化提供了獨特的工具。簡單的雙齒N-配體和金催化劑與綠色且低成本的氧化劑相結合,使得這種金氧化還原催化系統適用于多種偶聯反應,包括C(sp)-C(sp)交叉偶聯、C(sp2)-C(sp)環化偶聯和C(sp2)-C(sp2)雙環化偶聯。此轉化具有高原子經濟性、低合成成本、溫和的反應條件、顯著的選擇性、廣泛的底物范圍和良好的官能團耐受性等優點,展示了此體系在金氧化還原催化中的巨大潛力。克級規模合成和豐富的合成轉化證實了這些金催化的偶聯反應在合成應用中的前景。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn