

自從 Norris、Kehrmann和Wentzel 開創性地發現三苯甲基碳正離子以來,碳正離子化學取得了顯著進展。碳正離子現已廣泛應用于藥物合成、農用化學品開發、材料科學和天然產物合成,彰顯了其在現代有機化學中的關鍵作用。然而,不對稱催化碳正離子轉化的研究相對滯后,大多數研究集中在對映選擇性單分子親核取代 (SN1) 反應(圖1a)上。碳正離子重排為構建復雜的分子骨架提供了一種通用且高效的策略。盡管這些反應具有實用性,但實現對這些反應的選擇性控制,比如化學選擇性、區域選擇性,尤其是對映選擇性,仍然是催化體系中的一個基本挑戰。這一挑戰源于碳正離子中間體固有的高能量狀態和快速反應動力學性質,這使得實現高對映選擇性極其困難。迄今為止,催化不對稱碳正離子重排主要集中在烷基或芳基的遷移上,通常由環張力的釋放驅動。然而,由1,2-負氫遷移驅動的碳正離子重排,比烷基遷移更快,由于其快速性而面臨重大挑戰。1,2-負氫遷移反應速度極快,活化能極低(約2-4 kcal/mol),部分受超共軛作用促進,使其反應速度顯著快于SN1或E1反應。這種快速的反應性,以及較低的活化能壘,使得控制1,2-負氫遷移的立體選擇性尤為困難。因此,關于高效催化對映選擇性1,2-負氫遷移的報道極為稀少。目前唯一報道的例子是Arnold課題組報道的酶催化α-甲基苯乙烯對映選擇性anti-Markovnikov氧化反應,這突顯了此類轉化的稀有性和難度(圖1b)。
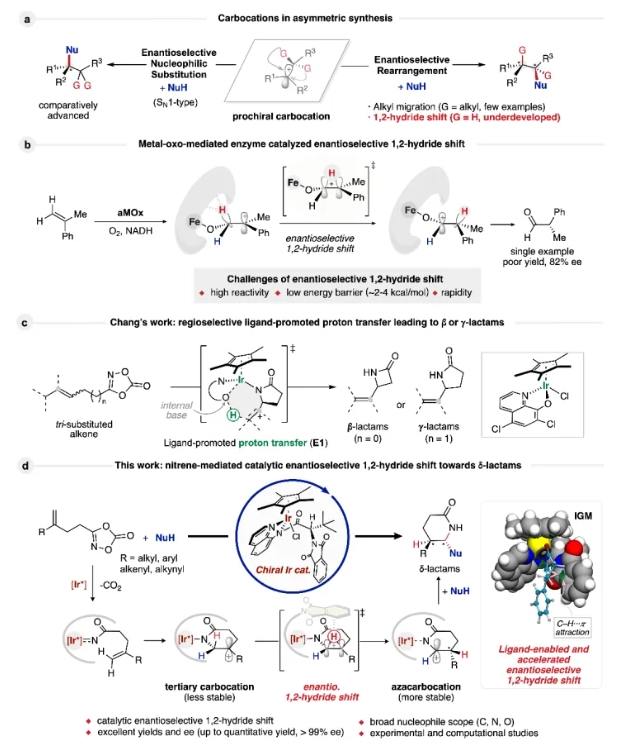
南開大學的王浩副研究員一直致力于不對稱催化與氮賓合成化學研究,1. 成功開發三類高效手性催化劑/配體體系(如手性單齒惡唑啉配體(MOX), 手性雙膦氧配體、手性tleAQ催化劑等),實現了高立體選擇性的碳氫鍵活化、非活化烯烴的不對稱官能團化等反應,推動了不對稱催化領域的發展。(Angew. Chem., Int. Ed. 2016, 55, 15387; J. Am. Chem. Soc.2018, 140, 3542; J. Am. Chem. Soc.2019, 141, 7194; J. Am. Chem. Soc.2021, 143, 1195)。2. 開發了多種新穎氮賓轉移反應,顯著提升了雜原子胺化的效率與選擇性(Nat. Chem.2021, 13, 378; Angew. Chem. Int. Ed.2024, 63, e202312465; CCS Chem. 2022, 4, 2258; Chem. Sci.2025, 16, 6458-6467; Chin. J. Org. Chem. 2021, 41, 4050.)。3. 創新性地將氮賓化學應用于多肽、糖類等復雜分子的修飾中,開發了氮賓介導的新型糖苷化方法,利用硫代糖苷作為供體,拓寬了生物活性分子的合成途徑(Sci. Adv.2025, 11, eadu7747)。
近日,南開大學王浩等人提出了一種金屬氮賓介導的策略,即通過分子內金屬氮賓與烯烴發生親電加成產生碳正離子,進而通過立體控制的1,2-負氫遷移,從而形成更穩定的氮雜碳正離子,被親核試劑捕獲,生成具有連續γ,δ-手性中心的δ-內酰胺。該反應在溫和的條件下進行,具有優異的非對映選擇性和對映選擇性(大多數實例>95% ee,>20:1 dr,圖1d),并表現出廣泛的底物兼容性,可兼容各種碳、氮和氧親核試劑,包括生物相關分子。
首先,作者以含末端烯烴的1,4,2-二噁唑-5-酮1a為模型底物,N-甲基吲哚2a為親核試劑,使用含有L1 配體的Cp*IrL1Cl為催化劑,NaBArF4為添加劑,六氟異丙醇(HFIP)為溶劑進行初步嘗試,發現可以得到手性δ-內酰胺3 ( 52% 收率,98% ee,7:1 dr),同時伴隨著烯烴的C-H插入產物3′和HFIP的溶劑解副產物5e (entry 1)。后續作者進行了一系列溶劑、催化劑、反應溫度等條件的考察,確定了最優反應條件:1a (1.5 equiv),2a (0.2 mmol), Cp*IrL4Cl (1.5 mol%),NaBArF4 (1.5 mol%),HFIP (0.5 M),25 oC,air,5 h。
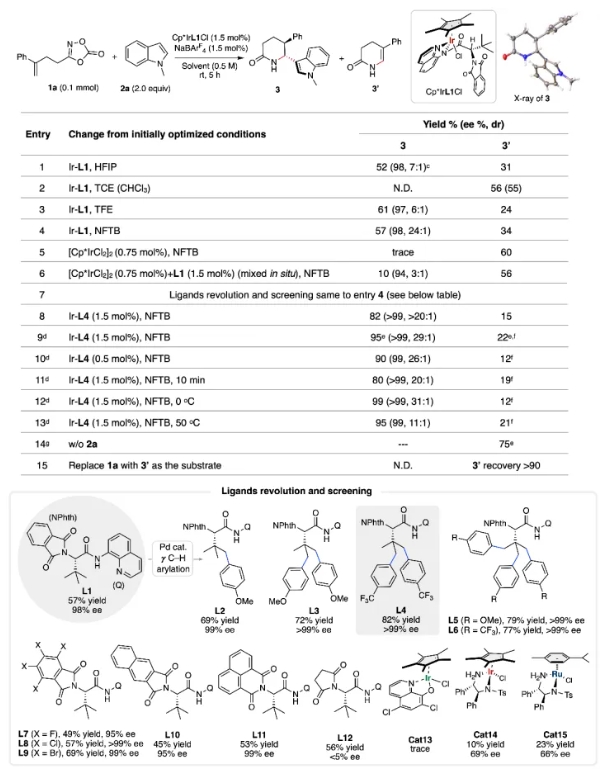
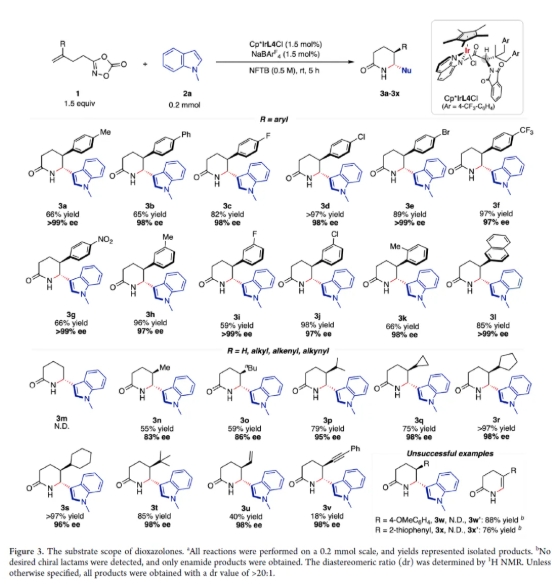
確定了最優反應條件之后,作者首先考察了二噁唑酮的底物范圍。最初,作者探索了各種γ-芳基取代的二噁唑酮底物。苯環上的對位取代基,例如-甲基、-苯基、鹵素(-F、-Cl、-Br)、-CF3和-NO2,均可得到手性內酰胺3a-3g,產物收率良好至優異,ee值高達99%,dr值>20:1。苯環上的間位取代基,例如-CH3、-F和-Cl,也可生成具有優異收率和對映選擇性的3h-3j。此外,鄰甲基苯基和2-萘基等空間位阻較大的底物,分別以66%的收率和98%的ee值、85%的收率和>99%的ee值得到產物3k-3l。隨后,作者進一步考察了γ-H和各種γ-烷基基團取代的二噁唑酮底物。當使用母體γ-H-取代的二噁唑酮底物時,反應被完全抑制。當R為甲基、正丁基、異丙基時,發現隨著R基團空間位阻的增加,內酰胺3n-3p的收率和對映選擇性得到明顯提高。這些結果表明,R基團的空間位阻會影響反應性和立體選擇性,從而凸顯了烯烴空間位阻在碳正離子中間體形成過程中的關鍵作用。令人驚訝的是,進一步將R基團的范圍擴大到環烷烴取代基,例如環丙基、環戊基和環己基,也可以得到目標產物3q-3s,產率為75%?>97%,ee值均為96?98%。當R基團為叔丁基時,反應得到3t,產率為85%,ee值為98%,這表明較大的R基團可以增強反應性和立體選擇性,猜測可能起到了穩定碳正離子中間體的作用。此外,該催化體系兼容帶有γ-烯烴和γ-炔烴的二噁唑酮底物。
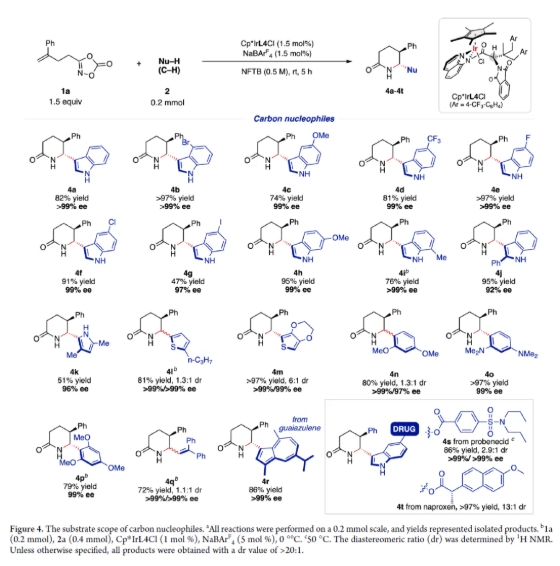
接下來,作者對各類親核試劑進行了考察。首先研究了碳親核試劑。如圖4所示,各種吲哚衍生物、富電子(雜)芳環化合物、富電子芳烴以及富電子烯烴以中等至良好的收率得到內酰胺4a-4r,并具有優異的非對映選擇性(>20:1 dr)和對映選擇性(92%-99% ee)。值得注意的是,藥物分子丙磺舒和萘普生衍生的5-取代吲哚底物也具有良好的耐受性,以中等至優異的收率和非對映選擇性得到目標產物4s和4t。
隨后,作者考察了氧親核試劑(圖5)。在標準條件下,使用甲醇、氘代甲醇、乙醇、水及HFIP,均可得到目標產物5a-5e,產率中等,且具有優異的對映選擇性(93%-99% ee)。值得注意的是,酚類衍生物作為親核試劑,生成O-進攻的產物5f-5i,產率中等至優異,且均具有> 99% ee和> 20:1 dr。此外,該反應兼容含醇羥基的底物,以優異的非對映選擇性得到內酰胺5j-5m。最后,作者對氮親核試劑進行了考察。3-取代吲哚,二級芳胺類親核試劑均可以以良好到優異的收率得到5n-5t, 且具有優異的對映選擇性。令人鼓舞的是,基于色氨酸的二肽5u和三肽5v分別以45%和40%的產率得到目標產物,且具有良好至優異的非對映選擇性。這種催化方法為多肽化學中色氨酸殘基的選擇性修飾提供了一種有前景的方法,凸顯了其在生物共軛和藥物化學中的潛在應用。
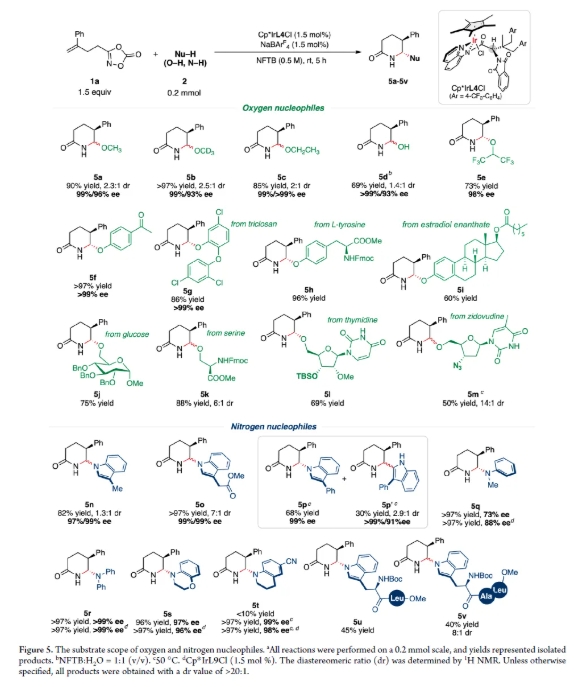
為了證明該方法的實用性,作者首先進行了克級實驗,得到1.93 g化合物3(圖6)。通過一系列轉化,證明了化合物3的多功能性。在KOH/MeI條件下,化合物3發生甲基化,得到產物6a,產率接近定量,且ee值沒有損失。此外,使用BH3·THF還原化合物3幾乎以定量的收率和97% ee得到產物6b。化合物3在Pd2(dba)3催化的Buchwald-Hartwig偶聯反應中,以86%的收率和98%的ee值生成6c。最后,在0.5當量Lawesson試劑存在下,化合物3的羰基被轉化為硫代羰基,得到產物6d,收率80%,ee值98%。這些轉化突顯了δ-內酰胺產物的穩定性和合成實用性。
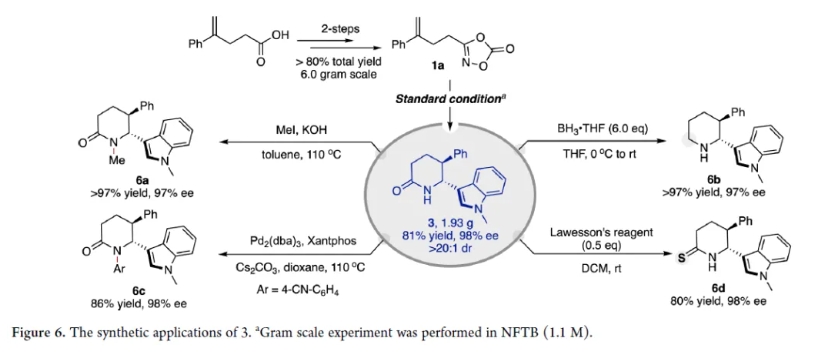
為了探究反應機理,作者首先進行了機理實驗。如圖7a所示,在標準條件下,目標產物3-d的收率>97%,ee值為99%。3-d的1H NMR譜證實了50%的氘原子在N-α-D和芐基位置,表明3的生成涉及1,2-負氫遷移。此外,動力學同位素實驗 (KIE)(圖 7b)表明 KIE ~ 1.0,表明1,2-負氫遷移不是速率控制步驟。交叉實驗(圖 7c)表明,無論是NFTB還是HFIP-d1作溶劑,氘的引入僅發生在3-d中,而3g保持未氘化狀態。該實驗說明1,2-負氫遷移是一個分子內過程。同樣,對于生成烯酰胺副產物的質子轉移途徑,只有3-d' 引入氘,而 3g' 保持未氘化狀態。這些結果表明質子轉移也是一個分子內過程,并且是不可逆的。
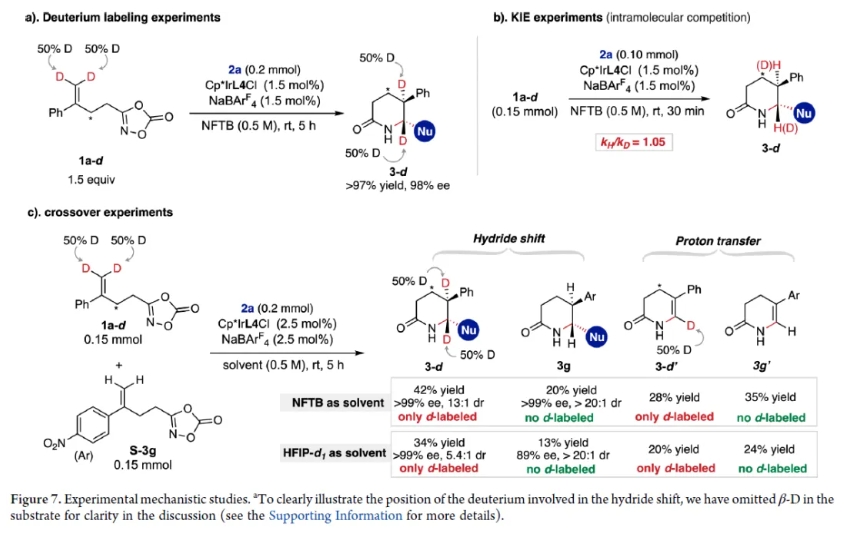
最后,作者以二噁唑酮1a為底物、N-甲基吲哚2a為親核試劑、Cp*IrL1Cl為催化劑,進行了密度泛函理論(DFT)計算(圖8)。提出的催化循環(圖8a)始于從催化劑中攫取Cl陰離子,形成活性催化物種陽離子銥配合物[Ir]。該物種與1a配位生成中間體IrD,IrD經過過渡態IrD-TS? (ΔG? = 22.6 kcal/mol)脫去一分子CO2,生成Ir-酰基氮賓IrN復合物。然后與烯烴發生分子內親電加成,通過TS1?(ΔG? = 11.1 kcal/mol)形成芐基碳正離子中間體IM1(ΔG = ?21.9 kcal/mol)。隨后,在特制的手性疏水微環境中,底物采取有利的構象,使C-H鍵與芐基碳正離子的空p軌道對齊,從而促進高度對映選擇性、協同的1,2-負氫遷移產生氮雜碳正離子IM2。S構型((S)-TS2?, ΔG? = ?19.9 kcal/mol)的過渡態能量比相應的R構型((R)-TS2?, ΔG? = ?17.1 kcal/mol)低2.8 kcal/mol,與實驗觀察到的>99% ee值一致。對(S)-TS2?的非共價相互作用 (NCI) 分析突出了催化劑NPhth基團與氫化物之間的關鍵C?H···π相互作用 (圖 8d 和 1d (右),這顯著促進了1,2-負氫遷移。隨后,IM2與N-甲基吲哚2a發生立體選擇性親核取代反應,經歷過渡態TS3trans?(ΔG? = ?24.7 kcal/mol),得到中間體IM4trans(ΔG = ?35.0 kcal/mol)。最后,AQ配體和內酰胺中間體之間發生兩次連續的質子轉移,最終得到反式內酰胺產物(ΔG? = ?67.7 kcal/mol),并再生出Ir催化劑,從而完成了對映選擇性1,2-負氫遷移催化循環。
總結
綜上所述,作者開發了一種通過氮賓介導1,2-負氫遷移驅動的不對稱碳正離子重排反應,合成了一系列具有連續γ,δ-手性中心的δ-內酰胺。該方法不僅具有優異的收率、非對映選擇性和對映選擇性(大多數實例的ee值均超過95%),而且在溫和條件下,對各種親核試劑(包括碳、氧、氮和生物相關分子)表現出卓越的通用性。結合機理實驗和DFT計算闡明了分子內對映選擇性1,2-負氫遷移控制立體化學結果。DFT計算表明,碳正離子重排主要受吸引性非共價相互作用控制,這種相互作用促使1,2-負氫遷移途徑優于競爭性質子轉移途徑。此外,NCI分析強調NPhth結構在催化劑骨架中的關鍵作用,該結構能夠通過C?H···π相互作用實現高對映選擇性1,2-負氫遷移。該方法不僅解決了碳正離子重排化學中長期存在的挑戰,還為碳正離子化學中不對稱1,2-負氫遷移建立了一個強大且可推廣的平臺。
該研究成果近日在《美國化學會志》(J. Am. Chem. Soc.)上發表。南開大學王浩副研究員為通訊作者,2022級博士生范乾坤為第一作者,白子謙博士對此工作作出重要貢獻。衷心感謝陳弓教授和何剛教授的悉心指導。本研究得到國家科技部重點研發計劃、國家自然科學基金以及南開大學等基金的資助。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn