

(圖片來源:Nature)
正文
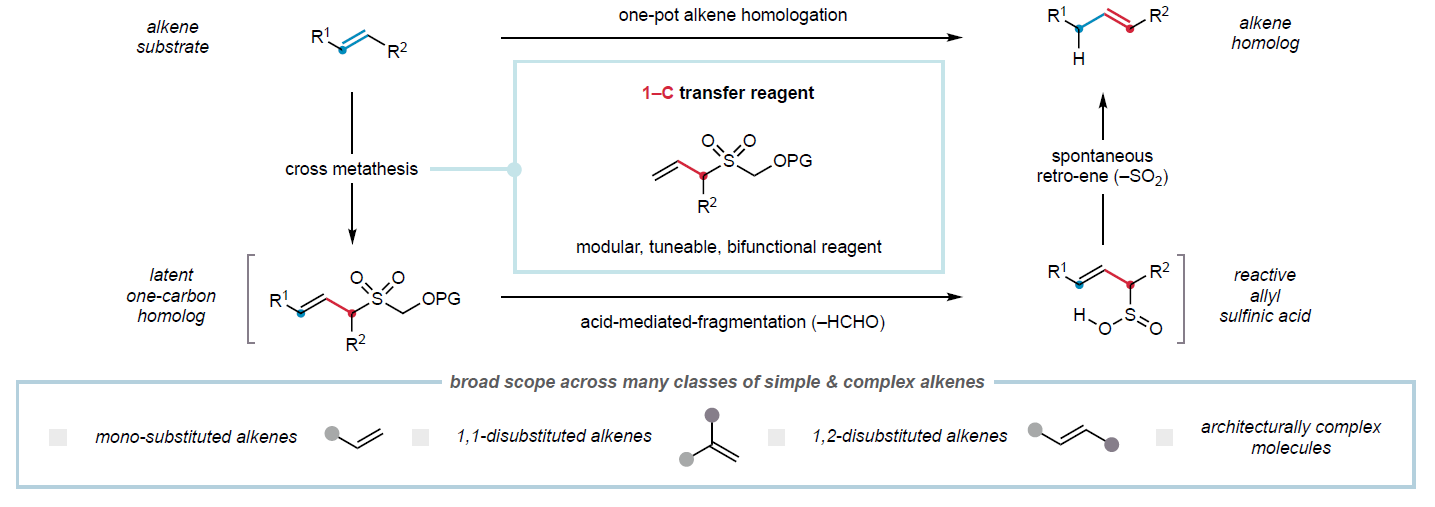
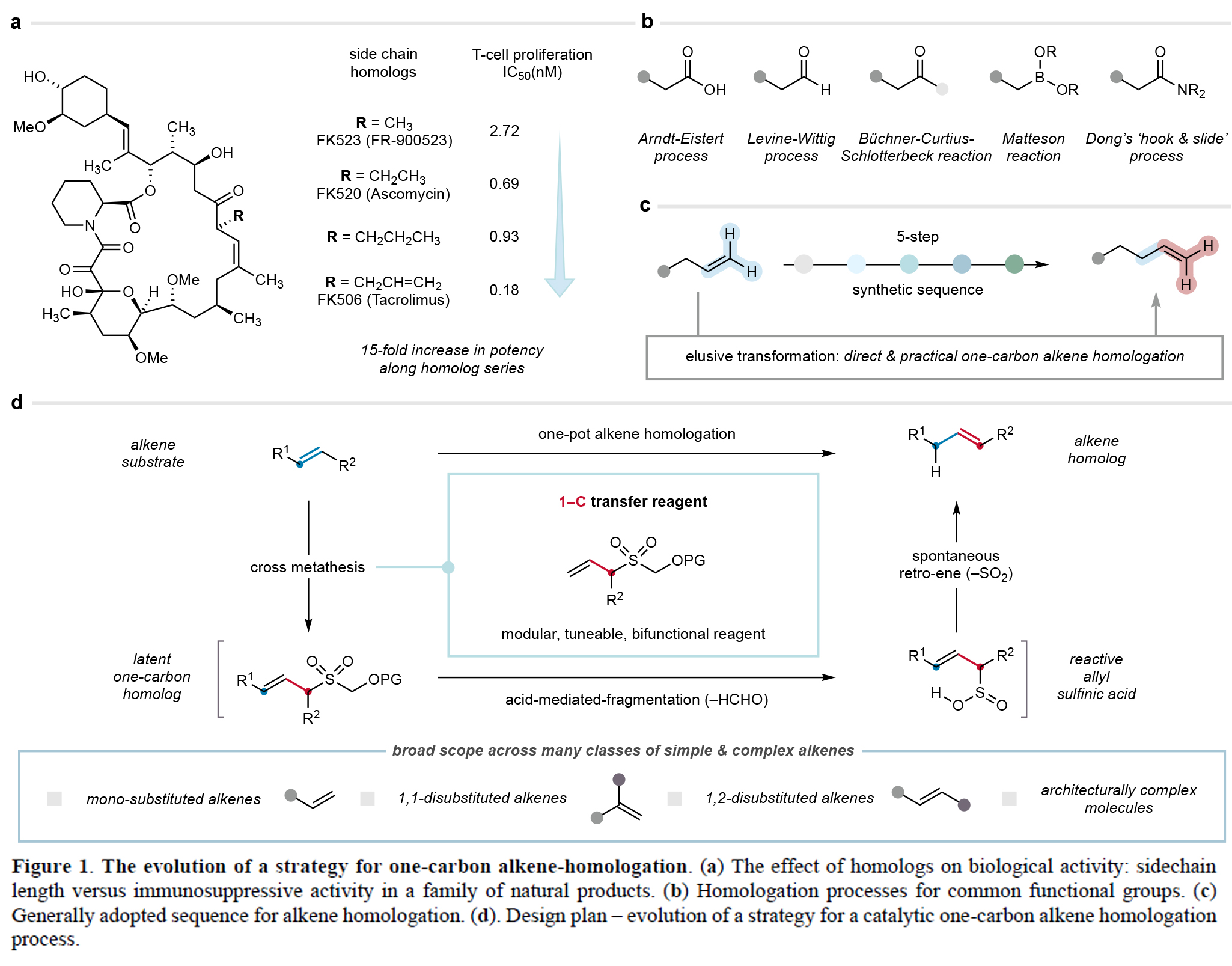
一碳同系物是指碳鏈長度相差一個亞甲基單元、結構相關且功能相似的有機分子。在藥物分子、天然產物、農用化學品、香料及石油產品等眾多類化合物中,同系物間微妙的理化性質差異可導致其功能顯著不同。因此,高效合成分子的同系物已成為分子發現計劃的重要策略。盡管目前已發展的方法可實現部分官能團的同系化,但烯烴的直接普適性碳鏈延伸策略仍未有報道。最近,英國劍橋大學Matthew J. Gaunt課題組報道了一種普適的烯烴一碳同系化方法。其利用烯丙基砜試劑,通過交叉復分解和斷裂/逆烯反應級聯實現了烯烴中亞甲基單元的形式插入。此外,該技術可成功實現cyclosporine-A的同系化,具有良好的實用價值(Figure 1)。 歡迎下載化學加APP到手機桌面,合成化學產業資源聚合服務平臺。
(圖片來源:Nature)
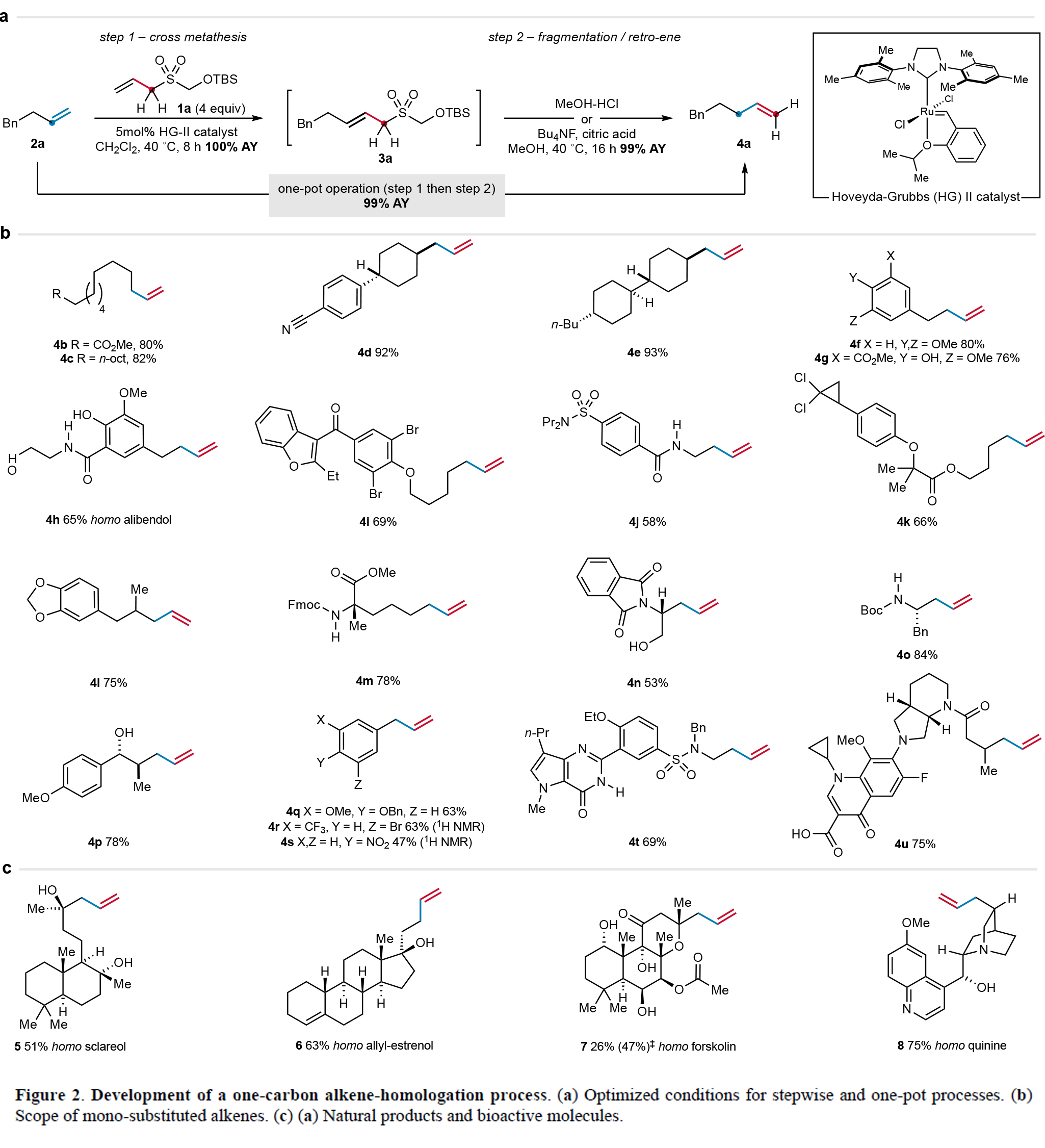
首先,作者以烯丙基砜試劑1a和烯烴2a作為模板底物對反應條件進行了考察(Figure 2a)。通過一系列條件篩選,作者發現當使用1a (4.0 equiv), 2a (1.0 equiv), Hoveyda-Grubbs二代催化劑(HG-II)(5 mol%),在DCM中,40 oC反應8小時可以得到3a。隨后在2 M MeOH-HCl溶液中攪拌16小時可以以接近定量的產率得到同系化的烯烴產物4a。
在得到了最優反應條件后,作者對此轉化的兼容性進行了考察(Figure 2b)。實驗結果表明此轉化對大多數烯烴底物有效,但對含酯基(4k)和氨基甲酸酯(4o)等酸敏感基團的烯烴,則需采用四丁基氟化銨(TBAF)和檸檬酸的溫和逆ene反應條件。其中比較典型的例子包括烯烴4p的合成,該分子若通過傳統方法需多步合成。苯乙烯類底物在改良的逆ene條件(90 oC, TFA-H2O)下可高效發生去共軛反應,生成烯丙基苯衍生物4q-4s。含氮雜環(4t)和羧酸(4u)等具有極性官能團的烯烴也能以良好收率完成一鍋法同系化,證實了該方法優異的官能團兼容性。值得注意的是,該策略成功應用于多種天然產物,包括sclareol和forskolin以及allylestrenol等均可實現同系化,以26-75%的產率得到相應的產物5-7,且這些生物活性分子的同系物均屬首次報道(Figure 2c)。
(圖片來源:Nature)
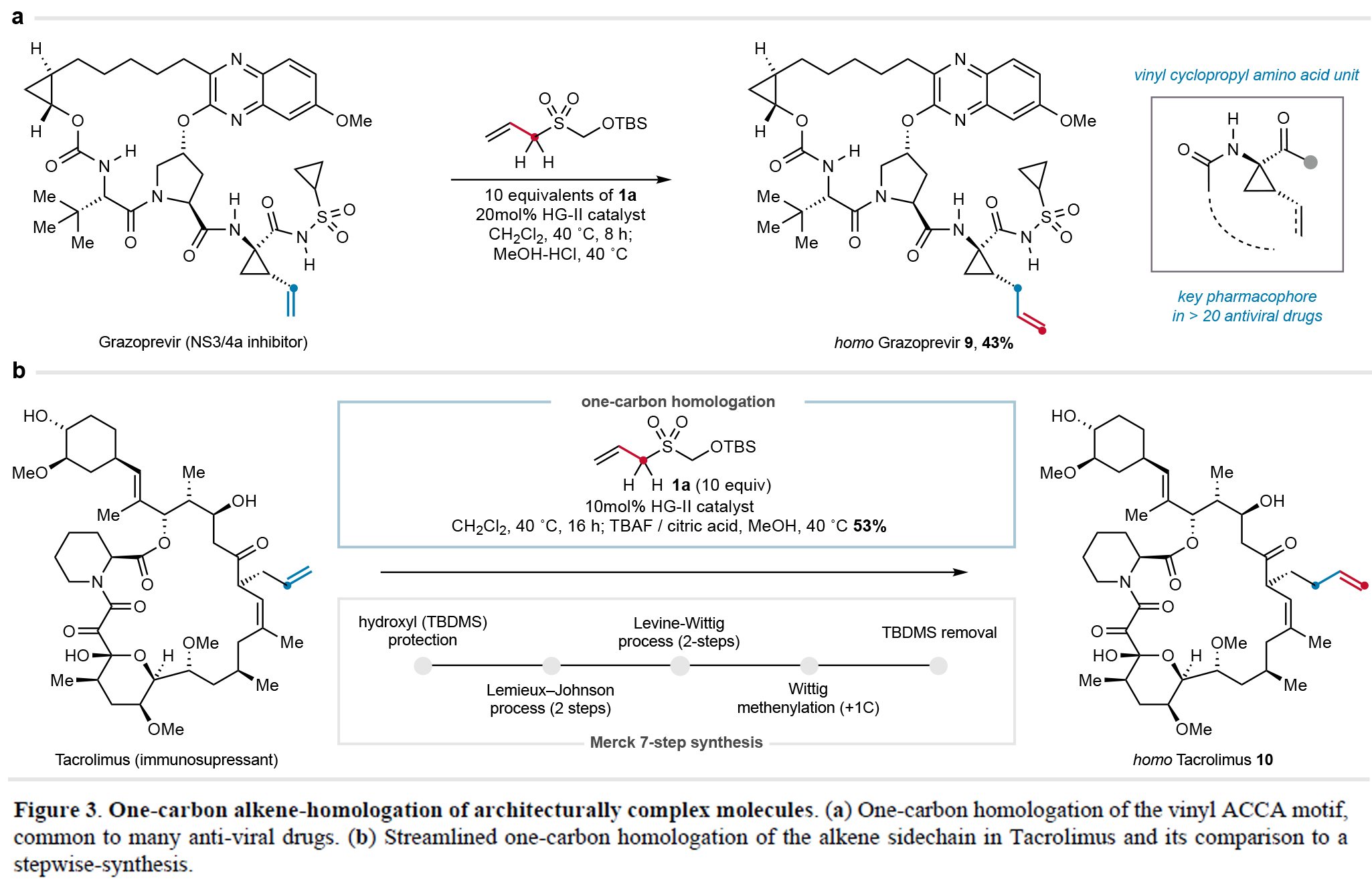
本研究成功將一碳同系化策略應用于復雜藥物分子改造,在格拉瑞韋(Grazoprevir)中實現ACCA(1-amino-2-vinyl cyclopropane-carboxamide)藥效團向烯丙基環丙烷類似物9(43%)的高效轉化,并一步完成了FK506同系物10合成(53%),較傳統7步路線顯著簡化。該策略不僅解決了特殊結構的合成難題,更為藥物結構修飾提供了高效新途徑(Figure 3)。
(圖片來源:Nature)
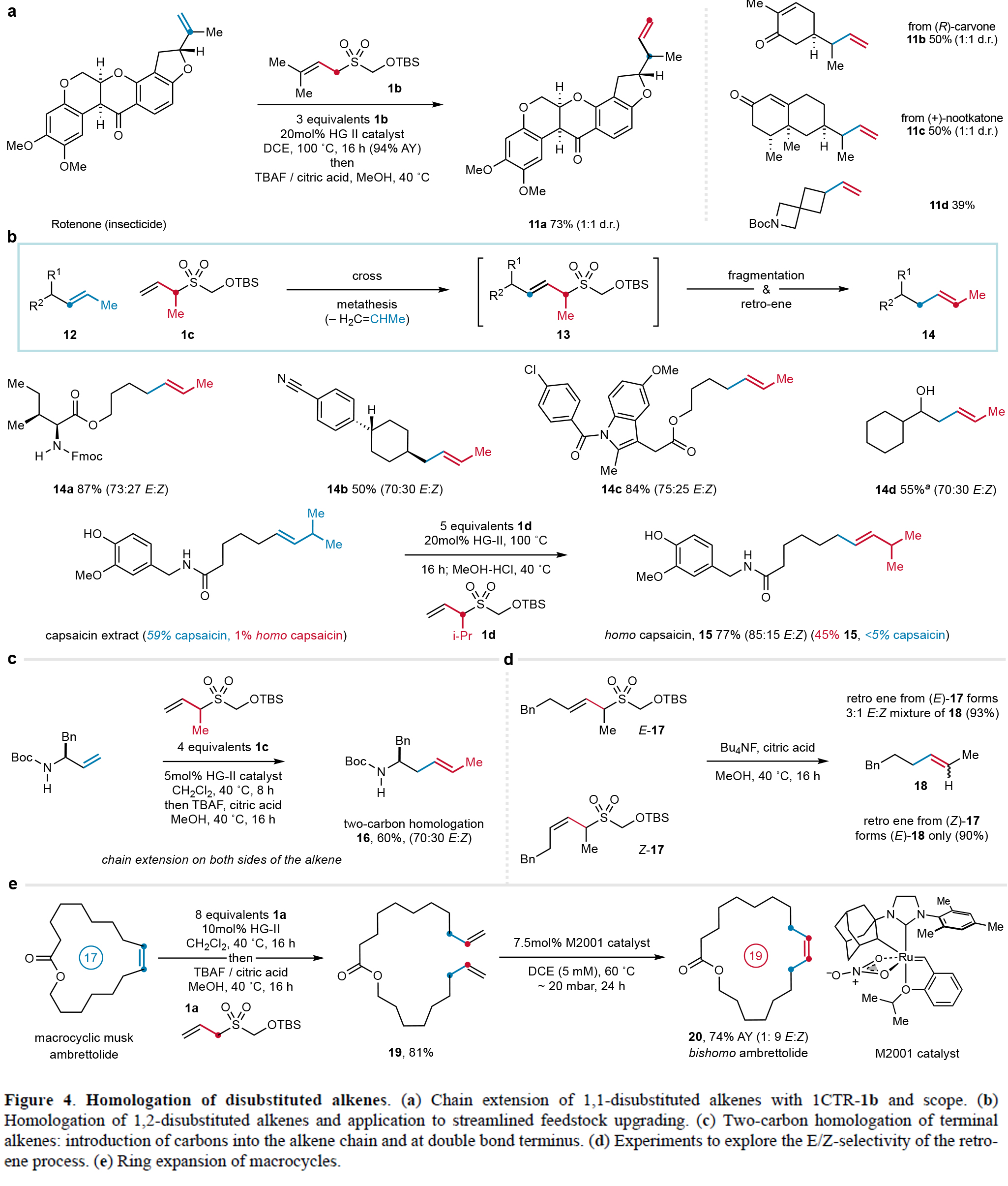
本研究成功將一碳同系化策略拓展至二取代烯烴的修飾。通過優化1CTR的結構(如引入偕二甲基),可以實現魚藤酮等1,1-二取代烯烴的高效同系化(收率最高94%),且獲得了具有農用化學品和香料應用價值的α-支鏈產物(11a-11d)。特別值得關注的是,該方法首次實現了1,2-二取代烯烴的直接同系化。利用甲基修飾的1CTR-1c與氨基酸衍生的烯烴反應,可以以87%收率(E/Z=3:1)得到內烯烴同系物14a。應用異丙基變體1CTR-1d對天然辣椒素提取物進行同系化,成功將同型辣椒素含量提升至45%(15,E/Z = 5:1),該產物較辣椒素具有顯著不同的辛辣度,在腫瘤學和鎮痛領域具有應用潛力(Figure 4)。
進一步研究表明,該策略還可實現大環烯烴的擴環。通過1CTR-1a介導的開環交叉復分解/RCM,作者可以成功將17元環內酯Ambrettolide高效轉化為19元大環20(74%),且可通過催化劑選擇調控E/Z構型。機理研究發現,逆ene反應中烯烴幾何構型不完全和前體一致,這可能與過渡態中1,3-雙直立鍵相互作用有關(Figure 4)。
(圖片來源:Nature)
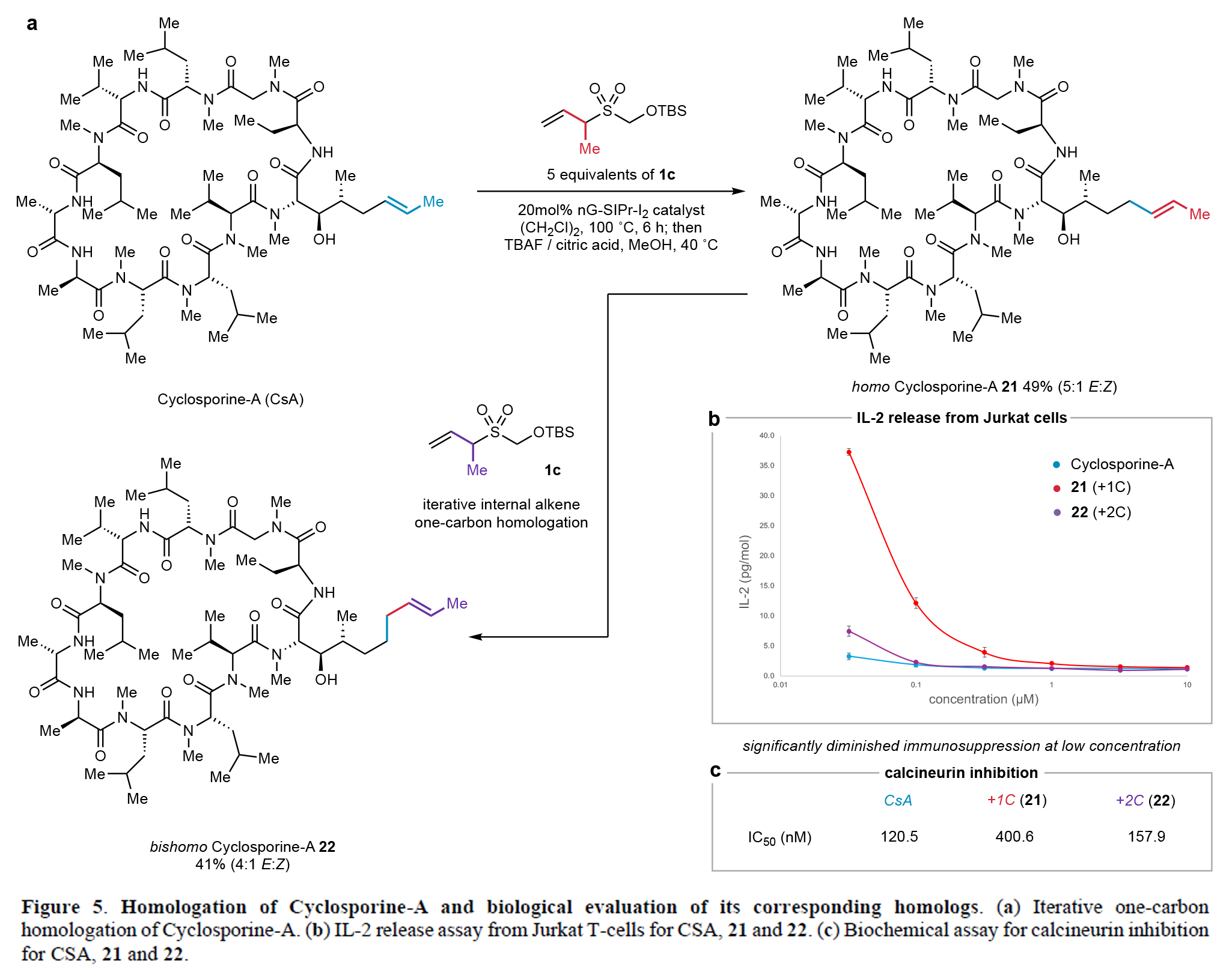
此外,此一碳同系化策略可成功應用于cyclosporine-A的結構改造(Figure 5)。通過優化1CTR-1c的反應條件,作者實現了該免疫抑制大環肽烯烴側鏈的一碳(21)和兩碳延伸(22),產物均以良好收率及E-構型選擇性獲得(Figure 5a)。生物學評價顯示,在 ≤ 320 nM濃度下,一碳同系物21的免疫抑制活性較母體降低13倍,其與cyclophilin-A形成的二元復合物對鈣調磷酸酶(calcineurin)的抑制活性也減弱3.5倍(Figure 5b,5c)。而兩碳同系物22則保持了與cyclophilin-A相當的活性。這些發現表明,通過精確調控烯烴側鏈長度可選擇性改變三元復合物的相互作用強度,為開發具有差異免疫抑制活性的cyclosporine類似物提供了新的策略。
(圖片來源:Nature)
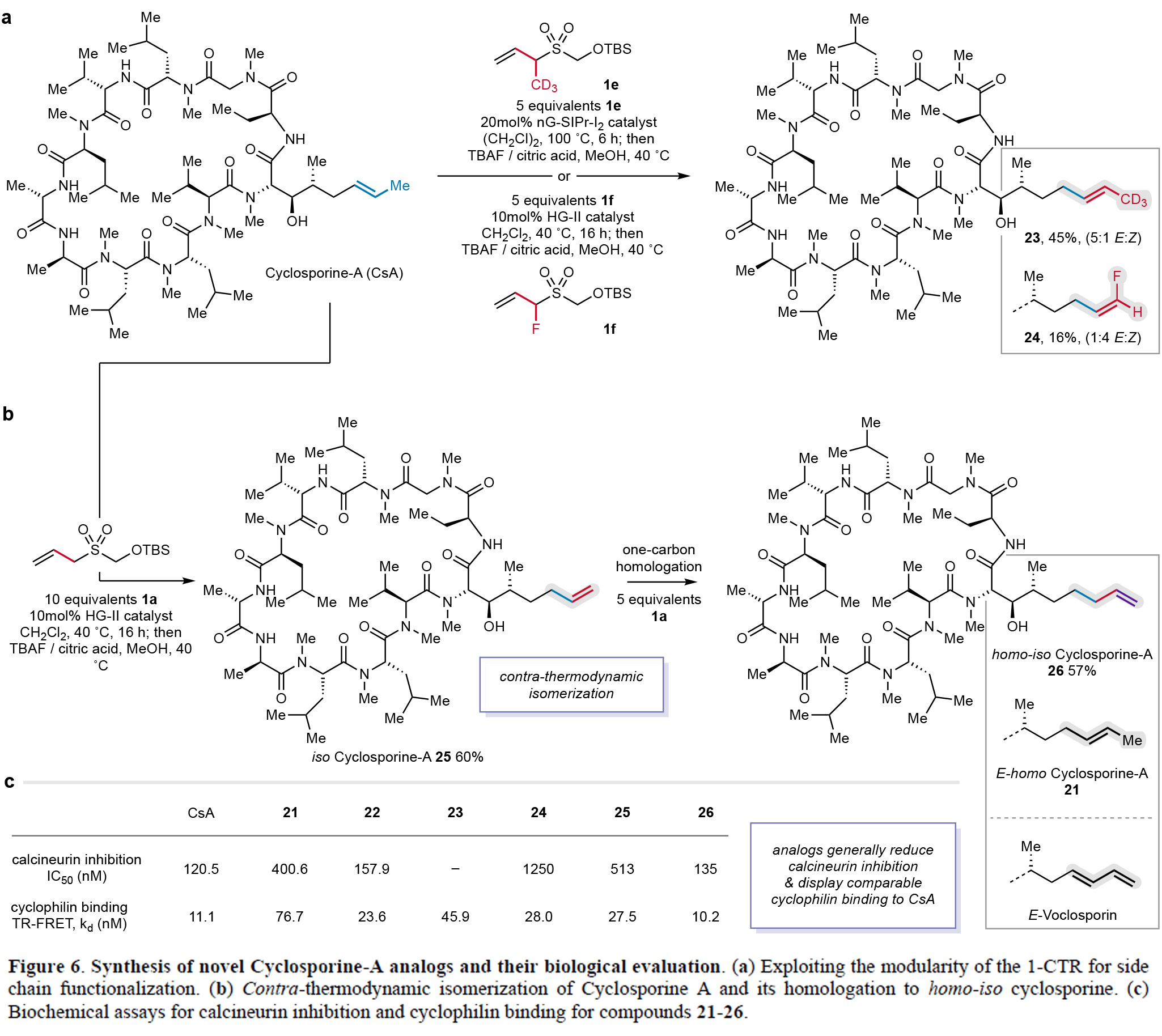
基于cyclosporine-A同系物21所表現出的獨特免疫抑制活性變化,作者進一步探索了烯烴側鏈的精細修飾策略(Figure 6)。利用1CTR的模塊化特性,作者成功合成了含氘代甲基(23,E/Z = 5:1)和氟原子(24,E/Z = 1:4)的cyclosporine類似物,其中23實現了甲基到CD3的替換,而24則保持了碳數不變但引入了末端氟取代(Figure 6a)。特別值得關注的是,使用未取代的1CTR-1a通過異構化策略可以以良好收率獲得末端烯烴類似物異環孢素A(25),并可進一步同系化為高異環孢素A(26)(Figure 6b)。此外,鈣調磷酸酶抑制實驗表明,氟化類似物24的活性較母體降低10倍,末端烯烴25降低4倍,而26則恢復至cyclosporine-A的水平(Figure 6c)。TR-FRET實驗證實所有類似物(22-26)均保持對親環蛋白A的高親和力(<80 nM)。
(圖片來源:Nature)
總結
傳統合成方法的局限性使得復雜分子中精細的系統性結構修飾難以實現,從而導致許多潛在的結構-活性關系和生物學突破被長期忽視。Matthew J. Gaunt課題組開發的烯烴同系化策略為此提供了高效解決方案。其通過可編程的烯烴側鏈長度調控,成功獲得了一系列結構精確調控的Cyclosporine-A衍生物。該策略可拓展至其他鈣調磷酸酶抑制劑,其催化烯烴同系化方法與互補性異構化方法的結合,為構建特定結構的復雜分子提供了全新的工具,在學術研究與工業應用中均具有廣闊前景。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn