

(圖片來源:Science)
正文
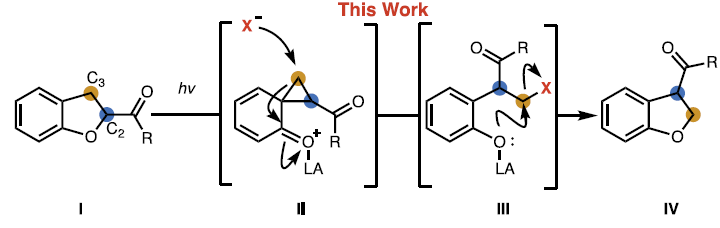
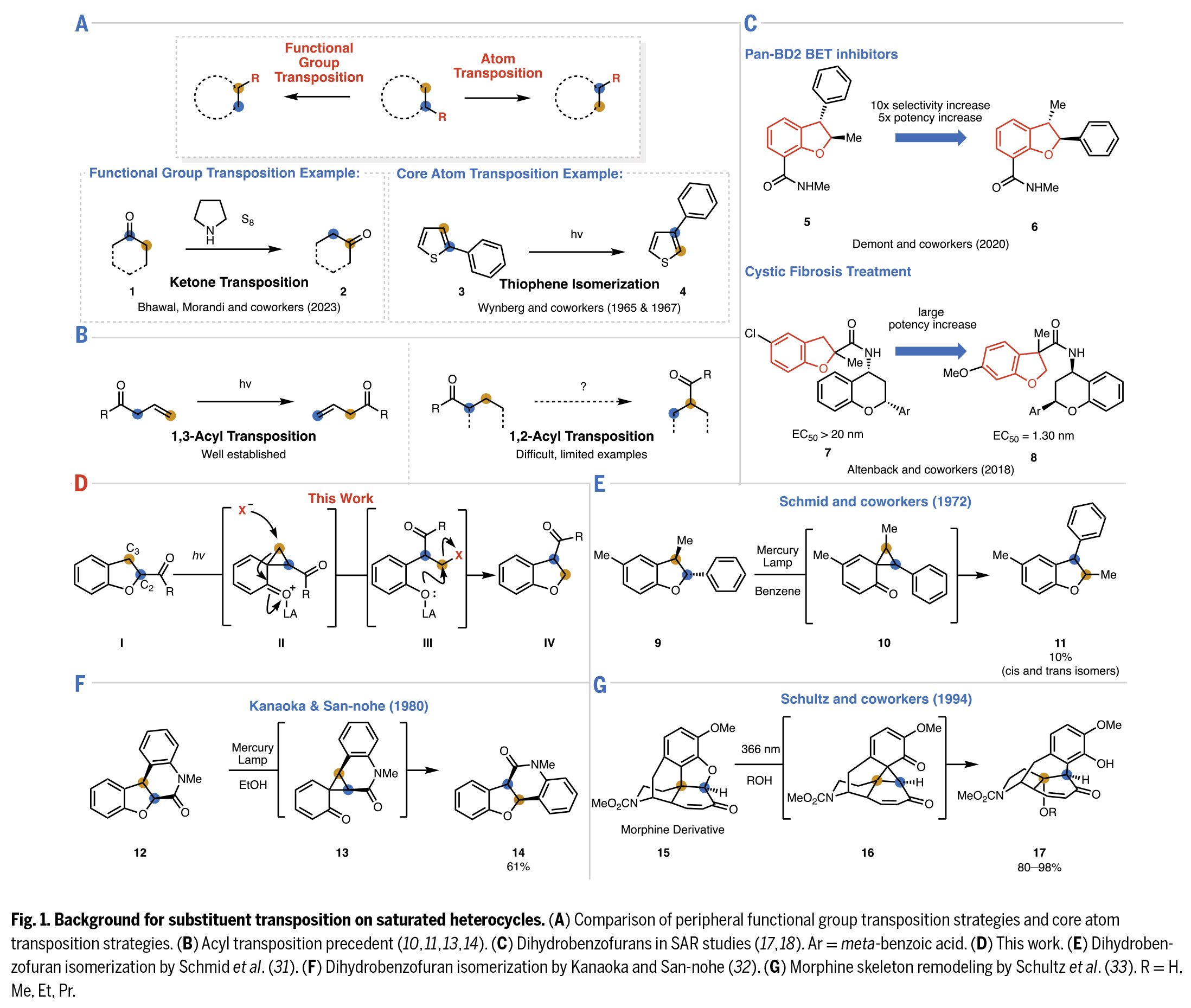
飽和雜環化合物是藥物分子中常見的骨架結構。在藥物發現過程中,化學家們往往需要對官能團位置不同的類似分子進行大量篩選。因此,開發能夠實現飽和雜環上現有取代基重排至周邊位點的合成方法具有重要意義。近日,加州大學伯克利分校Richmond Sarpong課題組通過C2-酰化二氫苯并呋喃的C2-C3位光化學交換反應,實現了形式上的1,2-酰基轉位。雖然該反應的凈效應是使羰基取代基在碳環上移動一個位點,但其作用機制實際上是通過保持C-CO鍵不變的同時交換骨架原子來實現的。該反應以二氫苯并呋喃為底物,其過程可能涉及光化學途徑生成的環丙烷中間體(Fig. 1)。歡迎下載化學加APP到手機桌面,合成化學產業資源聚合服務平臺。
(圖片來源:Science)
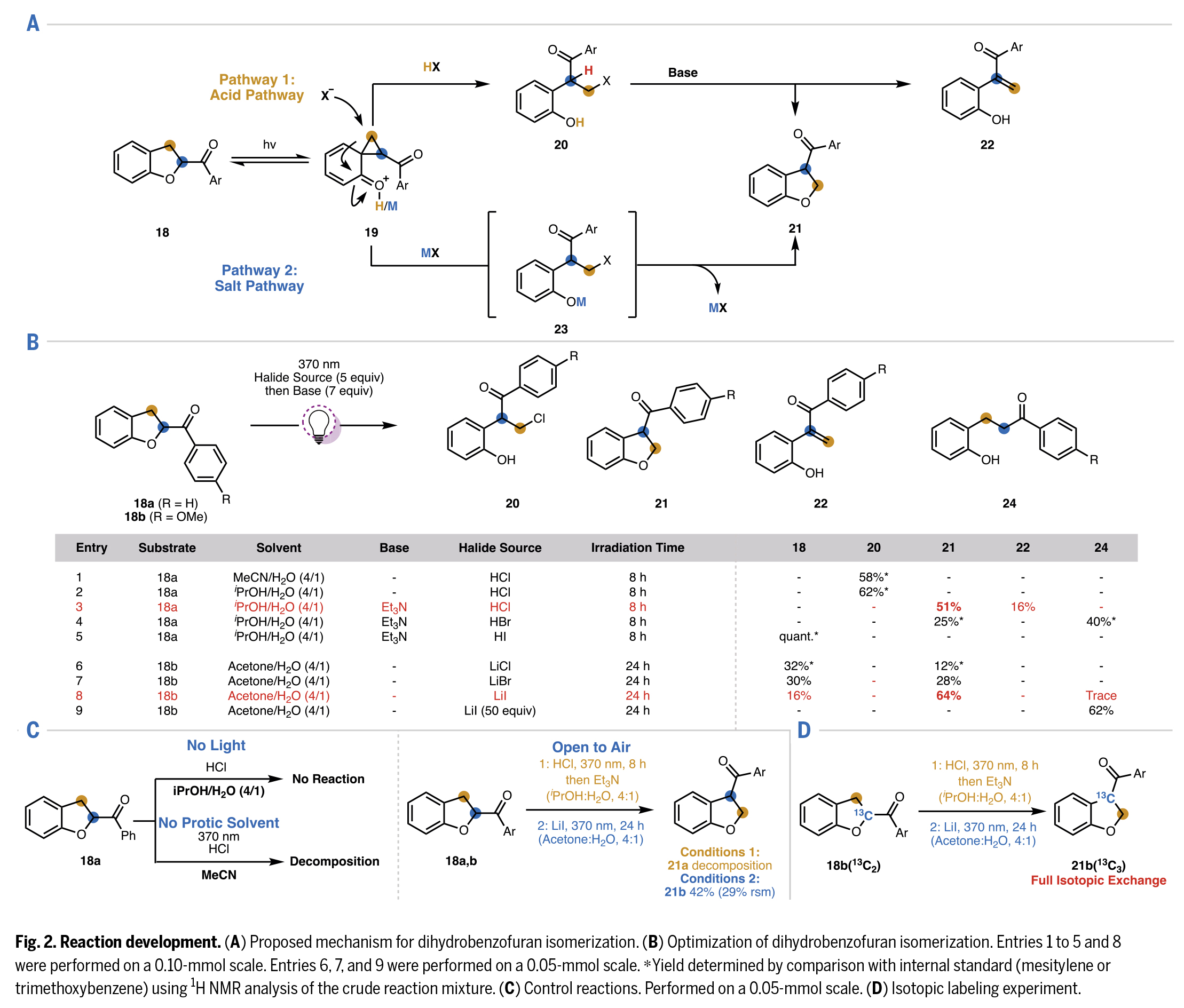
首先,作者觀察到在氮氣保護的極性質子溶劑中,模板底物18在稀鹽酸溶液里經370 nm的紫外光照射后,可發生預期的氯化反應生成產物20。該產物即使在持續光照下也不會進一步反應(Fig.2B)。對照實驗證實,該反應需要光照條件、質子溶劑和無氧環境(Fig.2C)。隨后,作者經過大量條件篩選,確定異丙醇與水的4:1混合體系為合成伯氯代物20的最佳溶劑。隨后作者通過對多種堿的篩選得出三乙胺能在有效促進目標環化反應的同時,最大限度地減少22的生成。考慮到若使用不同鹵化氫可能避免這一競爭性消除反應,作者考察了其他鹵化酸。當使用HBr時,未觀察到消除反應產生的烯酮副產物,但由于單電子轉移過程導致開環還原產物24a的生成(收率40%),使得總收率下降。而使用HI時反應完全被抑制,原料定量回收。最終確定HCl是最適宜的酸催化劑。
作為對初始發現的補充,作者提出一個假設,即無需采用兩步一鍋法,鹵化物源可直接引發異構化反應。進一步篩選表明,反應在丙酮:H2O(4:1)混合溶劑中光照24小時效果最佳。相較于LiCl或LiBr,親核性更強的LiI可獲得更高收率(Fig.2B)。值得注意的是,使用LiI的酰基轉位反應可在敞口空氣條件下進行,收率僅有輕微的下降(Fig.2C)。
鑒于HCl和LiI條件各有優勢,作者開發了兩種二氫苯并呋喃底物形式芳基酮(芳酰基)轉位方案:條件1為兩步一鍋法(370 nm光照8小時+HCl,隨后用Et3N處理);條件2為一步法(LiI光照24小時)。此外,作者通過同位素標記實驗(18b(13C2)轉化為21b(13C3))驗證了所提出的骨架重排機制。核磁共振(NMR)分析證實在兩種優化條件下,同位素標記的碳原子均在產物的C3位(Fig.2D)。
(圖片來源:Science)
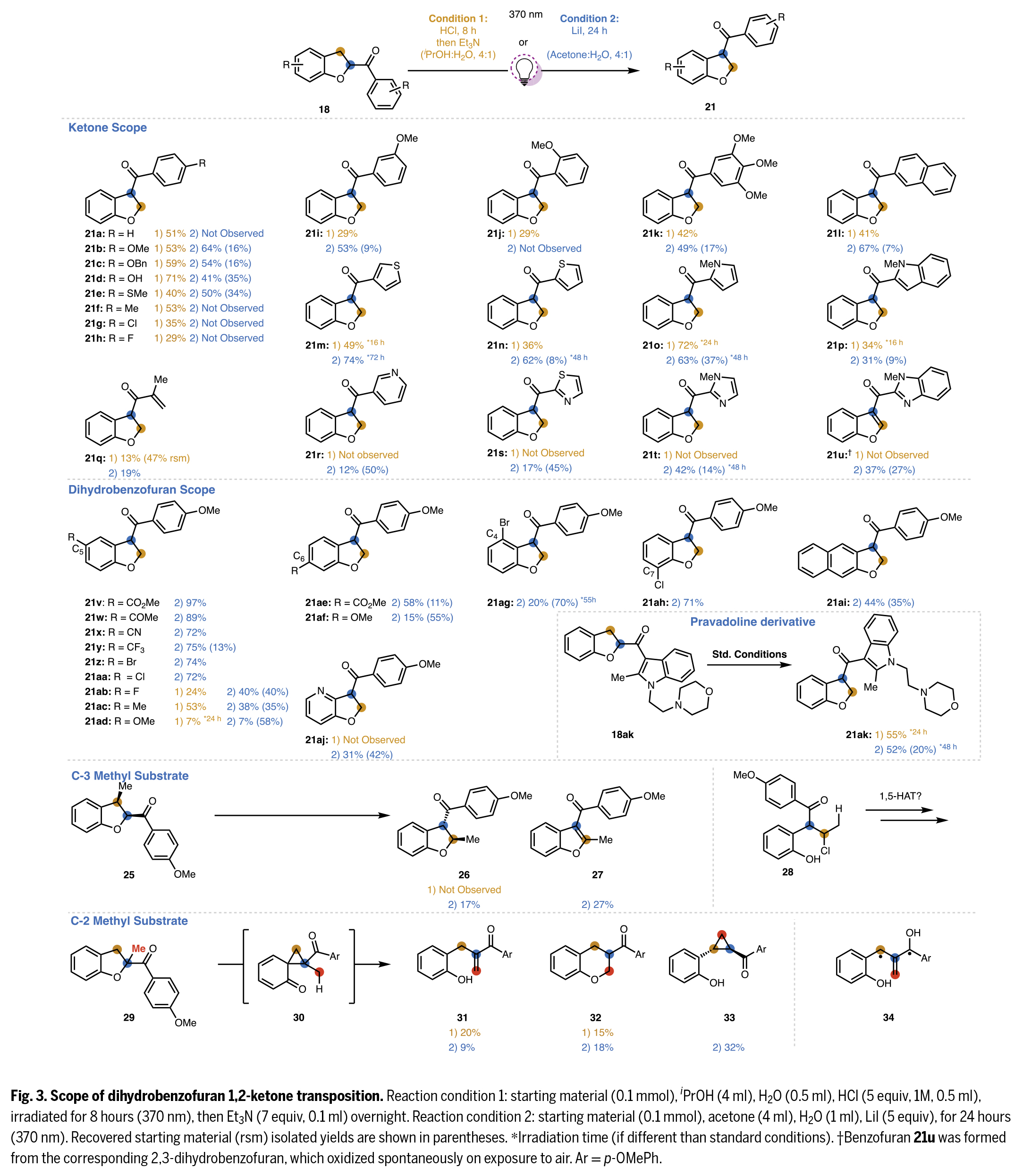
在得到了最優反應條件后,作者對此轉化的底物范圍進行了探索(Fig. 3)。實驗結果表明該轉化其具有廣譜的底物范圍。一系列不同取代的酮和二氫苯并呋喃均具有良好的兼容性,以中等至良好的產率得到相應的產物21a-21aj。值得注意的是,Pravadoline衍生物同樣可以兼容,證明了此轉化的實用性。
為考察C3位取代基對轉位反應的影響,作者研究了帶有額外取代基底物的反應兼容性。采用LiI條件時,順式C3-甲基二氫苯并呋喃25成功轉位生成反式產物26及芳構化產物27。盡管不能完全排除順式26生成后發生芳構化或分解的可能性,但實驗未檢測到任何順式產物。而條件1僅導致分解反應,這可能是因為開鏈氯代加合物28會進行不利的Norrish II型反應,而剛性結構26則不會發生此類副反應。
在兩種條件下光照2-甲基底物29均未獲得目標產物。該反應僅以低收率生成烯酮31、32和環丙烷33,這些產物可通過制備薄層色譜與其他微量副產物有效分離。推測31是由30通過形式[1,5]-σ遷移重排產生,而31經6-endo-trig氧雜-邁克爾加成生成32。另一種途徑是31的進一步激發可能促使芐位氫原子通過1,4-氫原子轉移至激發態芳酮,形成的中間體34,該中間體通過自由基重組生成環丙烷33。
(圖片來源:Science)
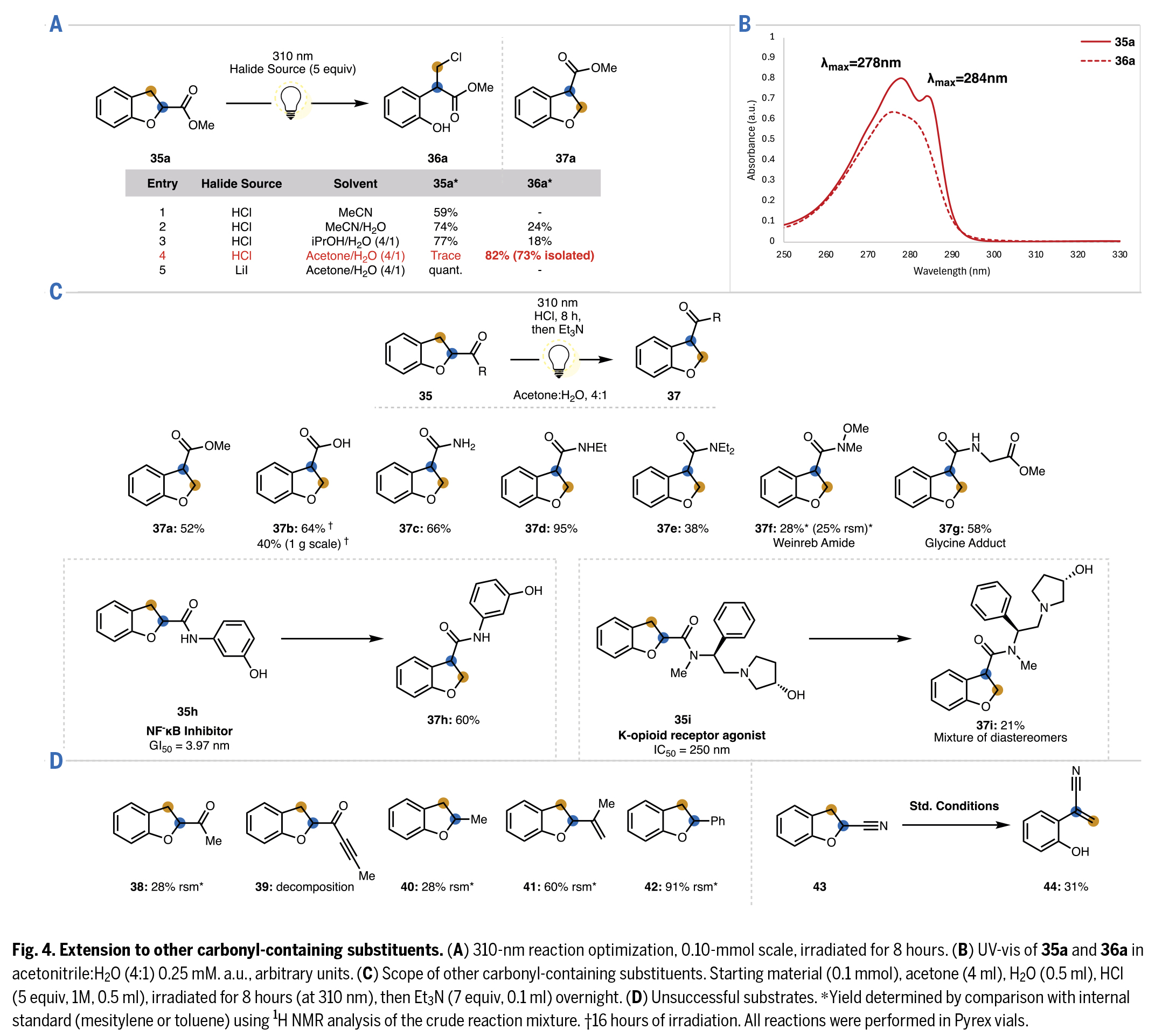
受前人關于二氫苯并呋喃在紫外光作用下形成螺環丙烷的報道啟發,作者研究了其他類型含羰基官能團的轉位反應,特別是那些在370 nm反應條件下不具有光反應活性的基團(Fig. 4)。實驗發現,通過中心波長為310 nm的光照,甲基酯35a能以高產率轉化為伯氯代物36a(Fig.4A)。在丙酮:水(4:1)混合溶劑中反應收率最高(entry 4)。由于酯基的酸性低于先前研究的芳基酮,所得伯鹵代物(36a)能有效轉化為轉位產物(37a),且不會發生競爭性的鹵素消除副反應。此外,作者嘗試使用LiI直接將35a轉化為37a未獲成功(entry 5)。
隨后,作者對C2-酯基取代的二氫苯并呋喃及其相應氯代加合物(35a和36a)進行了紫外-可見吸收光譜測定(Fig.4B)。值得注意的是,35a和36a在300 nm以上波長區域基本無顯著吸收(Pyrex玻璃瓶可濾除300 nm以下波長)。雖然紫外-可見光譜顯示35a在300 nm以上波長應該不能有效吸光并發生光化學反應,但光化學反應效率往往在比底物最大吸收波長更長的波段更高。此外,丙酮在300-330 nm區間有微弱吸收,可能通過溶劑光敏化作用促進反應。特別值得注意的是,35a在λmax = 284 nm處的特征吸收峰在氯代加合物36a中消失,這合理解釋了為何36a在反應條件下能保持光穩定性。
其他含羰基官能團—包括羧酸(35b)和酰胺類(35c-35g)—均能在310 nm光照下成功實現轉位(Fig.4C)。即使不穩定的Weinreb酰胺35f也能耐受反應條件,其N-O鍵未發生均裂,最終獲得轉位產物與原料的混合物。C3-羧酸35b的轉位反應在克級規模仍能進行,僅收率略有下降,證明該方法在高度可衍生化結構單元上的可放大性。這種對多種含羰基官能團的普適性顯著提升了該反應在生物活性分子合成中的應用價值。然而,烷基酮38和炔基酮39在所發展轉位條件下均發生分解(Fig.4D)。
(圖片來源:Science)
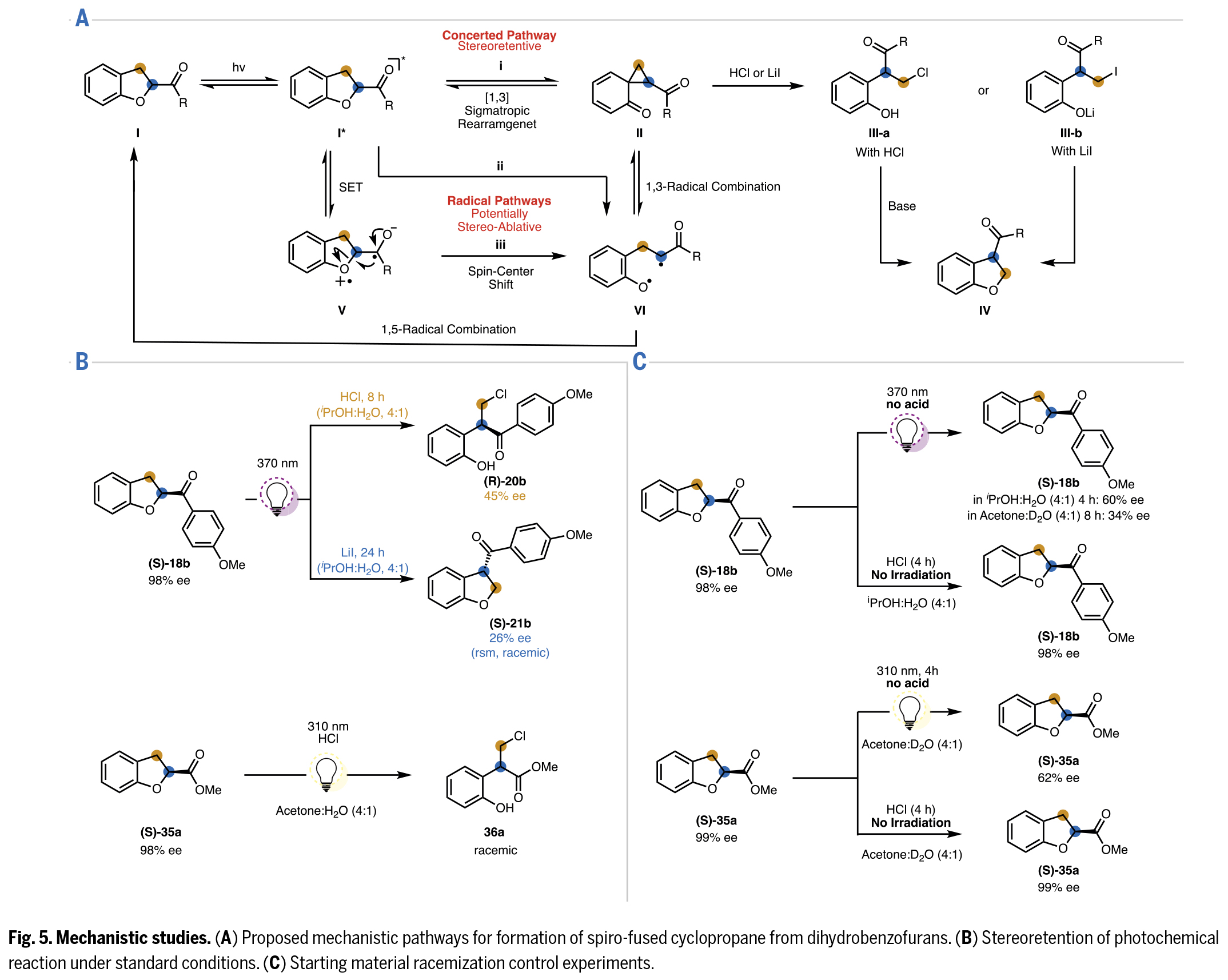
最后,作者提出了光化學激發態下關鍵螺環丙烷中間體形成的三種可能路徑:(i)[1,3]-σ遷移重排;(ii)C-O鍵均裂后發生1,3-雙自由基重組;(iii)電子轉移伴隨自旋中心轉移開環,繼而發生雙自由基重組(Fig.5A)。在某些反應中所表現出的立體保持特性支持了立體專一性的σ遷移重排機制;而從類似二氫呋喃底物的光化學異構化研究中分離出的雙自由基產物及其壽命測定結果為雙自由基中間體的存在提供了證據。此外,環丙烷中間體也是通過雙自由基機制形成的。
作為研究的重要組成部分,作者對手性富集起始原料產物的立體保留(或消旋)特性進行了定量分析。實驗觀測顯示,當使用高對映體純度的底物時,無論是條件1還是條件2都會導致產物對映選擇性顯著降低(Fig.5B)。雖然這一現象初步支持了通過雙自由基中間體導致消旋化的機理,但也不能排除另一種可能性。即手性富集的螺環丙烷中間體(II)可能通過熱力學或光化學驅動的雜乙烯基環丙烷重排轉化為起始原料,且該過程在某些情況下已被證實會通過導致消旋的自由基機理進行。
對照實驗證實,回收原料的消旋化源于光照作用而非酸性添加劑(Fig.5C)。在丙酮:D2O體系中開展的補充實驗顯示,回收的消旋化原料未檢測到氘代現象,這排除了通過光致烯醇化導致消旋的路徑。這些結果表明消旋過程是通過形成雙自由基中間體(VI),隨后發生1,5-位重組重新生成I而實現的(Fig.5A)。
(圖片來源:Science)
總結
Richmond Sarpong課題組開發了一種通過光化學轉化生成螺環丙烷中間體、實現二氫苯并呋喃C2-C3位酰基取代基形式轉位的合成策略。該策略利用非常規的骨架重排反應,解決了傳統方法難以實現的周邊官能團位置遷移難題。這種通過光化學途徑獲取去芳構化螺環丙烷中間體的策略,將為二氫苯并呋喃骨架的多樣化修飾提供新思路。機理研究表明,螺環丙烷中間體的形成部分涉及自由基反應機制。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn