



(圖片來源:J. Am. Chem. Soc.)
正文
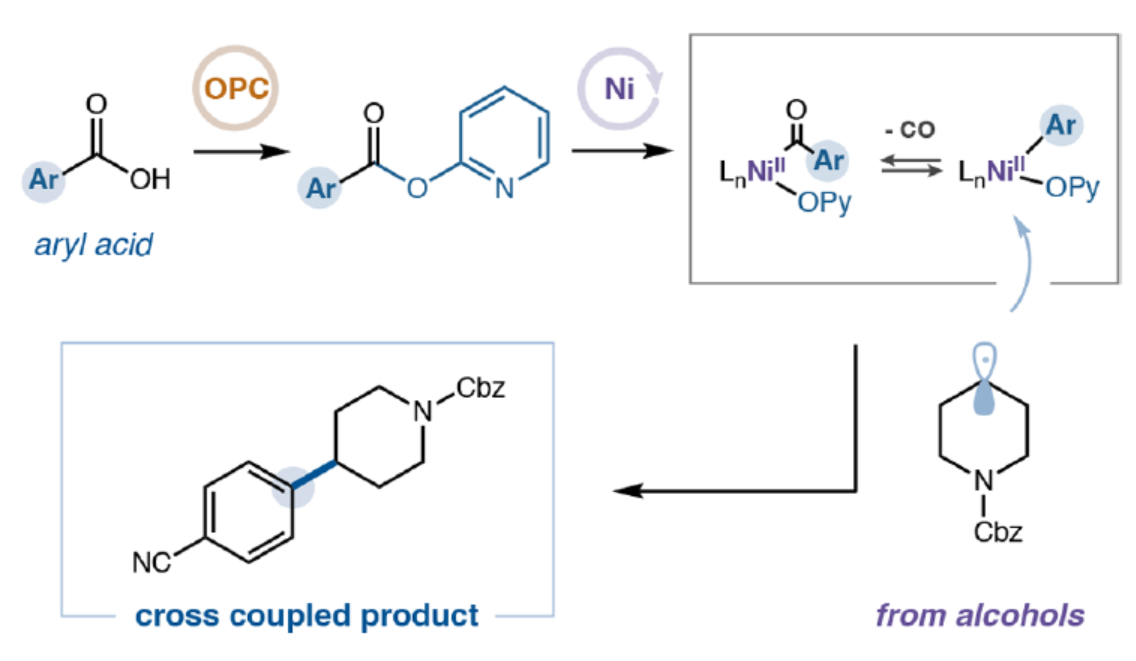
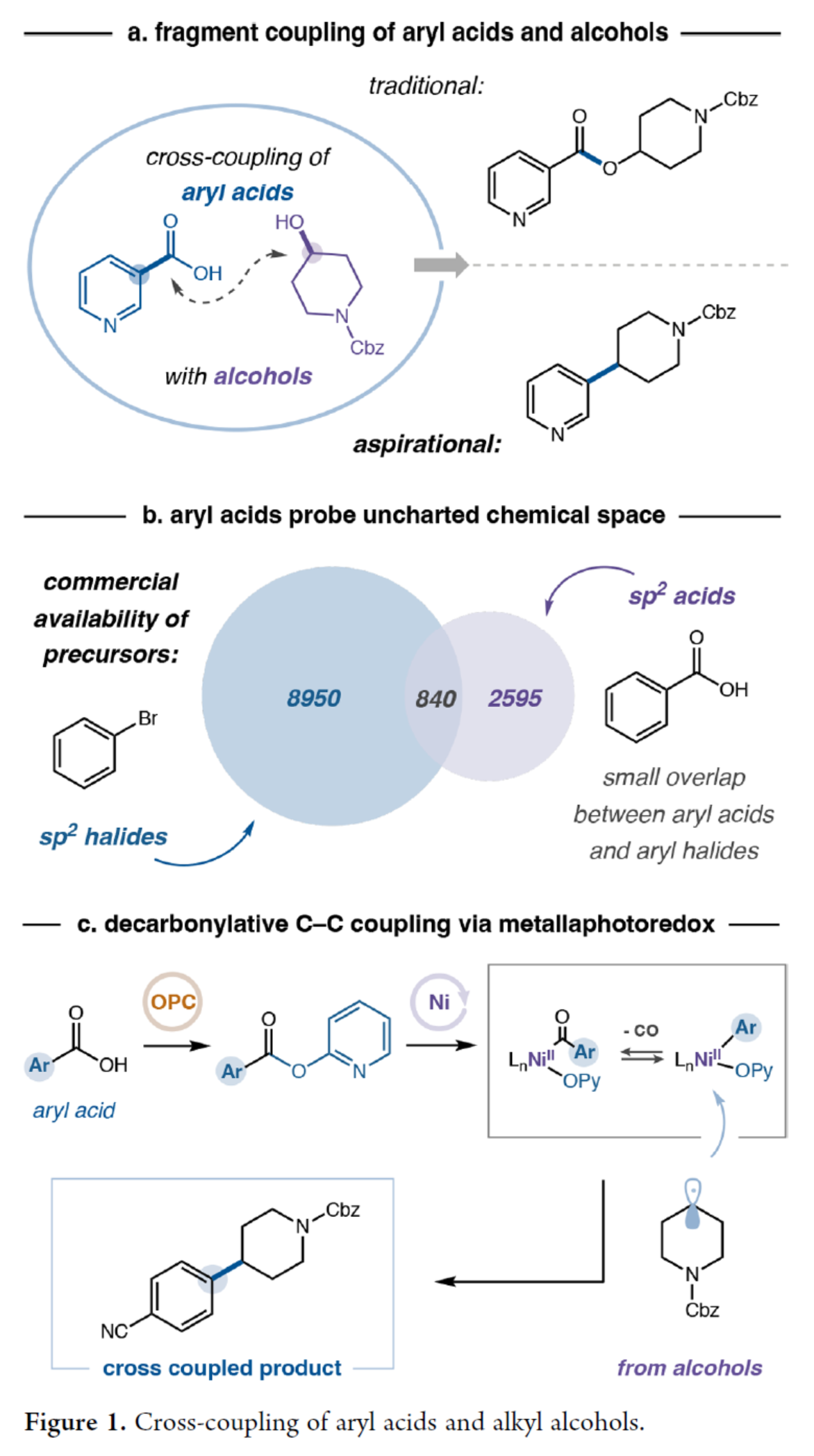
C(sp3)?C(sp2)結(jié)構(gòu)單元在藥物研發(fā)中具有特殊重要性,其可通過富含C(sp3)的分子骨架賦予三維空間復(fù)雜性,進(jìn)而在藥物設(shè)計(jì)與發(fā)現(xiàn)中發(fā)揮關(guān)鍵作用。同時(shí),此類骨架能夠顯著提升化合物的溶解性、生物利用度及藥代動(dòng)力學(xué)性質(zhì),因而在藥物分子開發(fā)中備受青睞。傳統(tǒng)上,C(sp3)?C(sp2)鍵的合成主要依賴于過渡金屬(如鈀)催化的交叉偶聯(lián)方法,需使用烷基/芳基有機(jī)金屬試劑與鹵代物反應(yīng)。然而,由于該策略對(duì)昂貴或難以獲取的起始原料與催化劑的依賴性,限制了其廣泛應(yīng)用。近年來,鎳催化領(lǐng)域的進(jìn)展為還原型C(sp3)?C(sp2)偶聯(lián)開辟了新途徑——該方法與鈀催化體系形成互補(bǔ),并可在更溫和條件下實(shí)現(xiàn)更廣泛的底物兼容性。盡管取得了這些進(jìn)展,現(xiàn)有方法仍主要依賴芳基與烷基鹵化物作為反應(yīng)組分,但此類原料常面臨成本高昂、制備困難或官能團(tuán)耐受性有限等問題。為此,MacMillan等團(tuán)隊(duì)致力于尋求一種可替代的交叉偶聯(lián)組分,并最終選定烷基醇與芳基羧酸作為理想候選——因其兼具商品化易得性、結(jié)構(gòu)多樣性及合成普適性等優(yōu)勢。雖然醇和芳基羧酸通常會(huì)發(fā)生酯化反應(yīng),但MacMillan等團(tuán)隊(duì)旨在探究金屬光氧化還原策略是否能夠促進(jìn)C(sp3)?C(sp2)鍵的脫羰基化形成(Figure 1a)。此外,芳基羧酸所探索的化學(xué)空間通常是芳基鹵化物尚未涉足的領(lǐng)域。因此,該方法將提供互補(bǔ)的反應(yīng)活性,并拓展進(jìn)入一個(gè)大部分未被探索的化學(xué)空間的途徑(Figure 1b)。最近,Weix和Cernak課題組通過鎳催化脫羰基反應(yīng)實(shí)現(xiàn)了碳-碳鍵的構(gòu)建,這一研究展示了芳基羧酸作為多功能合成子參與交叉偶聯(lián)反應(yīng)的潛力。受此啟發(fā),近日,MacMillan等團(tuán)隊(duì)開發(fā)了一種將醇脫氧與芳基羧酸活化相結(jié)合策略,成功構(gòu)建了一個(gè)能夠高效形成C(sp3)?C(sp2)鍵的催化體系,并具有優(yōu)異的官能團(tuán)耐受性(Figure 1c)。歡迎下載化學(xué)加APP到手機(jī)桌面,合成化學(xué)產(chǎn)業(yè)資源聚合服務(wù)平臺(tái)。
(圖片來源:J. Am. Chem. Soc.)
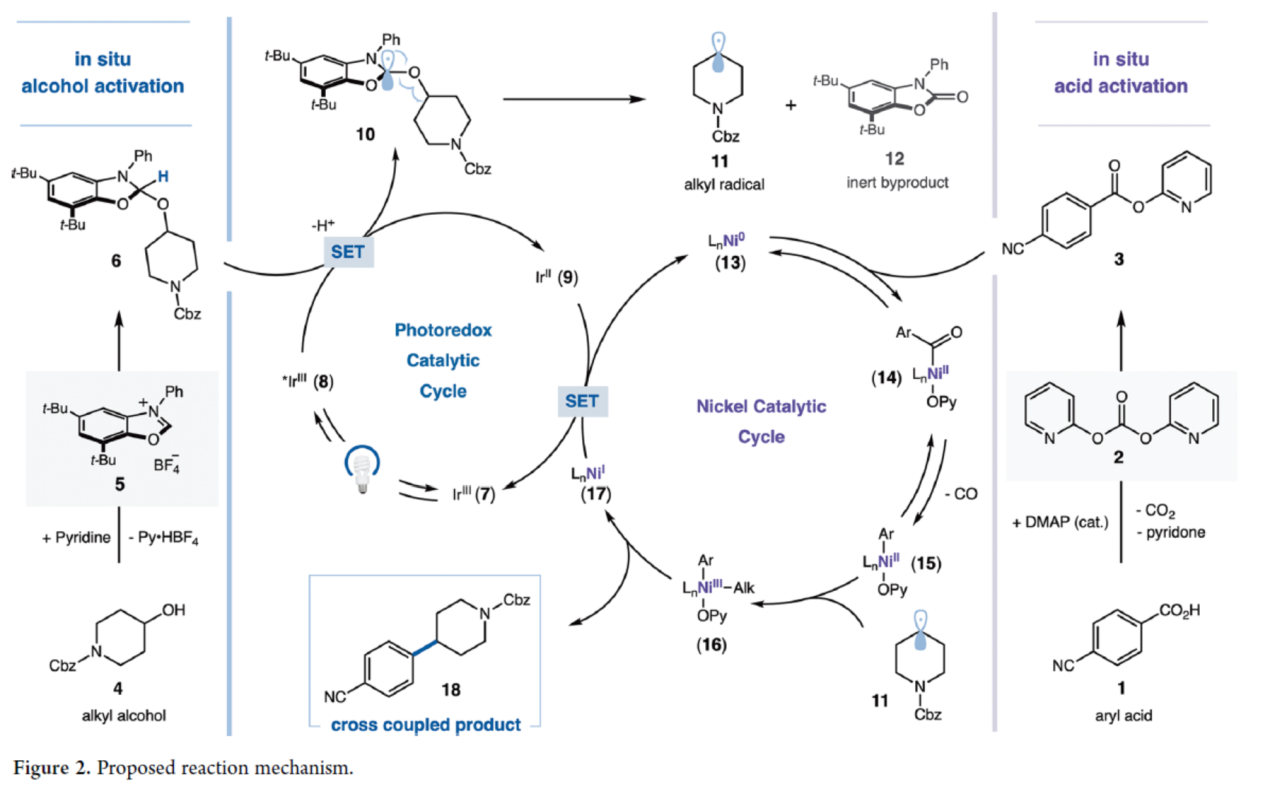
首先,作者提出了一種合理的雙重鎳/光氧化還原催化交叉偶聯(lián)反應(yīng)的機(jī)理(Figure 2)。最初,將芳基羧酸(1)與二吡啶-2-基碳酸酯(DPC,2)及催化量的DMAP預(yù)混合,無需純化即可原位生成活化酸(3)。在另一反應(yīng)容器中,醇底物(4)與NHC鹽(5)在弱堿性條件下反應(yīng),同樣無需進(jìn)一步純化即可原位生成活化NHC-醇加合物(6)。其次,在可見光激發(fā)光催化劑Ir[dF(CF3)-ppy]?(dtbbpy)PF?(7)時(shí),會(huì)生成具有長壽命氧化性質(zhì)的三重激發(fā)態(tài)配合物(8),其可通過NHC-醇加合物(6)的單電子轉(zhuǎn)移(SET)過程發(fā)生還原淬滅,從而形成還原態(tài)的Ir(II)光催化劑(9)與中間體(10)。隨后,中間體(10)的快速去質(zhì)子化及β-斷裂過程將釋放出惰性芳構(gòu)化副產(chǎn)物(12),并生成烷基自由基(11)。同時(shí),作者推測,Ni(0)配合物(13)對(duì)活化酸(3)的氧化加成將生成Ni(II)配合物(14),其經(jīng)歷脫羰反應(yīng)后生成中間體(15)。烷基自由基(11)可被鎳催化劑快速捕獲,形成Ni(III)-烷基中間體(16),其通過還原消除后生成目標(biāo)交叉偶聯(lián)產(chǎn)物(18),并釋放出Ni(I)中間體(17)。最終,Ir(II)配合物(9)與Ni(I)配合物(17)之間經(jīng)單電子轉(zhuǎn)移(SET)過程將Ni(I)還原為Ni(0),同時(shí)使Ir(II)被氧化,從而同步完成光氧化還原循環(huán)和鎳催化循環(huán)。
(圖片來源:J. Am. Chem. Soc.)
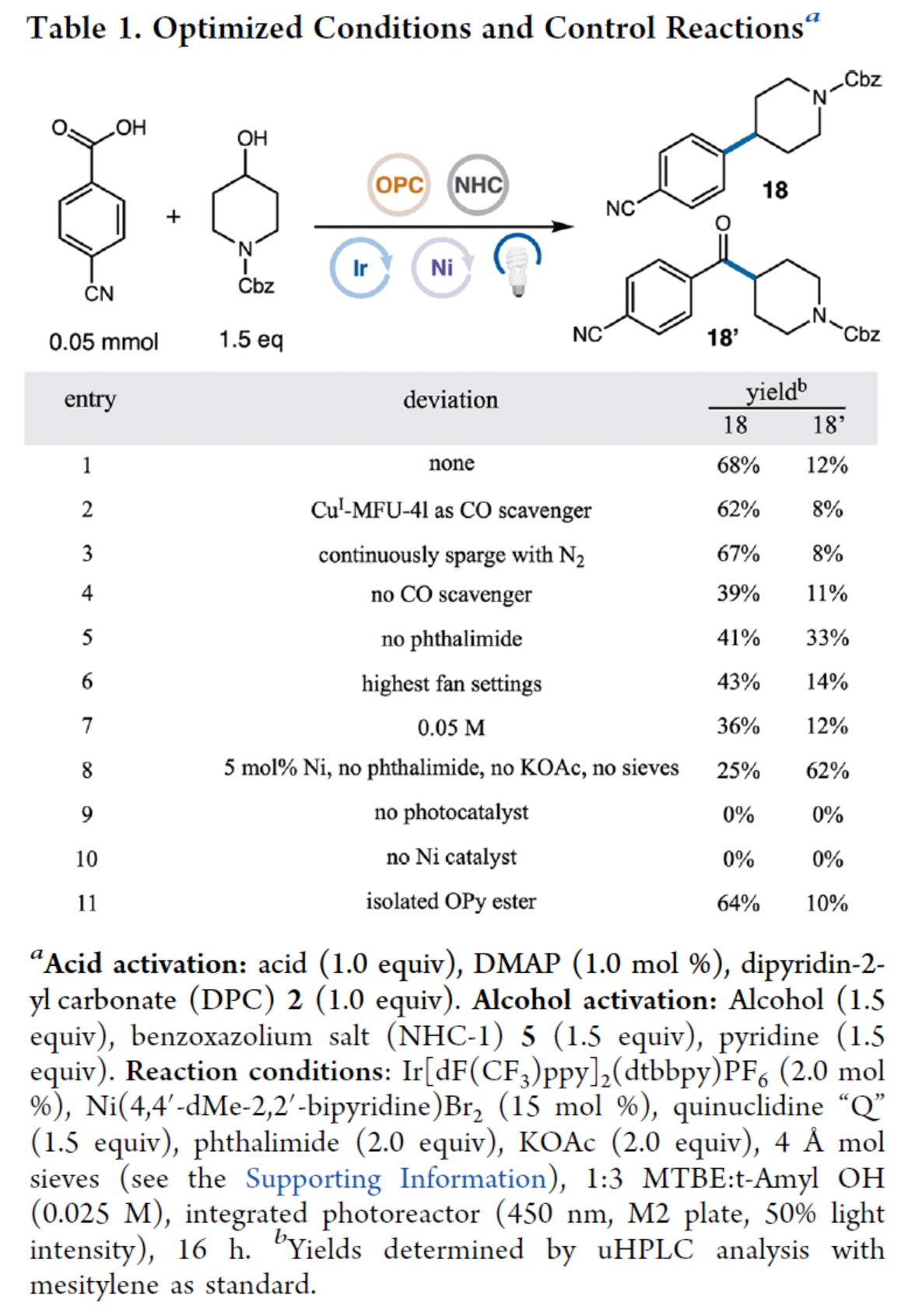
其次,作者以4-氰基苯甲酸與醇衍生物作為模型底物,進(jìn)行了相關(guān)反應(yīng)條件的篩選(Table 1)。酸化合物活化的條件為:即羧酸化合物(1.0 equiv)與二吡啶-2-基碳酸酯(DPC,2)(1.0 equiv)在DMAP(1.0 mol %)催化下反應(yīng)。醇化合物活化的條件為:即醇化合物(1.5 equiv)與吡啶(1.5 equiv)在NHC-1(5,1.5 equiv)催化下反應(yīng)。在活化兩種底物后,以Ir[dF(CF3)ppy]2(dtbbpy)PF6(2.0 mol%)作為光催化劑,Ni(4,4’-dMe-2,2’-bipyridine)Br2(15 mol%)作為金屬催化劑,奎寧環(huán)“Q”(1.5 equiv)作為配體,鄰苯二甲酰亞胺(2.0 equiv)作為添加劑,KOAc(2.0 equiv)作為堿,4 ?作為添加劑,藍(lán)色LEDs作為光源,在MTBE:t-Amyl OH(比例為1:3)混合溶劑中反應(yīng),可以68%的收率得到偶聯(lián)產(chǎn)物18以及12%收率的酮副產(chǎn)物18’。
(圖片來源:J. Am. Chem. Soc.)
在獲得上述最佳反應(yīng)條件后,作者對(duì)烷基醇與烷基羧酸的底物范圍進(jìn)行了擴(kuò)展(Table 2)。首先,一系列一級(jí)醇與二級(jí)醇,均可順利進(jìn)行反應(yīng),獲得相應(yīng)的產(chǎn)物19-43,收率為44-67%。其中,通過市售甲醇即可簡便地引入富氫和富碳同位素單元,從而避免了冗長的從頭合成步驟(如22和23)。其次,羧酸也可作為烷基自由基,其可從豐富的α-氨基酸原料氧化生成,如苯丙氨酸(44,收率55%)、脯氨酸(45,收率49%)、α-羥基酸(46,收率40%)和非經(jīng)典α-氨基酸氮雜環(huán)丁烷(47,收率58%)中生成,并獲得相應(yīng)的C(sp3)?C(sp2)偶聯(lián)產(chǎn)物。
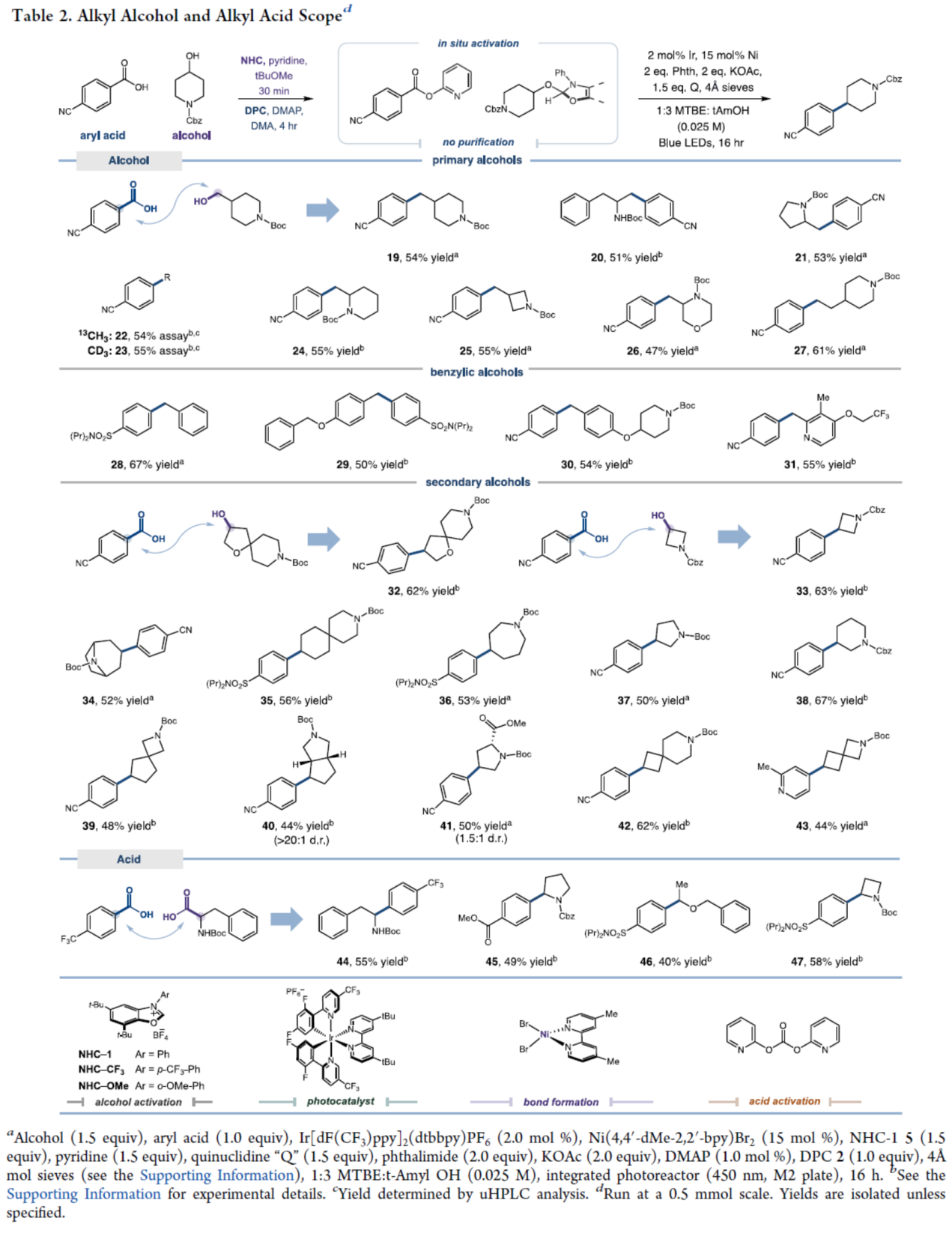
(圖片來源:J. Am. Chem. Soc.)
緊接著,作者對(duì)芳基羧酸的底物范圍進(jìn)行了擴(kuò)展(Table 3)。首先,具有不同電性和位阻的苯甲酸,均可順利進(jìn)行反應(yīng),獲得相應(yīng)的產(chǎn)物18和48-55,收率為33-69%。其次,衍生自吡啶、喹啉、嘧啶、噻唑等雜芳基羧酸,也與體系兼容,獲得相應(yīng)的產(chǎn)物56-64,收率為41-81%。值得注意的是,一系列活性基團(tuán),如硼基、烷氧羰基、鹵素等,均與體系兼容。同時(shí),由于2-吡啶酯與鎳催化劑的氧化加成速率較慢,同時(shí)伴隨脫羰反應(yīng)速率的下降,導(dǎo)致富電子的羧酸底物(如51)收率有所降低。
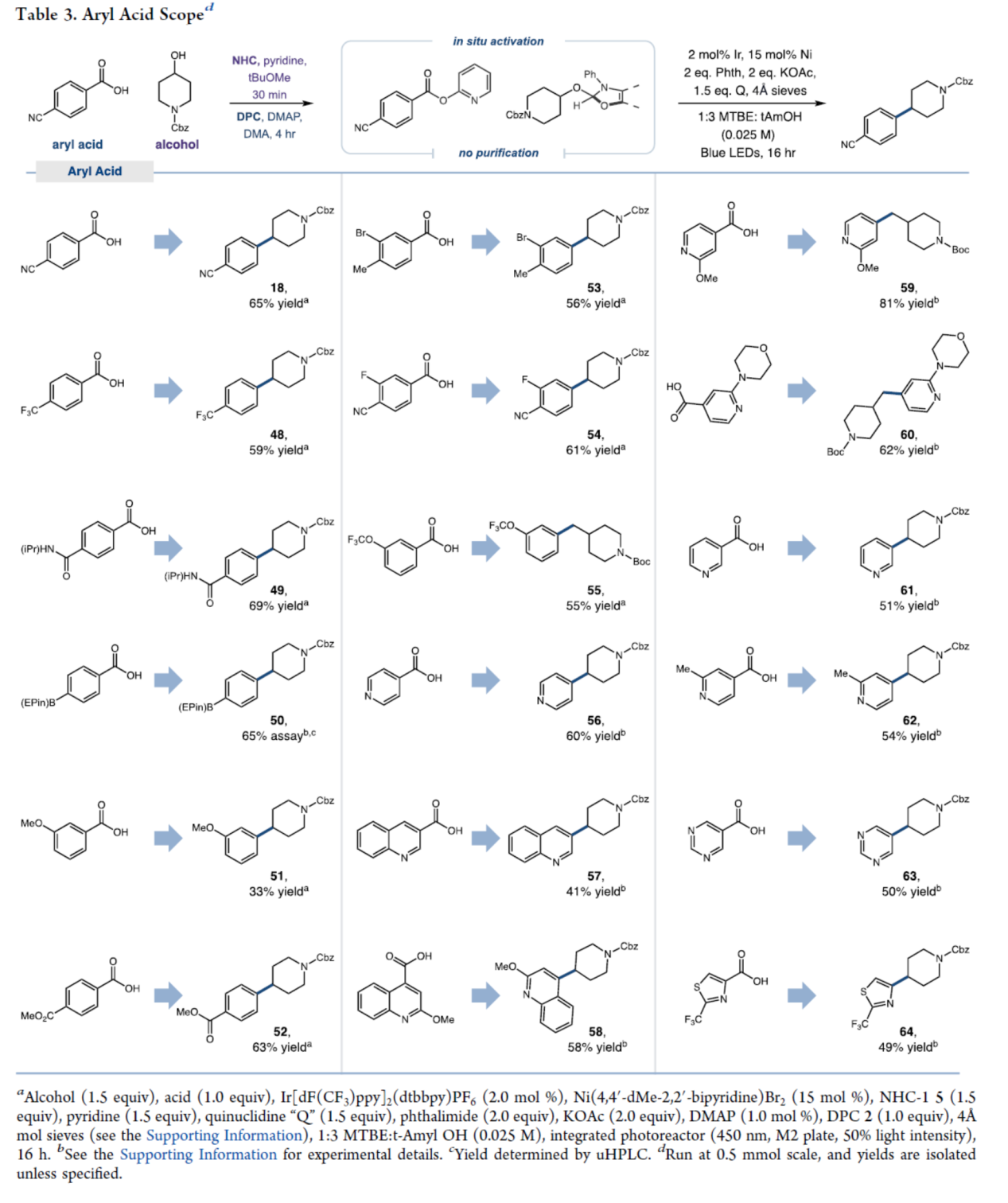
(圖片來源:J. Am. Chem. Soc.)
最后,作者對(duì)反應(yīng)的實(shí)用性進(jìn)行了研究(Table 4)。首先,該策略可用于一系列藥物與生物分子的后期衍生化,如氯苯唑酸(Tafamidis)、氯尼達(dá)明(Lonidamine)、魯瑪卡托(Lumacaftor)、替格瑞洛(Ticagrelor)、糖類化合物、α-氨基酸絲氨酸的衍生物、睪酮(Androsterone)等,獲得相應(yīng)的化合物65-74,收率為41-67%。值得關(guān)注的是,在呋喃糖(66)與替格瑞洛(72-b)的反應(yīng)中,觀察到顯著的區(qū)域選擇性,即在二級(jí)醇共存條件下,一級(jí)醇位點(diǎn)被專一性活化。
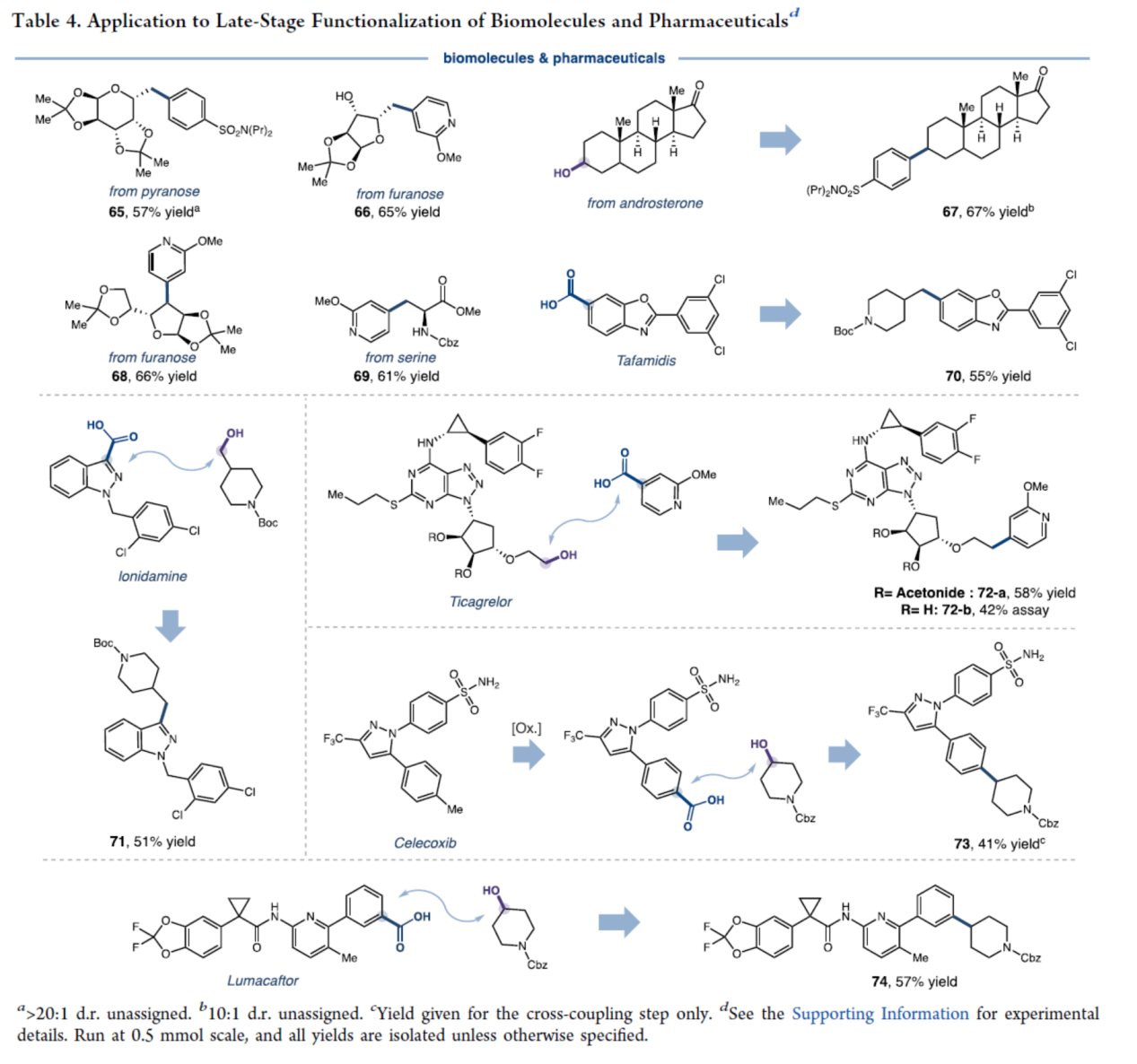
(圖片來源:J. Am. Chem. Soc.)
總結(jié)
David W.C. MacMillan等人報(bào)道了一種芳基羧酸與烷基醇的形式交叉偶聯(lián)策略,實(shí)現(xiàn)了C(sp3)?C(sp2)鍵的構(gòu)建。該方法不僅為傳統(tǒng)交叉偶聯(lián)技術(shù)提供了一種互補(bǔ)策略,也為傳統(tǒng)的酯化反應(yīng)提供了一個(gè)正交替代方案。其次,通過將NHC介導(dǎo)的脫氧過程與鎳催化脫羰成鍵機(jī)理相結(jié)合,作者開發(fā)了一種適用于廣泛脂肪醇和芳基羧酸的雙重鎳/光氧化還原催化方法。這種轉(zhuǎn)化的關(guān)鍵因素是加入分子篩和其他清除劑,能夠有效去除CO,從而最大限度地減少酮類副產(chǎn)物的生成,并提高反應(yīng)的轉(zhuǎn)化率。此外,使用非傳統(tǒng)的交叉偶聯(lián)底物,如醇和芳基羧酸,這種方法可以開辟構(gòu)建富含C(sp3)的新化學(xué)空間。
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn