


研究背景
環胺類化合物,特別是氮雜環丁烷、哌啶、吡咯烷和氮雜環庚烷,因其獨特的結構特征和廣泛的生物活性,已成為制藥和農用化學品領域的核心骨架分子。這一重要性在美國食品藥品監督管理局(FDA)最新批準的小分子藥物數據庫中得到充分印證。環胺合成化學的發展對創新藥物研發具有重要推動作用。盡管過去幾十年已開發出許多高效合成方法,但現有技術大多局限于特定結構類型的環胺。值得注意的是,不同環尺寸(尤其是4~7元環)的構建往往需要差異化的底物設計和截然不同的合成路線,這已成為制約藥物發現效率的重要因素(圖1a,左)。
另外,在現代藥物研發中,增加候選藥物分子中sp3雜化碳原子比例(Fsp3)已成為重要趨勢。這種結構特征不僅能顯著提升先導化合物的生物活性,還可有效降低臨床研發過程中的淘汰率。從分子設計角度看,引入環烷烴結構不僅能提高Fsp3值,還能增加分子的三維復雜性,為取代基的精細調控提供更多可能,同時保持分子剛性和代謝穩定性等 (圖1a,右)。
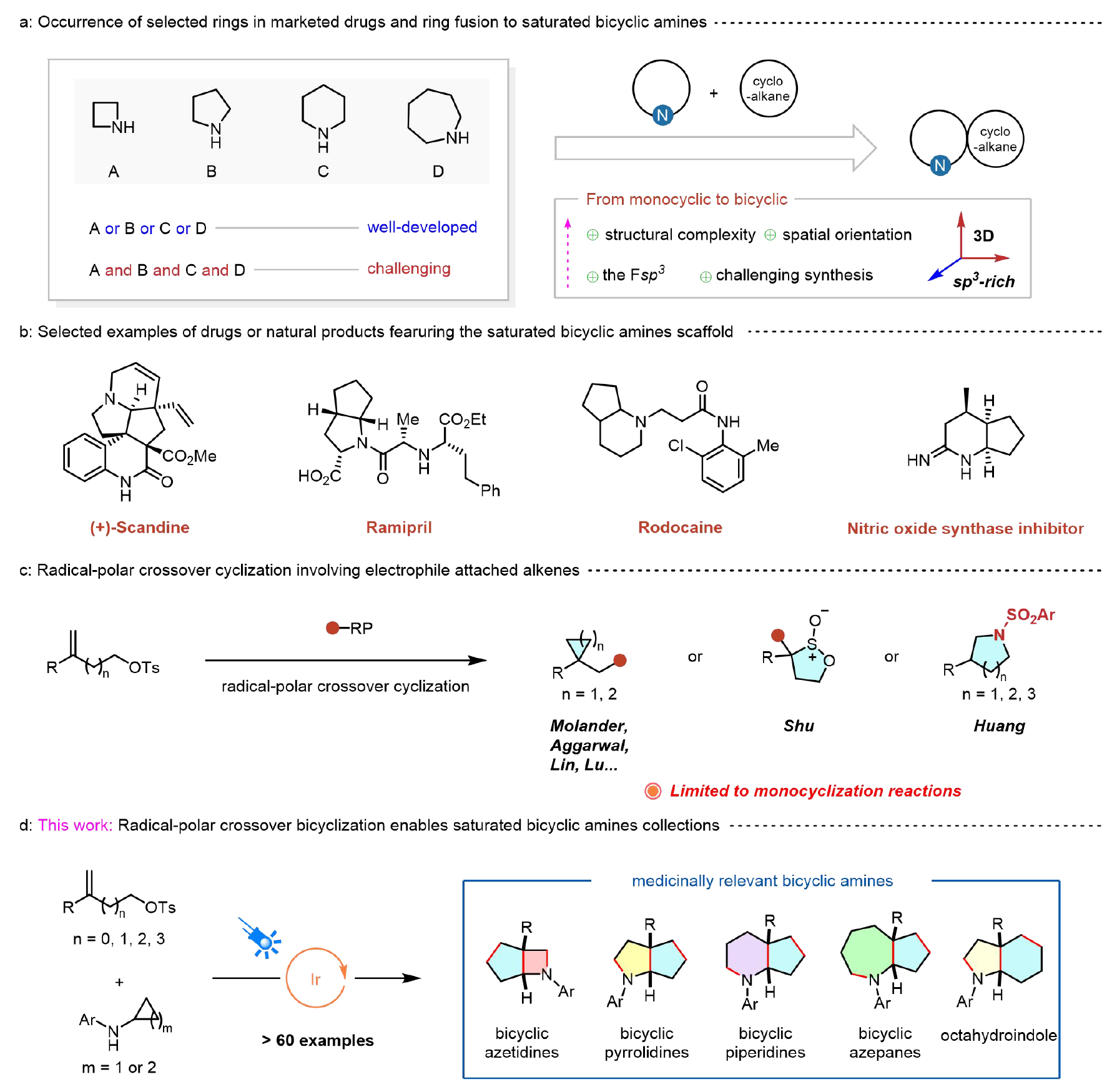
圖1. 飽和雙環胺的重要性及合成方法介紹
環戊烷并環胺作為一類重要的雙環胺衍生物,因其獨特的結構和理化性質,在眾多天然產物和藥物分子中廣泛存在(圖1b)。這類雙環體系的傳統合成方法主要包括氫化、重排、環化和環加成等策略。盡管取得了上述進展,但這些方法通常需要預先構建的單環或雙環結構作為底物,導致合成效率低下且步驟繁瑣。因此,更高效的雙環化反應亟待發展!最近,可見光驅動的分子內自由基環化(aza Paternò-Büchi反應)為飽和雙環氮雜環丁烷的合成提供了新思路。該方法可直接構建雙環骨架,避免了傳統方法對預成型環狀底物的依賴。然而,該方法僅適用于[2+2]環化反應,難以實現環尺寸的靈活調控。
近年來,自由基-極性交叉環化(RPCC)反應受到了廣泛關注,特別是Molander、Aggarwal、Shu、Huang、Lin和Lu等課題組開發的一系列創新方法,實現了溫和條件下從取代烯烴出發合成飽和碳環和雜環化合物。作者設想:若能實現取代烯烴與N-芳基環丙胺之間的自由基-極性交叉雙環化反應,將為構建不同環尺寸的雙環胺化合物庫提供重要合成工具。但這一設想面臨兩大挑戰:(1)環丙胺的1,3-雙官能團化反應較為常見,而更具合成價值的三官能團化反應卻鮮有報道,極具挑戰性;(2)環化反應通常需要精確控制反應位點間距,開發一種普適性的方法來實現不同尺寸(特別是中小環系)環胺的合成仍面臨巨大挑戰。本研究,作者報道了一種光誘導自由基-極性交叉雙環化反應,實現了環丙胺與取代烯烴的高效轉化(圖1d)。這種自由基-極性交叉雙環化策略為飽和雙環胺的從頭合成提供了便捷途徑。特別值得注意的是,該方法采用相同的底物設計和相同的合成路線,以模塊化的方式高效構建具有重要藥用價值的4/5-、5/5-、6/5-、7/5-和5/6-并環飽和雙環胺,并表現出優異的立體選擇性。
研究內容
條件篩選
作者以環丙胺(1a)和取代烯烴(2a)作為模型底物開始反應條件的優化研究(表1)。實驗結果表明,在450-455 nm藍光LED照射24小時條件下,以Ir(dtbbpy)(ppy)2PF6(1 mol%)為光催化劑,K2HPO4(50 mol%)為堿,PhCl(0.1 M)為溶劑體系,可以81%的分離收率獲得目標產物3,且表現出優異的非對映選擇性(表1,entry 1)。值得注意的是,溶劑效應對反應活性和選擇性具有顯著影響:鹵代苯類溶劑(PhCl和PhF)表現出最佳反應效果,而PhMe、DMF和DMA等溶劑則導致產物收率明顯降低(entries 1-5)。在光催化劑篩選實驗中,fac-Ir(ppy)3、Ru(dbz)3(ppy)2和4CzIPN等光催化劑均表現出不同程度的催化效率下降(entries 6-8)。堿用量研究表明,K2HPO4用量增加或減少均會導致產物收率降低(entry 9)。采用2a'、2a''和2a'''替代2a時,產物3的分離收率分別為53%、68%和66%(entry 10)。值得注意的是,該反應對氧氣敏感,在空氣氛圍下完全抑制了反應進行(entry 11)。進一步的控制實驗證實,可見光和光催化劑均為該轉化反應的必要條件(entries 12-13)。
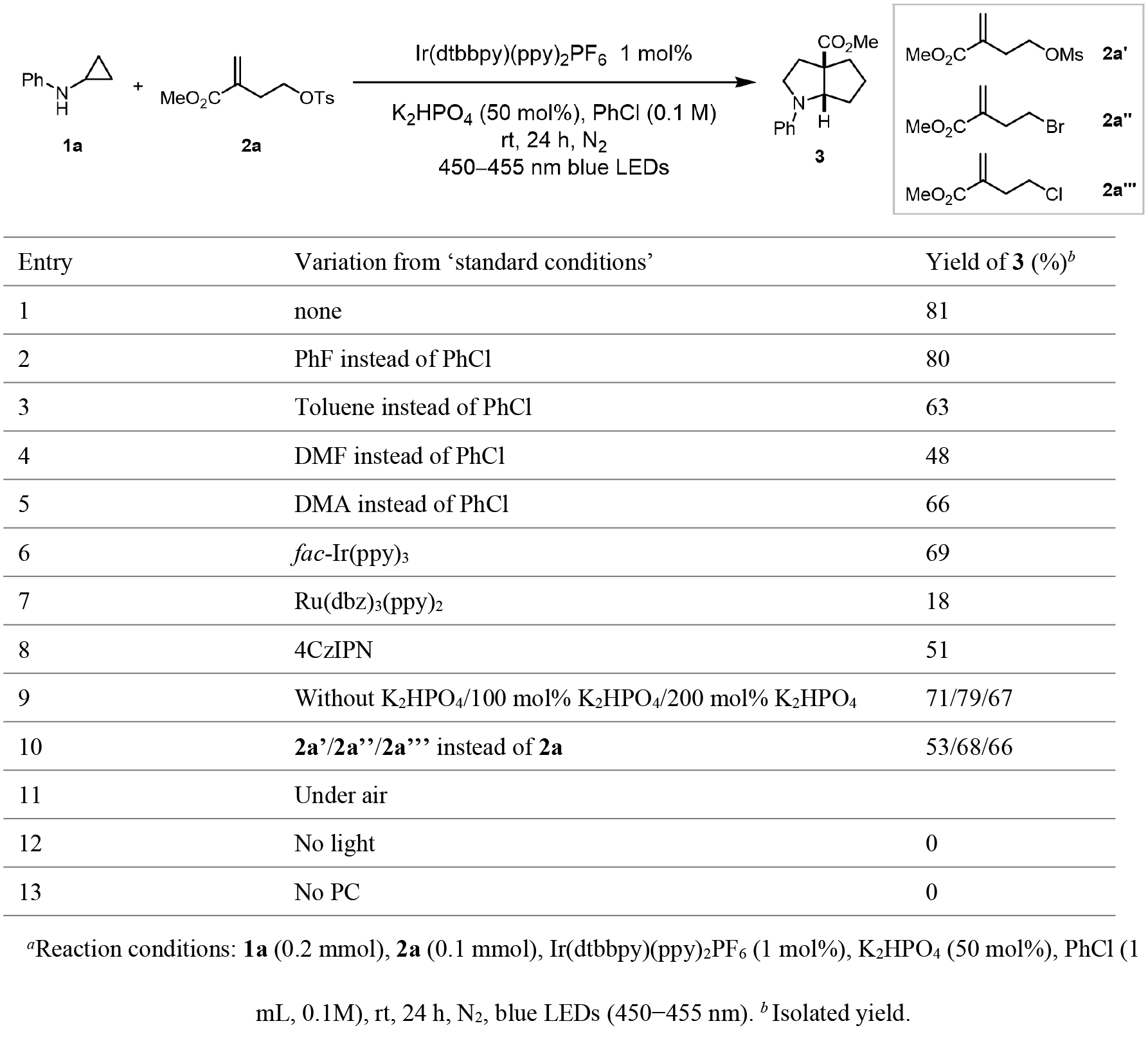
表1. 條件篩選
底物范圍
在最優反應條件下,作者繼續探究了該反應的底物適用范圍。如表2所示,首先系統考察了不同取代基修飾的環丙胺類底物的適用范圍。實驗結果表明,芳環上帶有不同電子效應取代基(包括供電子基團如甲基、正丁基、叔丁基二甲基硅氧基、甲氧基、乙氧基、二甲基等,以及吸電子鹵素如氟、氯、碘)的環丙胺均能順利參與反應,以中等至良好的收率(47–82%)獲得目標產物(4–16)。特別值得注意的是,含三氟甲氧基(17)和三氟甲基(18)類藥物優勢結構的底物表現出優異的反應性,分別以67%和81%的收率獲得相應產物。此外,4-苯基取代(19,72%)、萘基取代(20,55%;21,35%)以及含苯并呋喃"優勢骨架"(22)的環丙胺類底物均展現出良好的兼容性。
在烯烴底物適用范圍研究方面,多種官能團化烯烴(1b–1r)均能高效參與轉化。其中,不同酯基取代的烯烴(1b–1f)以64–83%的收率生成相應雙環吡咯烷產物(23–27)。值得注意的是,含氰基(1o)、酰基(1p)、羰基(1q)和硝基(1r)等活性官能團的芳基烯烴(1g–1r)同樣適用,以中等收率(52–78%)獲得目標產物(28–39),這為后續結構修飾提供了豐富可能。
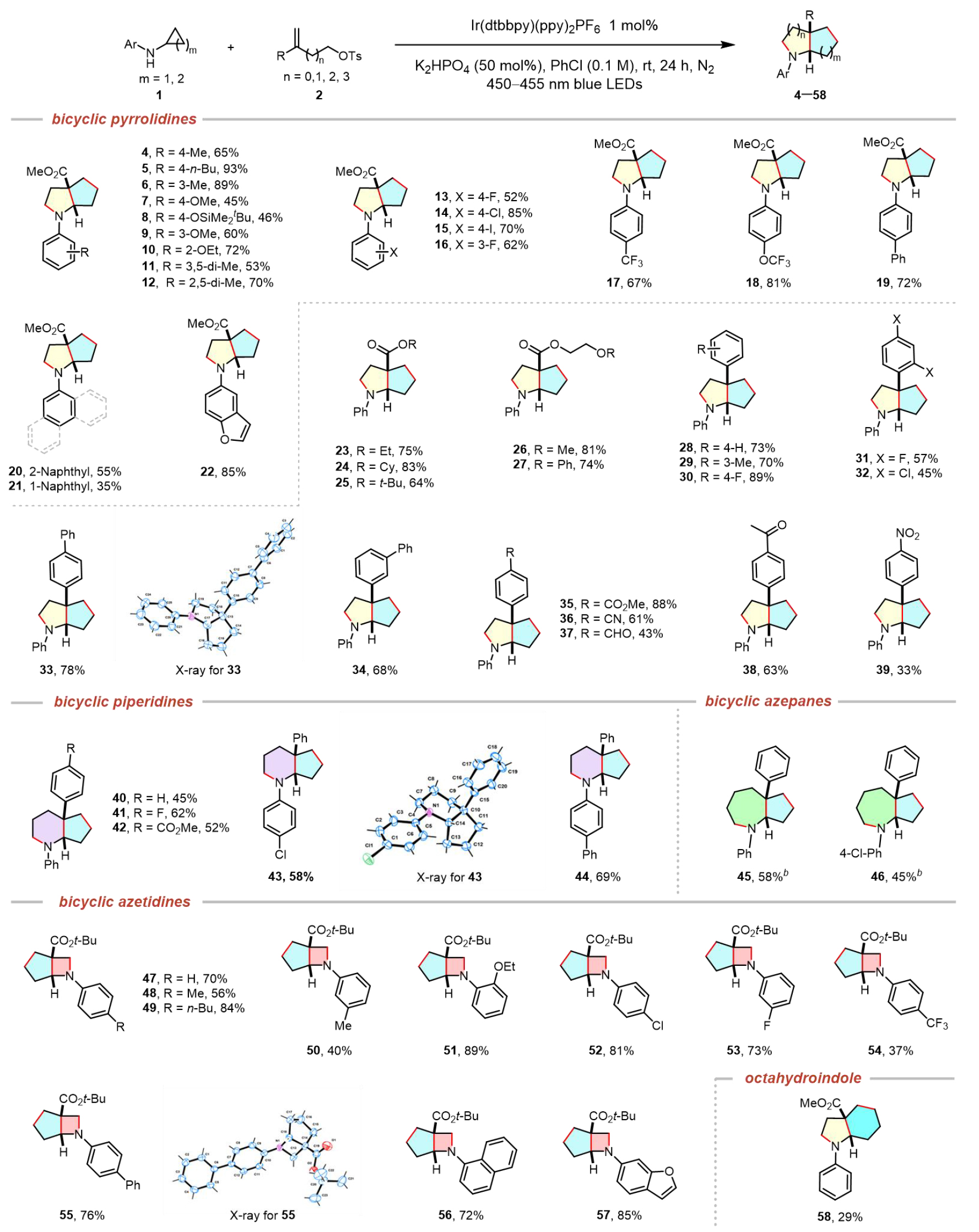
圖2. 底物適用性探究
為進一步拓展該方法的應用范圍,作者通過改變取代烯烴鏈長度實現了不同環系尺寸的精準調控。實驗結果表明,該策略對雙環哌啶類化合物(40–44)的合成具有顯著普適性。經反應條件微調后,也能以中等收率獲得雙環氮雜庚烷(45,46)。特別值得關注的是,在藥物研發領域,氮雜環丁烷作為一類小分子雜環化合物,因其相較于常見的五元、六元和七元環胺類化合物展現出更優異的藥代動力學特性而備受關注。然而,傳統適用于其他尺寸環胺合成的成熟方法在構建氮雜環丁烷骨架時往往表現不佳。該研究通過縮短取代烯烴的烷基鏈長,在最優條件下成功實現了取代烯烴2x與各種N-芳基環丙胺類化合物的高效反應,以良好至優異的收率獲得目標雙環氮雜環丁烷產物(47–57)。此外,N-苯基環丁胺作為底物也展現出一定的反應活性,能夠以29%的分離收率獲得八氫吲哚產物58。盡管該收率相對較低,但這一結果充分證明該反應體系能夠兼容環丁烷這一稍大環系的骨架構建。
合成應用
基于前期廣泛的底物適用性研究結果,作者進一步探究了該雙環化反應的實用價值。實驗表明,多種生物活性分子(包括洛索洛芬、3-吲哚乙酸、芬布芬、伊索克酸和舒巴坦)衍生的烯烴類底物,以及(-)-薄荷醇衍生的共軛烯烴,均能順利參與反應,以中等至良好的收率(52–78%)獲得目標產物59–65(圖3a)。值得關注的是,該反應在放大至3.0 mmol規模時仍能保持穩定的收率(圖3b)。通過NaBH4還原產物3,可以85%的高收率獲得環烷醇衍生物66(圖3c左)。此外,該方法可高效實現非布司他和吲哚美辛等藥物分子與66的偶聯(圖3c右),充分展現了其在藥物修飾中的應用潛力。此外,通過選擇性脫除PMP保護基,可以66%的收率獲得產物69(圖3d),為后續結構衍生化提供了便利。
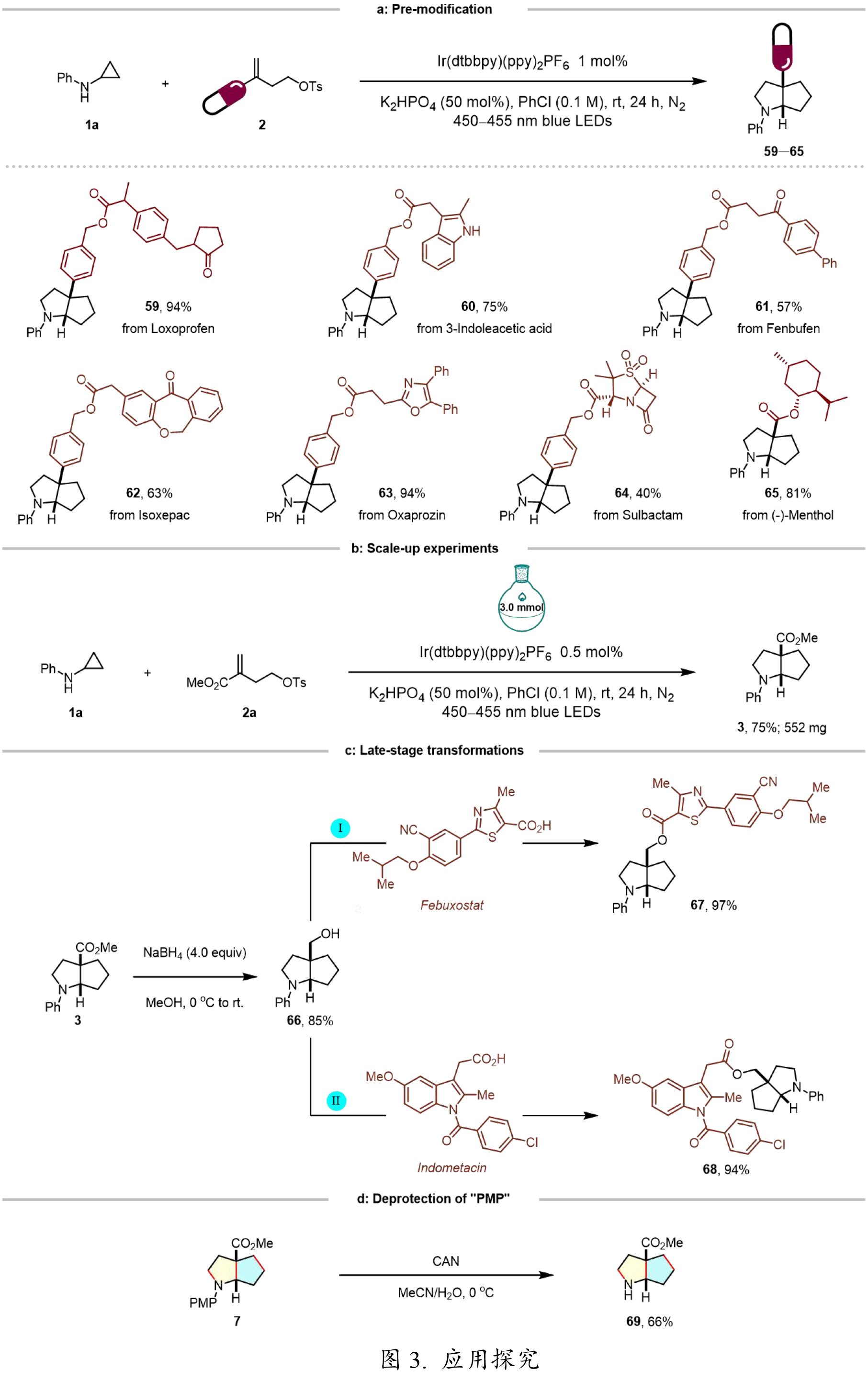
圖3. 應用探究
機理研究
為了更好地了解反應機理,作者開展了一系列控制實驗(圖4)。自由基捕獲實驗表明,當加入2,2,6,6-四甲基哌啶-1-氧基(TEMPO)或丁基羥基甲苯(BHT)時,完全抑制了目標產物3的生成,同時通過高分辨質譜(HRMS)檢測到相應的TEMPO/BHT加合物(圖4A, B),這證實了反應過程中經歷了自由基中間體。為進一步驗證雙環化反應的歷程,作者設計了兩組關鍵對照實驗:在無光照和光催化劑的條件下,反應體系未能生成親核取代產物3a(圖4C);而環丙胺1a與4-羥基-2-亞甲基丁酸乙酯(2b')可發生[3+2]環化反應生成產物70(圖4D),這一結果表明自由基環化過程可能是該轉化的起始步驟。
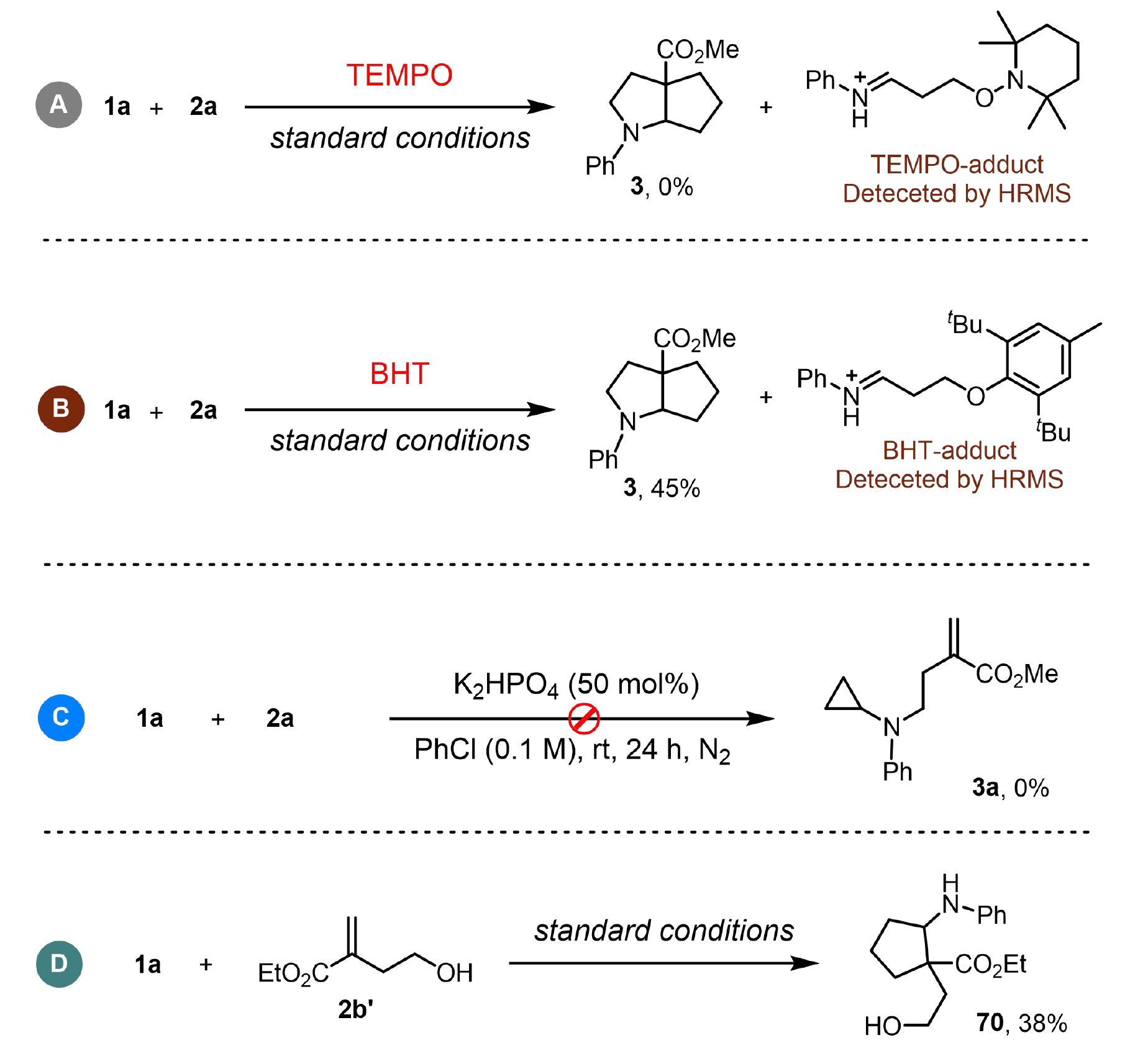
圖4. 控制實驗
基于上述機理研究及文獻報道,作者提出如圖5所示的可能反應機理:首先,光激發Ir(dtbbpy)(ppy)?PF? (IrIII)產生激發態光催化劑Ir(dtbbpy)(ppy)?PF?* (IrIII*)。隨后,IrIII*與N-芳基環丙胺發生單電子轉移(SET)過程,使光催化劑被還原為IrII,同時N-芳基環丙胺被氧化為自由基陽離子中間體I。該中間體I通過開環過程轉化為烷基自由基物種II。接著,II與取代烯烴2發生自由基加成反應,形成自由基中心位于叔碳位的自由基陽離子III。隨后,III經過自由基環化反應生成自由基陽離子IV。中間體IV與光催化劑(IrII)發生第二次SET完成光氧化還原催化循環,并產生中間體V。最后,通過4、5、6或7-exo-tet環化反應生成飽和雙環胺類產物。
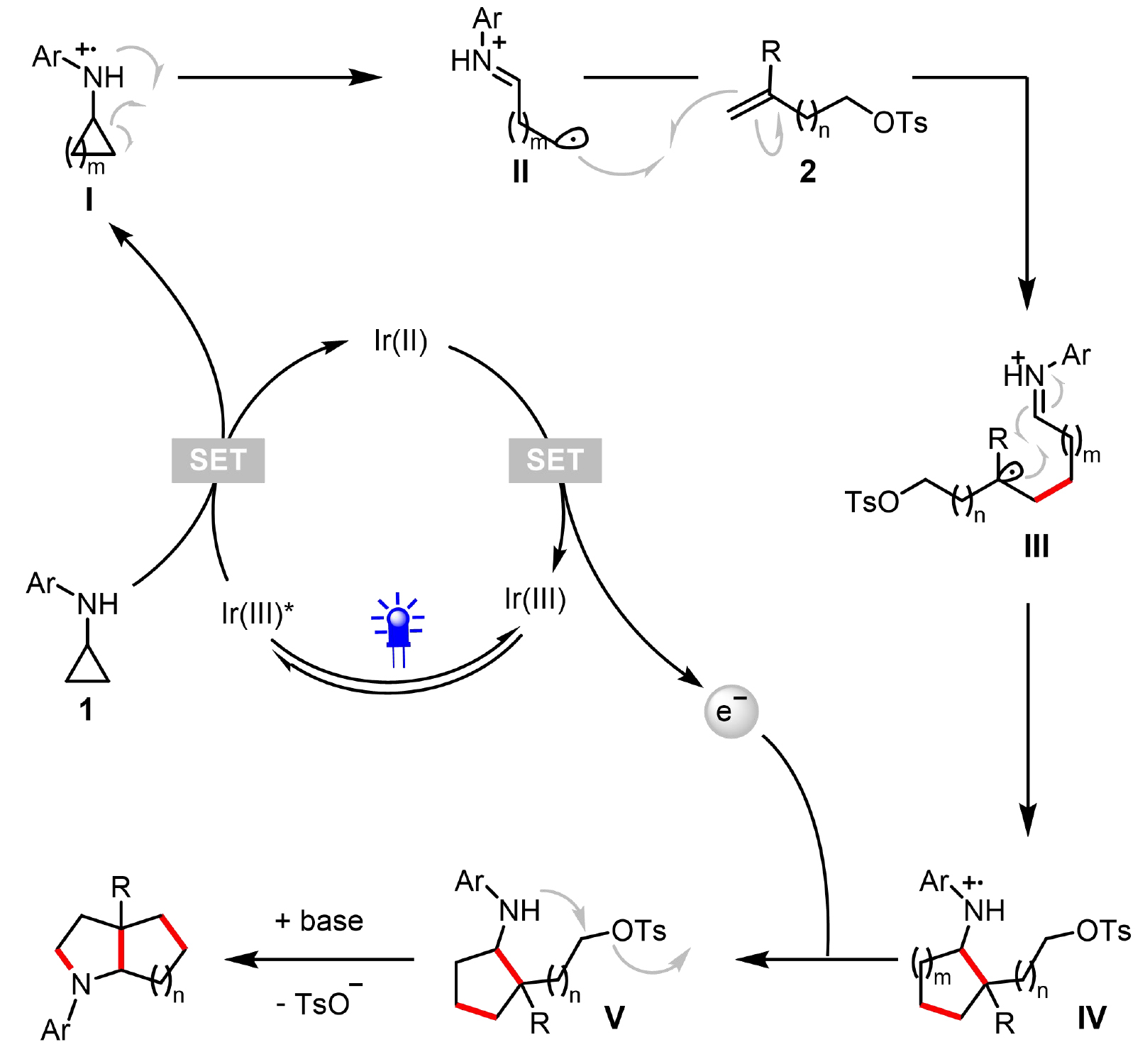
圖5. 推測的機理
總結
綜上所述,耿肖/王磊團隊創新性地將光氧化還原催化與自由基-極性交叉環化(RPCC)過程相結合,開發了一種普適性的雙環化策略,實現了以簡單易得的環丙胺和取代烯烴為原料,高效、模塊化地合成多種飽和雙環胺類化合物。這一模塊化合成方法具有以下顯著優勢:
1.通過簡單調節鏈長度,可系統構建4~7元雙環胺化合物,顯著提高結構多樣性,并展現出優異的非對映選擇性和廣泛的官能團兼容性。
2.實現了環丙胺的三官能團化反應(開環、雙鍵加成、環化),拓展了該明星分子的反應模式。
3.所得飽和雙環胺具有高Fsp3值,符合現代藥物設計“逃離平面性”的趨勢,展現出重要的應用潛力。
未來,這一策略有望在天然產物全合成、藥物結構優化和生物活性分子庫構建中發揮重要作用,尤其為氮雜環丁烷等傳統方法難以合成的小環體系提供了簡便高效的制備途徑。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn