



正文
手性胺是藥物分子的核心骨架,也是不對(duì)稱催化中重要的手性配體與催化劑。2023年全球暢銷前200的小分子藥物中,約36%至少含一個(gè)手性胺單元。此外,含雙手性中心的α-手性伯胺因獨(dú)特生物活性及合成價(jià)值備受關(guān)注。由于手性分子與生物靶點(diǎn)的三維相互作用會(huì)直接影響其生理和藥理活性,因此發(fā)展α-手性伯胺的高效立體發(fā)散合成新方法具有重要意義。從未保護(hù)伯胺出發(fā),直接實(shí)現(xiàn)其不對(duì)稱α-C-H官能化具有較高的原子經(jīng)濟(jì)性與步驟經(jīng)濟(jì)性。然而,伯胺的強(qiáng)堿性易與金屬催化劑發(fā)生配位,導(dǎo)致催化劑失活,同時(shí)其作為親核試劑易發(fā)生N-官能化副反應(yīng)。因此,在多金屬體系下實(shí)現(xiàn)未保護(hù)伯胺的立體發(fā)散性不對(duì)稱α-C-H官能化仍面臨重大挑戰(zhàn)(圖1)。
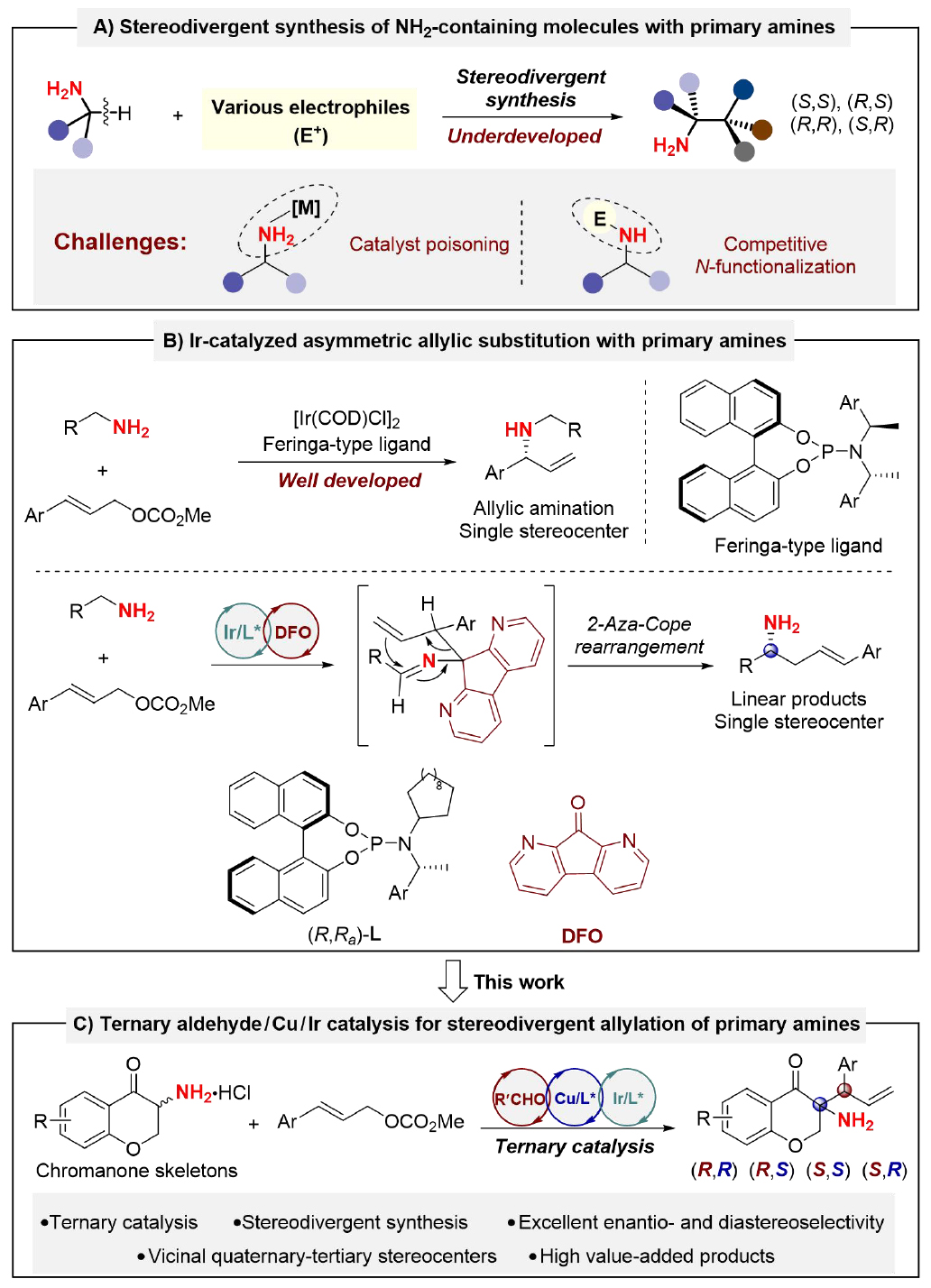
圖1:從未保護(hù)伯胺出發(fā)立體發(fā)散性合成含兩個(gè)手性中心的含NH2分子
上海交通大學(xué)張萬斌教授課題組長(zhǎng)期致力于雙手性金屬協(xié)同催化體系的開發(fā)及其立體發(fā)散性合成研究,并取得了一系列的原創(chuàng)性成果。2016年,該課題組報(bào)道了第一例基于雙手性金屬Ir/Zn協(xié)同催化策略的立體發(fā)散性反應(yīng)(J. Am. Chem. Soc.2016, 138, 11093),隨后又開發(fā)了Ir/Cu、Pd/Cu和Ni/Cu等多種雙手性金屬協(xié)同催化體系,并成功應(yīng)用于含兩個(gè)手性中心化合物的高效不對(duì)稱合成(J. Am. Chem. Soc. 2018, 140, 2080; J. Am. Chem. Soc. 2020, 142, 8097; CCS Chem. 2021, 4, 1720; J. Am. Chem. Soc. 2021, 143, 12622; Angew. Chem. Int. Ed. 2021, 60, 24941; Angew. Chem. Int. Ed. 2022, 61, e202203448; Angew. Chem. Int. Ed. 2022, 61, e202210086; Angew. Chem. Int. Ed. 2023, 62, e202218146; Angew. Chem. Int. Ed. 2023, 62, e202305680; Angew. Chem. Int. Ed. 2023, 62, e202313838; CCS Chem. 2024, 6, 2452; J. Am. Chem. Soc. 2024, 146, 9241; Angew. Chem. Int. Ed. 2024, 63, e202407498; J. Am. Chem. Soc. 2024, 146, 26121;Science 2024, 385, 972)。近日,上海交通大學(xué)張萬斌團(tuán)隊(duì)開發(fā)了一例醛/銅/銥三元催化體系,能夠直接對(duì)未保護(hù)的伯胺進(jìn)行α-C-H官能化,具有優(yōu)異的對(duì)映和非對(duì)映選擇性,并且可以立體發(fā)散地合成含有兩個(gè)相鄰立體中心的α-手性伯胺的所有立體異構(gòu)體。該方法避免了傳統(tǒng)方法中需要保護(hù)胺基的步驟,極大提高了原子經(jīng)濟(jì)性和步驟效率(圖1C)。
為了開發(fā)高效的α-手性伯胺不對(duì)稱合成方法,作者以α-氨基色滿酮1a與肉桂基碳酸酯2a為模型底物,在THF溶劑中,以Na?CO?為堿,優(yōu)化了三元催化體系(圖2)。初始實(shí)驗(yàn)中,無醛催化劑時(shí)僅獲得痕量目標(biāo)產(chǎn)物3aa及15% N-烯丙基化副產(chǎn)物。添加苯甲醛4a后,3aa產(chǎn)率提升至21%(>12:1 dr, 97% ee)。進(jìn)一步篩選醛類催化劑發(fā)現(xiàn),環(huán)己醛4c可將產(chǎn)率提升至48%(entry 1, >20:1 dr, >99% ee)。通過優(yōu)化酸堿添加劑(TFA/Na?CO?)和溶劑,最終在60 mol% 4c條件下獲得91%產(chǎn)率(entry 13, >20:1 dr, >99% ee)。對(duì)照實(shí)驗(yàn)證實(shí)銥、銅、醛催化劑缺一不可(entries 14-16)。
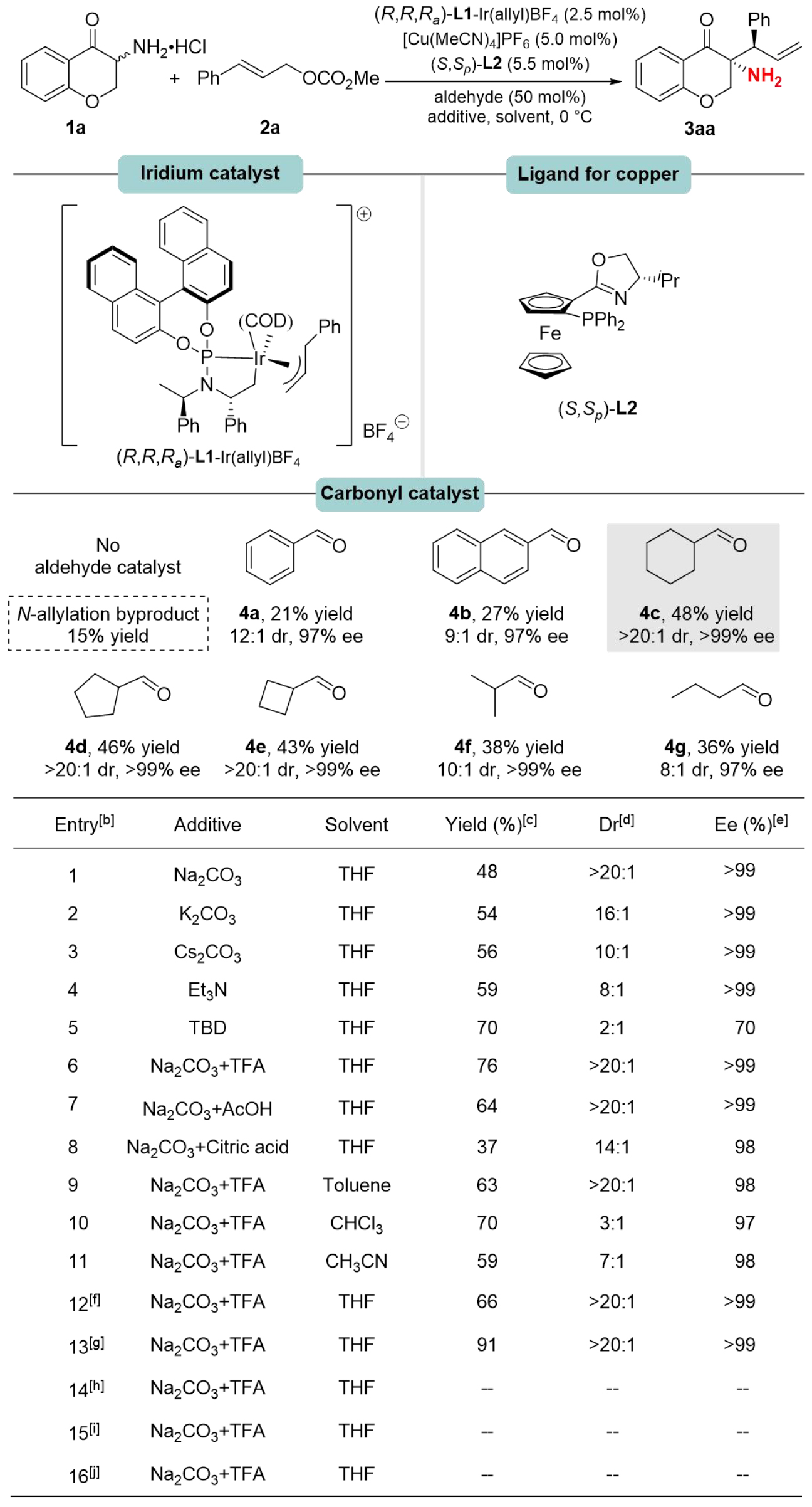
圖2:條件優(yōu)化
在確定最優(yōu)條件后,作者對(duì)烯丙基碳酸酯的底物范圍進(jìn)行了考察(圖3)。實(shí)驗(yàn)結(jié)果表明,不同取代基的芳基烯丙基碳酸酯(包括給電子基、吸電子基團(tuán))均能順利反應(yīng),以良好的產(chǎn)率生成產(chǎn)物3ab-3al,并表現(xiàn)出出色的立體選擇性。此外,多環(huán)芳烴及雜芳烴類底物也表現(xiàn)良好(3ap-3as)。值得一提的是,使用源自天然產(chǎn)物(-)-myrtenal和helicid的碳酸酯,也成功合成了目標(biāo)產(chǎn)物3at和3au。此外,烷基取代的碳酸酯(2v和2w)在該三元體系中同樣具有良好兼容性。
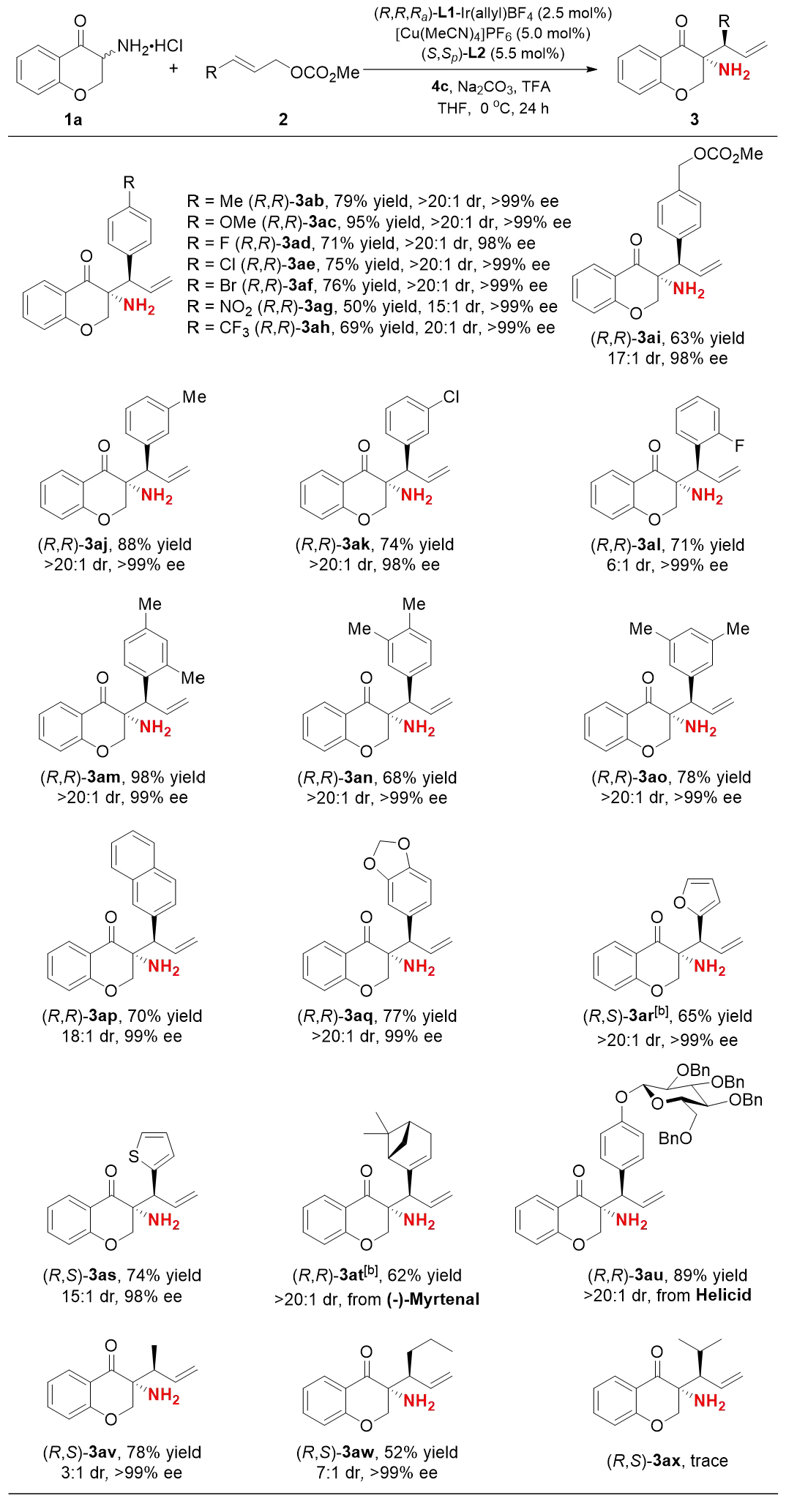
圖3:烯丙基碳酸酯的底物適用性
隨后,作者考察了不同的α-氨基色滿酮底物(圖4)。結(jié)果表明,芳環(huán)上不同位置、不同電性的取代基幾乎不影響產(chǎn)率和立體選擇性(3ba-3ja)。此外,萘酮或硫代色滿酮骨架的伯胺類底物也表現(xiàn)良好(3ka、3la)。然而,使用α-氨基吡喃酮底物時(shí),產(chǎn)率下降至35%,但立體選擇性仍然良好。值得注意的是,作者嘗試開鏈α-氨基酮(如2n和2o)時(shí),反應(yīng)幾乎不發(fā)生,可能歸因于這些底物的更大位阻。
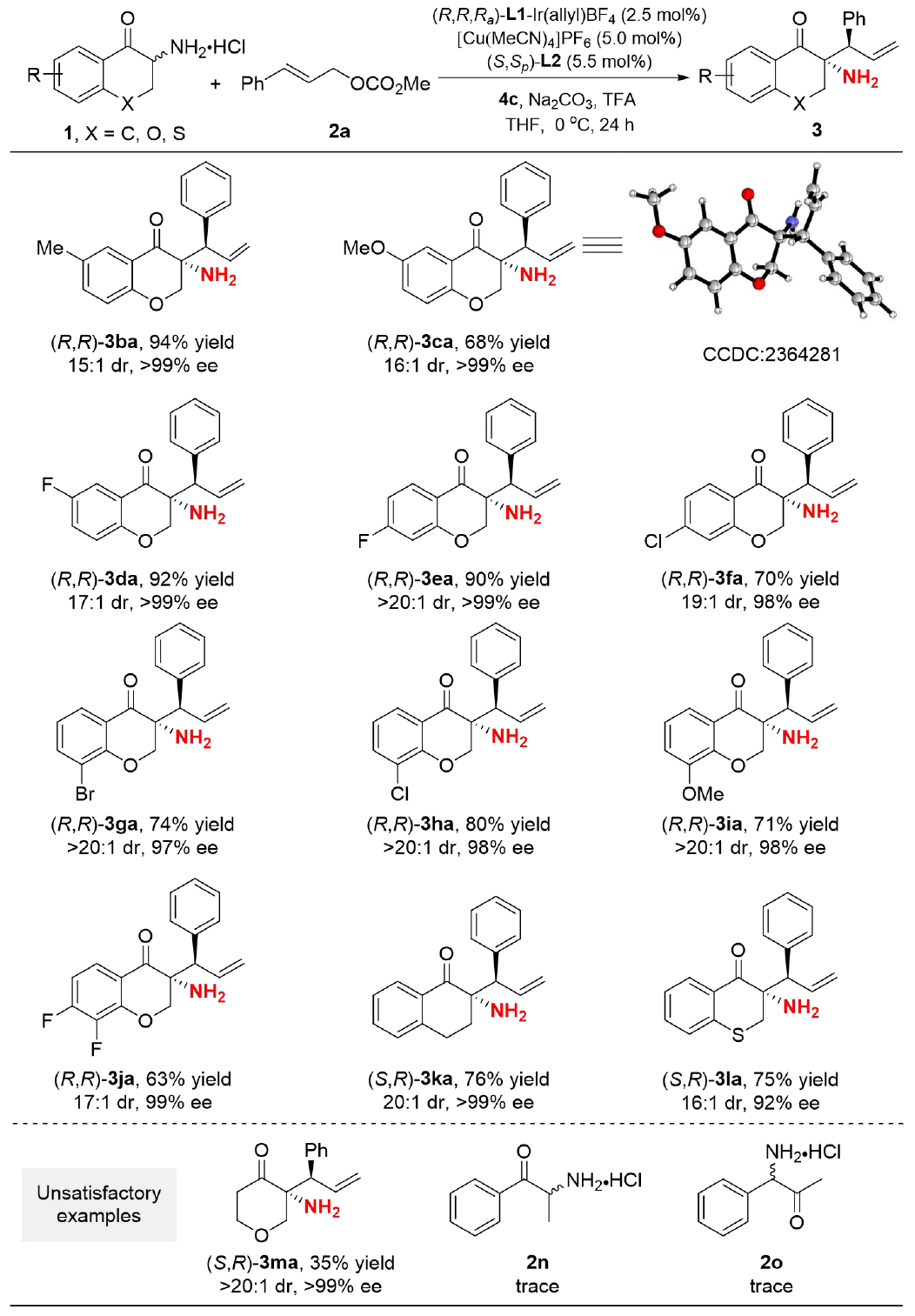
圖4:α-氨基色滿酮底物的底物適用性
作者從相同的底物出發(fā),僅僅通過改變兩種手性金屬催化劑配體的構(gòu)型組合即可獲得含雙手性中心手性伯胺的全部四種立體異構(gòu)體,且反應(yīng)具有較好的產(chǎn)率和優(yōu)異的非對(duì)映選擇性和對(duì)映選擇性(圖5)。
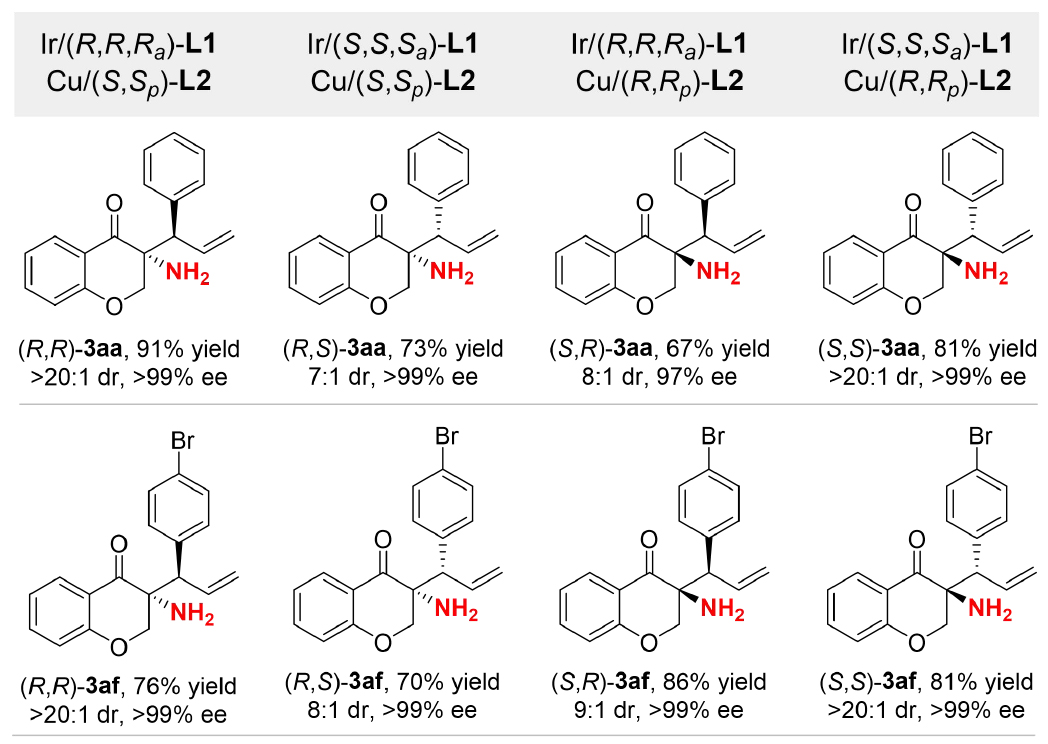
圖5:立體發(fā)散性合成
為深入理解該三元催化體系的立體選擇性來源,作者通過DFT計(jì)算對(duì)不同過渡態(tài)和中間體的能量及相互作用進(jìn)行了詳細(xì)分析(圖6和圖 7)。DFT計(jì)算結(jié)果表明,在Cu/(S,Sp)-L2和Na2CO3的輔助下,α-氨基色滿酮1a與環(huán)己醛4c反應(yīng)生成兩種N-金屬亞甲胺葉立德Nu-1和Nu-2能量相差4.2 kcal/mol。IGMH分析表明Nu-1中由于底物與配體L2有四個(gè)強(qiáng)氫鍵的作用,因此會(huì)比Nu-2更穩(wěn)定(圖6A)。立體排斥分析表明Re面因鄰近i-Pr基團(tuán)而受較大位阻(圖6B),同時(shí)Si面通過膦基團(tuán)提供了更大的π界面及更強(qiáng)的吸引勢(shì)能(圖6C)。非對(duì)映選擇性分析表明過渡態(tài)TS-1-Si能量更低(7.8 kcal/mol),比TS-1-Re具有更多有利的色散作用(四處vs兩處)(圖7)。能量分解分析(EDA)表明TS-1-Si不僅相互作用能更優(yōu)(-56.1 kcal/mol vs -52.6 kcal/mol),而且扭曲能更低(20.5 kcal/mol vs 29.0 kcal/mol)。DFT計(jì)算與實(shí)驗(yàn)結(jié)果(>20:1 dr)保持一致。
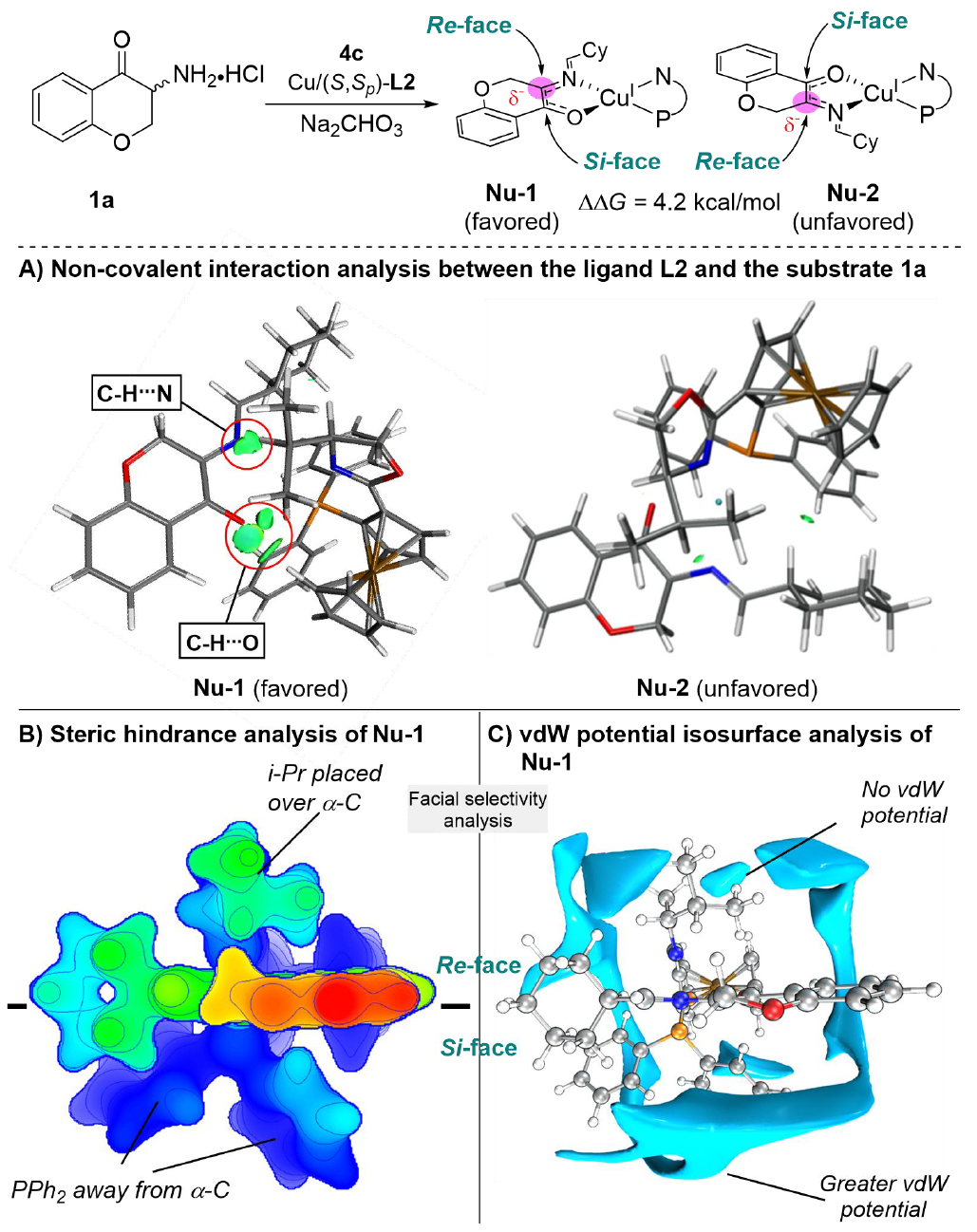
圖6:α-氨基色滿酮的α-立體選擇性來源分析
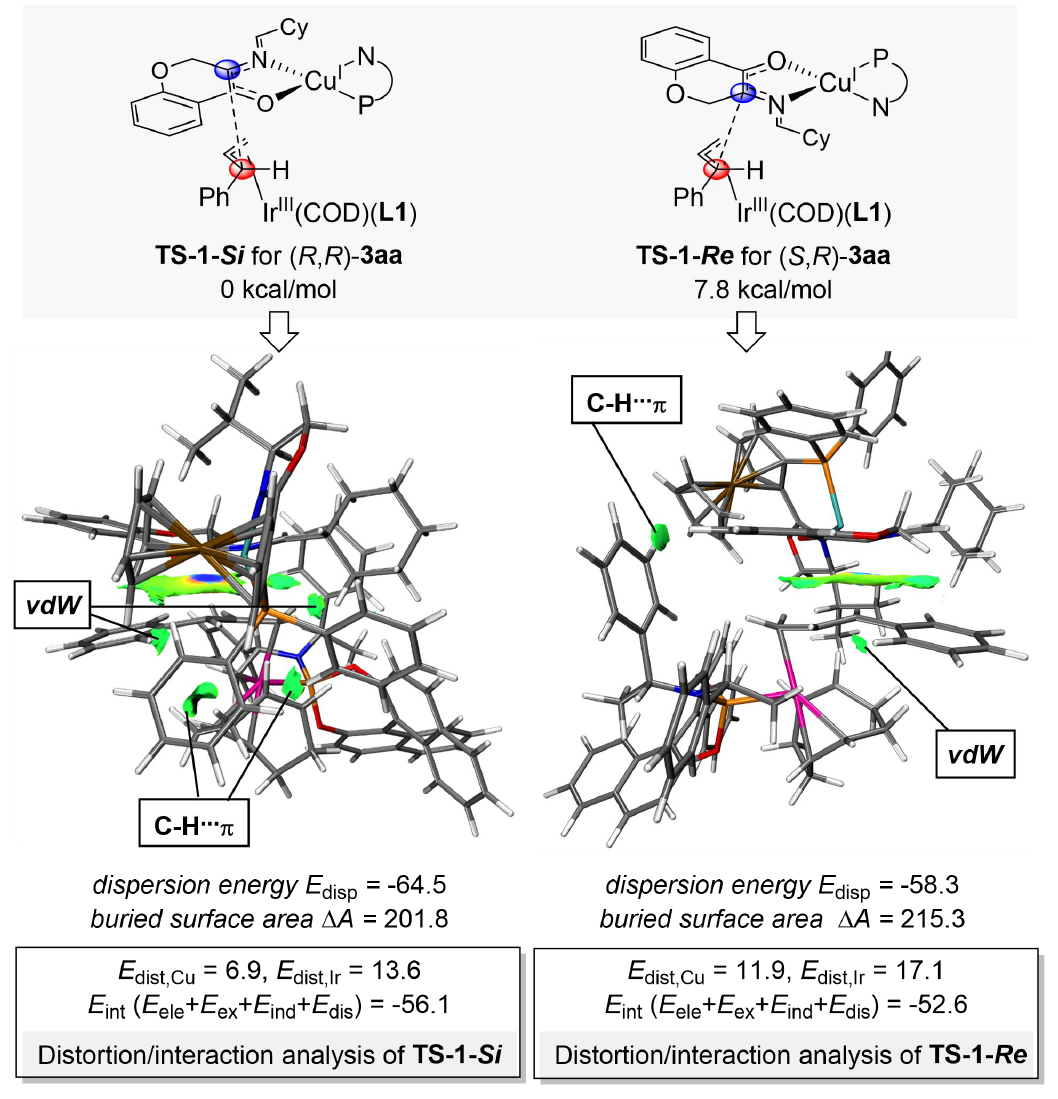
圖7:三元催化體系的非對(duì)映選擇性來源分析
根據(jù)DFT計(jì)算,作者提出了可能的催化循環(huán)(圖8)。首先α-氨基色滿酮1a和非手性醛催化劑4c生成亞胺中間體A;隨后,Cu/(S,Sp)-L2催化劑與A絡(luò)合生成親核性Cu-亞甲胺葉立德Nu-1;與此同時(shí),烯丙基碳酸酯2a與Ir/(R,R,Ra)-L1反應(yīng)生成親電性π-烯丙基-Ir中間體B;Nu-1由Si面捕獲中間體B,形成中間體C并釋放Cu和Ir金屬催化劑;最終,中間體C經(jīng)水解生成目標(biāo)產(chǎn)物3aa并再生醛催化劑4c。
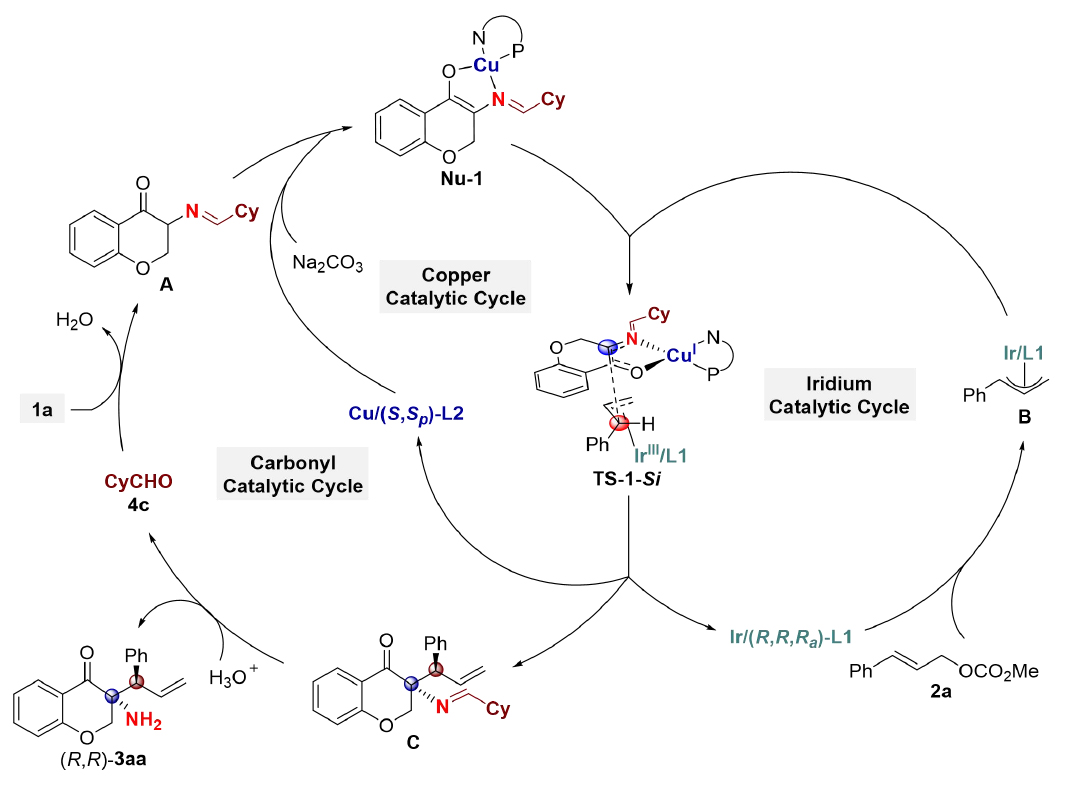
圖8:三元協(xié)同催化體系可能的催化循環(huán)
最后,作者對(duì)該反應(yīng)的轉(zhuǎn)化也進(jìn)行了研究。首先通過酰氯保護(hù)/NBS介導(dǎo)的分子內(nèi)環(huán)化串聯(lián)反應(yīng),高效構(gòu)建了具有螺環(huán)骨架的化合物5;隨后利用Boc保護(hù)以及與L-丙氨酸異丙酯的縮合反應(yīng),成功將手性氨基酸單元引入分子骨架,獲得結(jié)構(gòu)新穎的尿素類衍生物6;鈀碳催化氫化可實(shí)現(xiàn)烯烴雙鍵的完全還原,而NaBH4體系則選擇性的還原羰基,高效合成含三個(gè)連續(xù)手性中心的β-氨基醇化合物8;通過烯丙基格氏試劑的親核加成,實(shí)現(xiàn)了分子骨架的多烯功能化。這一系列衍生實(shí)驗(yàn)驗(yàn)證了產(chǎn)物存在潛在的應(yīng)用價(jià)值(圖9)。
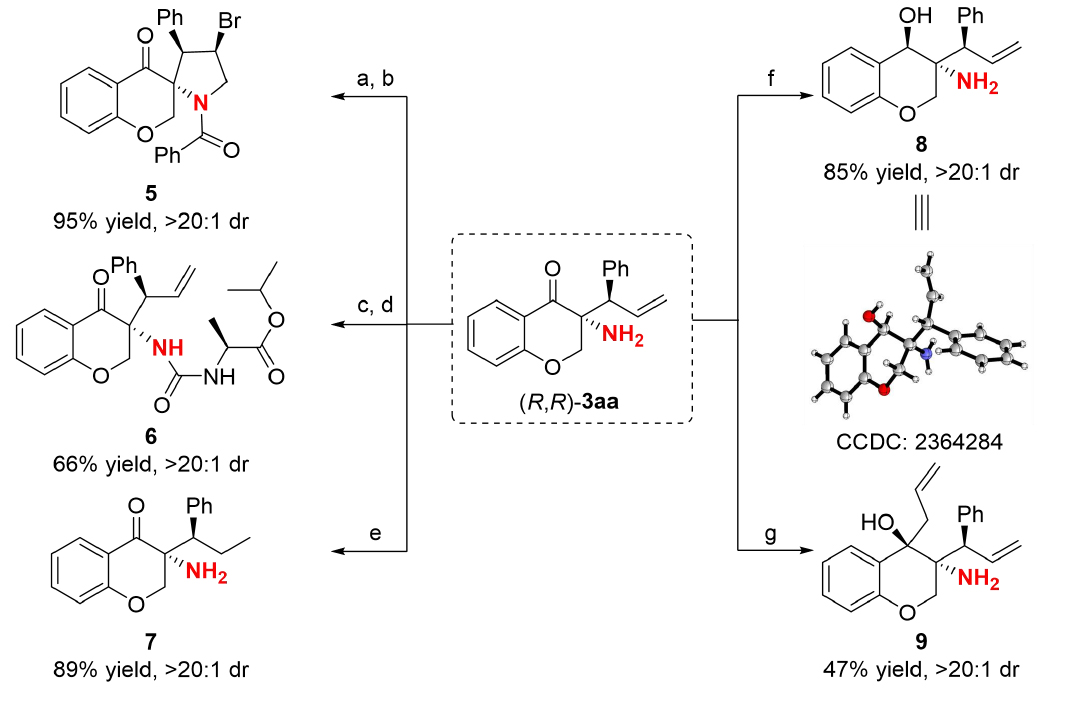
圖9:產(chǎn)物轉(zhuǎn)化
總結(jié)
綜上,該工作通過醛/Cu/Ir三元協(xié)同催化體系,實(shí)現(xiàn)了未保護(hù)伯胺的直接立體發(fā)散α-烯丙基化,高效合成一系列含雙手性中心的手性伯胺,具有較高的產(chǎn)率、非對(duì)映選擇性和對(duì)映選擇性。計(jì)算和實(shí)驗(yàn)結(jié)果表明,醛催化劑與手性銅催化劑的協(xié)同效應(yīng)是實(shí)現(xiàn)高立體選擇性α-C-H官能團(tuán)化的關(guān)鍵,為制備多手性中心伯胺提供了普適的不對(duì)稱催化策略。該成果近期發(fā)表在Angew. Chem. Int. Ed.上,碩士生劉紫嬌和博士后李盼盼為共同第一作者,上海交通大學(xué)張萬斌教授、霍小紅教授和上海交通大學(xué)附屬第六人民醫(yī)院南院孫振亮教授為共同通訊作者。
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請(qǐng)作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn