

(圖片來源:Nature)
正文
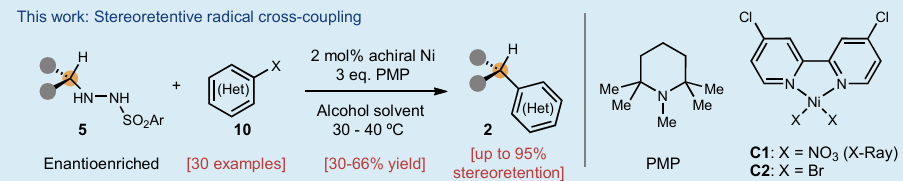
雖然自由基物種由Gomberg于120余年前發現,但自由基交叉偶聯反應則是由Kochi在20世紀70年代首次實現的。與化學家們廣泛應用的極性交叉偶聯反應(如Suzuki、Negishi、Kumada等反應)構建C(sp2)-C(sp2)鍵不同,自由基交叉偶聯在飽和體系的偶聯中具有顯著優勢,其溫和的反應條件及單電子化學特有的高化學選擇性使其成為理想選擇。事實上,利用普遍存在的碳基片段(如羧酸、醇、胺、烯烴等)進行交叉偶聯可以極大簡化復雜分子的合成路徑。然而,盡管其具有這些優勢,但涉及自由基的對映專一性偶聯反應至今未有報道。由于自由基在瞬間即會發生外消旋化,因此這類反應被普遍認為極具挑戰性。目前,僅能通過以下兩種方式控制自由基交叉偶聯的立體化學結果:1)使用手性配體進行調控;2)使用鄰近立體中心的誘導實現非對映選擇性控制。最近,美國斯克里普斯研究所Phil S. Baran課題組首次通過簡單易得的對映富集磺酰肼化合物與廉價非手性鎳催化劑組合,成功解決了這一長期難題。該方法無需外源氧化還原試劑或手性配體,即可實現對映體富集的烷基片段與(雜)芳基鹵化物的立體保持對映專一性自由基交叉偶聯反應(Figure 1)。歡迎下載化學加APP到手機桌面,合成化學產業資源聚合服務平臺。
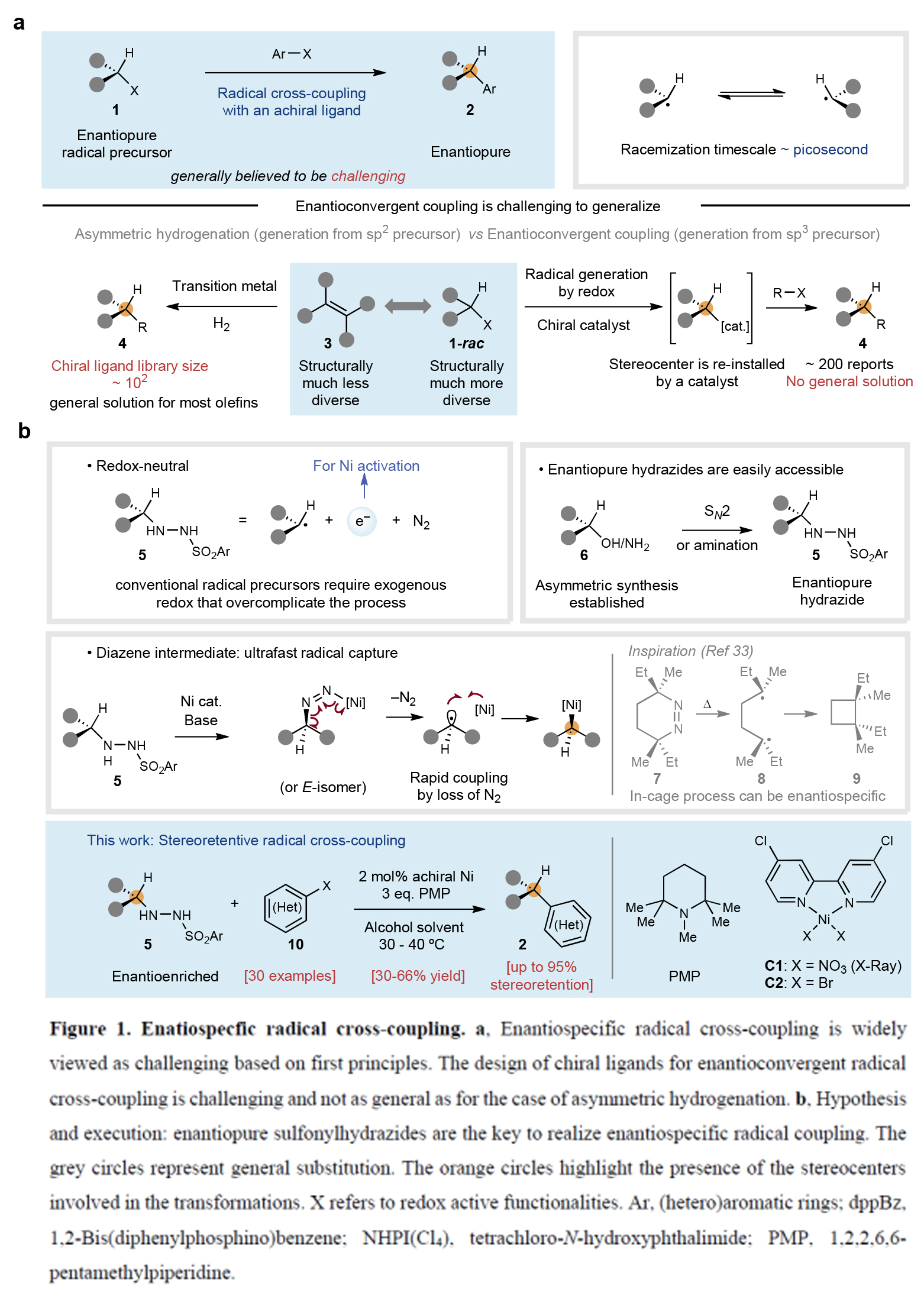
(圖片來源:Nature)
首先,作者以對映體富集的磺酰肼11和碘吡啶12作為模板底物對此轉化進行探索。通過一系列條件篩選,作者發現當使用條件A或條件B時,使用對映體比例為97.5:2.5的磺酰肼11為原料,可以46-55%的產率獲得產物13,產物的對映體比例分別為92.5:7.5或93.6:6.4(即對映選擇性保持率分別為89%或92%)(條件A:2 mol% C1, PMP (3.0 equiv), t-amyl alcohol (0.2 M);條件B:5 mol% C2, PMP (3.0 equiv), carveol (0.2 M))。作者通過將Cbz保護基替換為Ts基團后進行X-射線晶體學分析,確認了產物的絕對構型(立體構型保持)。這兩組最終優化的反應條件極為簡便且相似:使用廉價的醇類作為溶劑(濃度0.2 M),簡單的叔胺堿,溫和加熱條件,以及2-5 mol%負載量的廉價鎳催化劑(Figure 2a)。
在得到了最優反應條件后,作者對此轉化的底物范圍進行了考察(Figure 2b)。實驗結果表明一系列不同的環骨架,如吡啶、嘧啶、噠嗪、吡啶酮、芳烴等均可兼容。此外,一系列不同的吸電子基、給電子基以及鹵原子同樣可兼容此轉化。值得注意的是,含鄰位取代基的底物以及游離的苯胺均可實現轉化。總體來講,該轉化具有良好的底物適用性和官能團兼容性,以30-57%的產率,良好的對映選擇性得到相應的產物16-41。
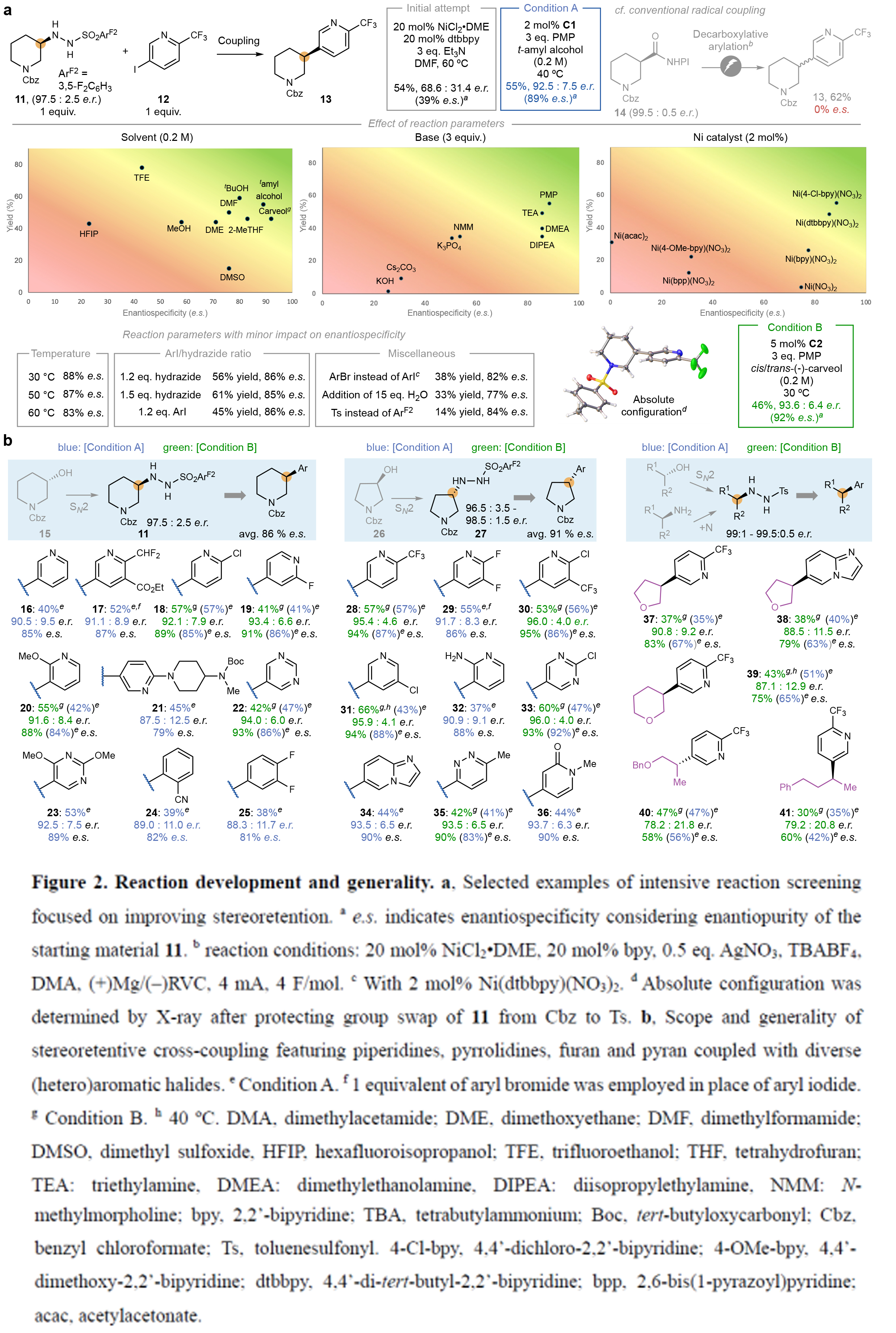
(圖片來源:Nature)
為了證明此轉化的實用性,作者以利用11和42作為起始原料,利用此策略可以以兩步(41%,85%)35%的總產率得到手性哌啶產物46(95.2:7.8 er; 89% e.s.)。而文獻報道的合成路徑則需要五步,僅以19%的總產率得到46(Figure3a)。此外,當利用27和47作為起始原料,利用此策略可以以兩步(52%,96%)得到手性哌啶產物51(93.5:6.5 er; 94% e.s.)。這與文獻報道的需要六步3%的總收率相比具有較大的優勢。
隨后,作者通過考察非對映選擇性控制進一步探究了該反應的立體保持特性(Figure3b)。現有文獻充分證實,自由基交叉偶聯會重置反應中心的立體構型,其立體化學結果由預先存在的立體中心所決定。基于此,作者將外消旋哌啶酮52經NaBH4還原得到醇53(反式/順式=3:1)。其中順式異構體53a轉化為相應的反式磺酰肼54a,與底物12偶聯后以20:1的選擇性得到反式構型哌啶55a。值得注意的是,由反式醇53b制備的順式碘化物56b,在三種不同溶劑中進行常規電催化自由基交叉偶聯條件時,仍主要生成反式產物55a。與之形成鮮明對比的是,反式醇53b可轉化為保持順式構型的磺酰肼54b,最終以5:1的非對映選擇性(硅膠柱層析易分離)獲得順式主產物55b。類似地,3-羥基脯氨酸衍生的順/反式磺酰肼57與12進行偶聯時,分別以立體保持的方式得到順式加合物58a(反/順=1:5.5)和反式加合物58b(反/順=15.6:1)。作為對照實驗,作者采用經典電催化自由基偶聯條件時,無論使用順式或反式碘化物59與12反應,均主要生成反式加合物58(反/順=8.1-8.2:1)。
接下來,作者通過克級規模實驗驗證了該反應的實用性(Figure3c)。作者以磺酰肼11和芳基碘化物12為原料制備哌啶13。在不改變標準反應條件的情況下,偶聯反應順利進行,以50%的分離收率和84%的對映選擇性(e.s.)獲得加合物13。鑒于工藝化學中已知對映體富集物質可通過重結晶純化,作者脫除Cbz保護基后,僅經過一輪重結晶即可獲得脫保護哌啶產物,其立體純度提升至>99.9:0.1 e.r.。
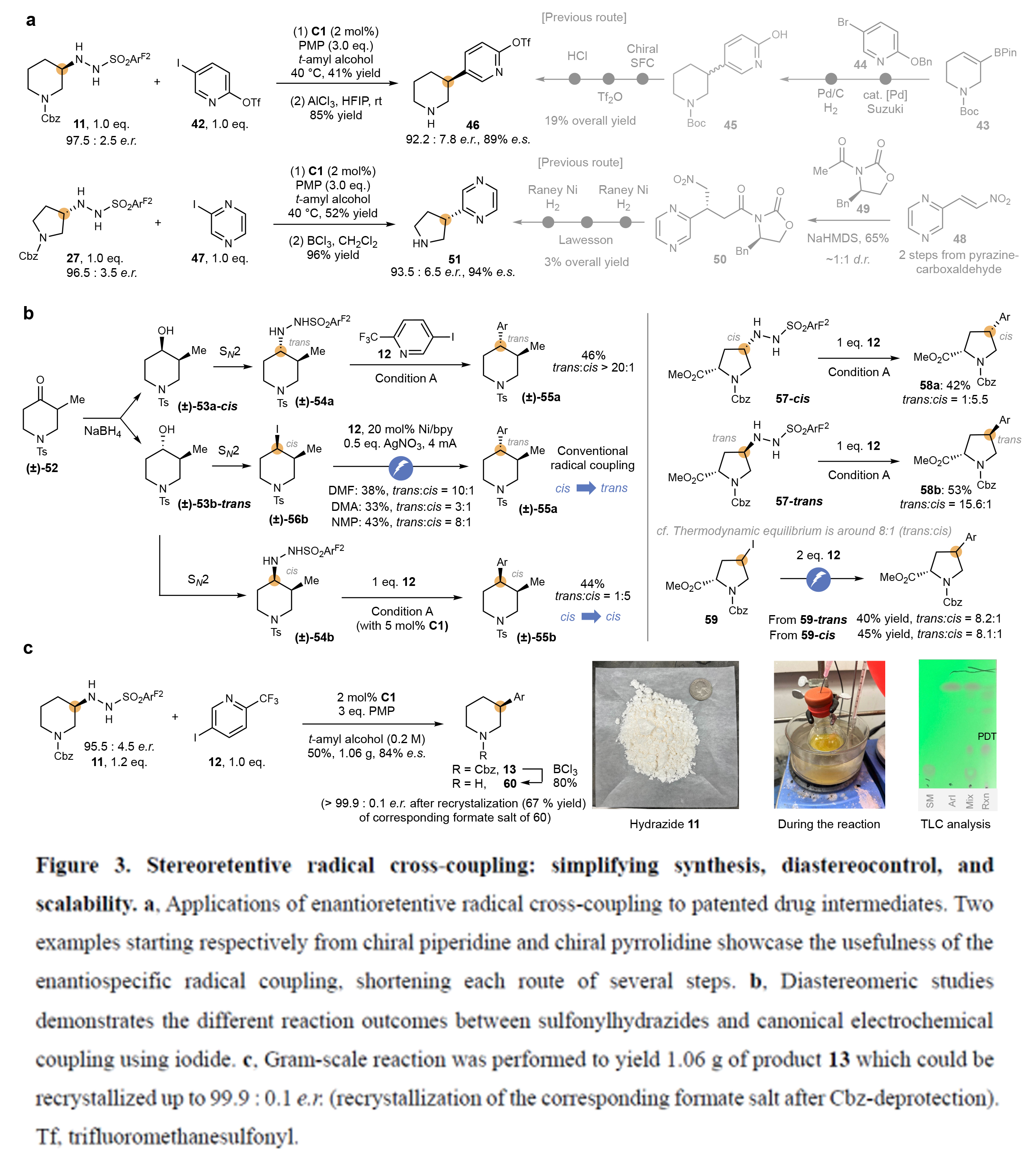
(圖片來源:Nature)
最后,作者對此過程進行了機理探索(Figure4)。作者通過DFT計算,得出此反應通過一種獨特的含二氮烯鎳過渡態進行,其C-C鍵的形成由N2的釋放來驅動。此外,作者通過控制實驗得出該反應是通過內球自由基交叉偶聯機制實現了立體構型保持,這一機制成功規避了傳統鎳(II)催化體系形成C(sp2)-C(sp3)鍵時所面臨的熱力學障礙。
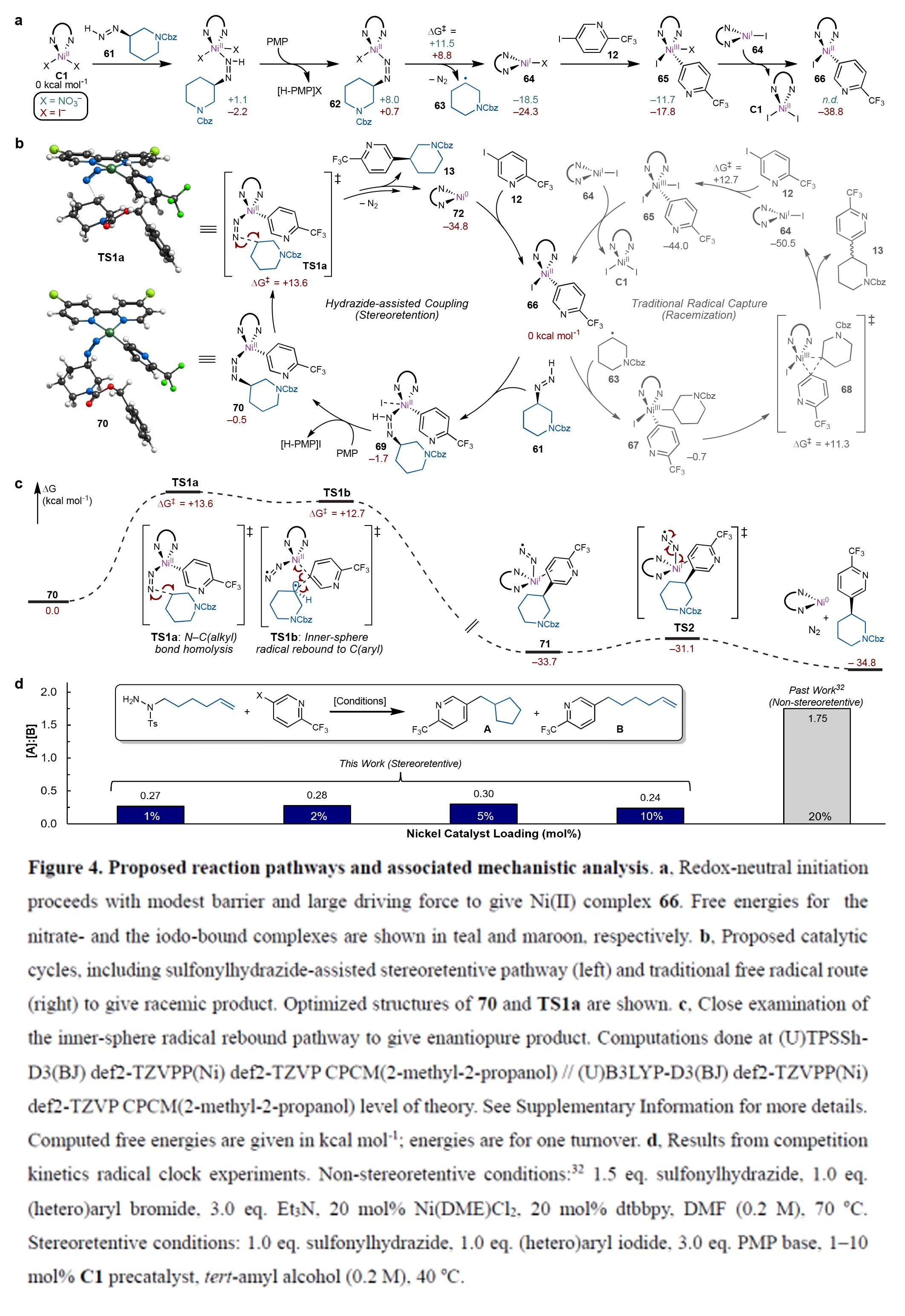
(圖片來源:Nature)
總結
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn