

研究背景
活性中間體的生成和調控對有機化學發展至關重要。通過光化學或電化學的外部調控,可以從已知催化循環中發現新的反應活性。作為經典的親核性共價催化中間體,烯胺在氧化條件下易于發生單電子氧化,產生極性反轉,與親核試劑偶聯。在過去的幾十年中,化學氧化以及光氧化已被廣泛應用于單占據分子軌道(SOMO)型氨基催化。然而,令人驚訝的是,陽極氧化在這類催化中的應用進展甚少。
陽極氧化烯胺主要有兩方面的挑戰。其一,陽極氧化烯胺的效率低下,在以往工作中更常見到的是將親核試劑氧化。其二,由于電場和離子介質的存在,電化學條件下的手性控制存在挑戰。為了解決上述問題,基于長期手性伯胺催化劑的研究基礎(Acc. Chem. Res. 2024 , 57, 10, 1523–1537.),作者提出,依據前期建立的烯胺氧化電位標度(J. Org. Chem. 2019, 84, 12071–12090),應用烯胺氧化還原介體定位(enamine redox mediator mapping (e-RM2))策略,幫助尋找合適的氧還介體來提升反應效率,目標分子和烯胺之間的氧化電勢匹配是重要的遴選標準;結合課題組獨特的離子型的伯叔二胺催化劑,有望實現不對稱的氧化偶聯反應。
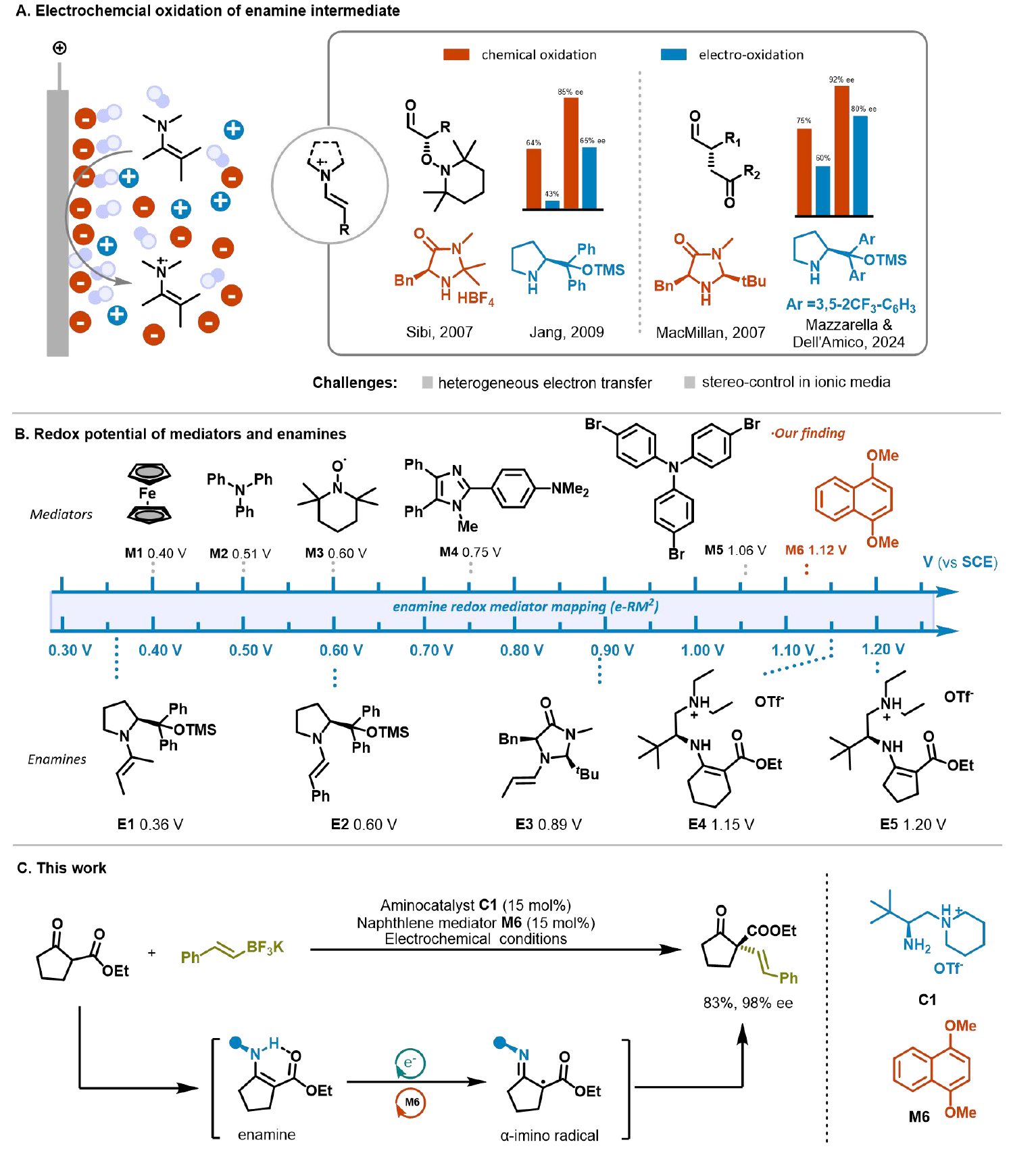
條件探索與底物拓展
作者以2-氧代環戊基羧酸酯和苯乙烯基三氟硼酸酯的氧化偶聯作為模板,經過電壓、溶劑、催化劑等條件的優化后獲得最佳條件。在催化劑篩選方面,pKa更大的哌啶側鏈對于立體控制有顯著優勢,而大位阻催化劑并沒有很好的手性控制結果。需要引起關注的是,作者強調了氧化還原介體(redox mediator)與目標烯胺的氧還電位匹配的重要性。通過下圖的氧還電勢比較可以看出,當mediator的電勢非常接近且略小于目標烯胺的電勢時,電化學反應性可以獲得最大的提升。最終,在Pt作為陰極和陽極,C1·HOTf作為氨基催化劑,1,4-二甲氧基萘作為mediator,3 mL DCM(0.1 M TBABF4)為電解質溶液,外加5當量HFIP作為質子源,經過12 h的2.20 V恒壓電解,可以獲得83%分離產率和98% ee.
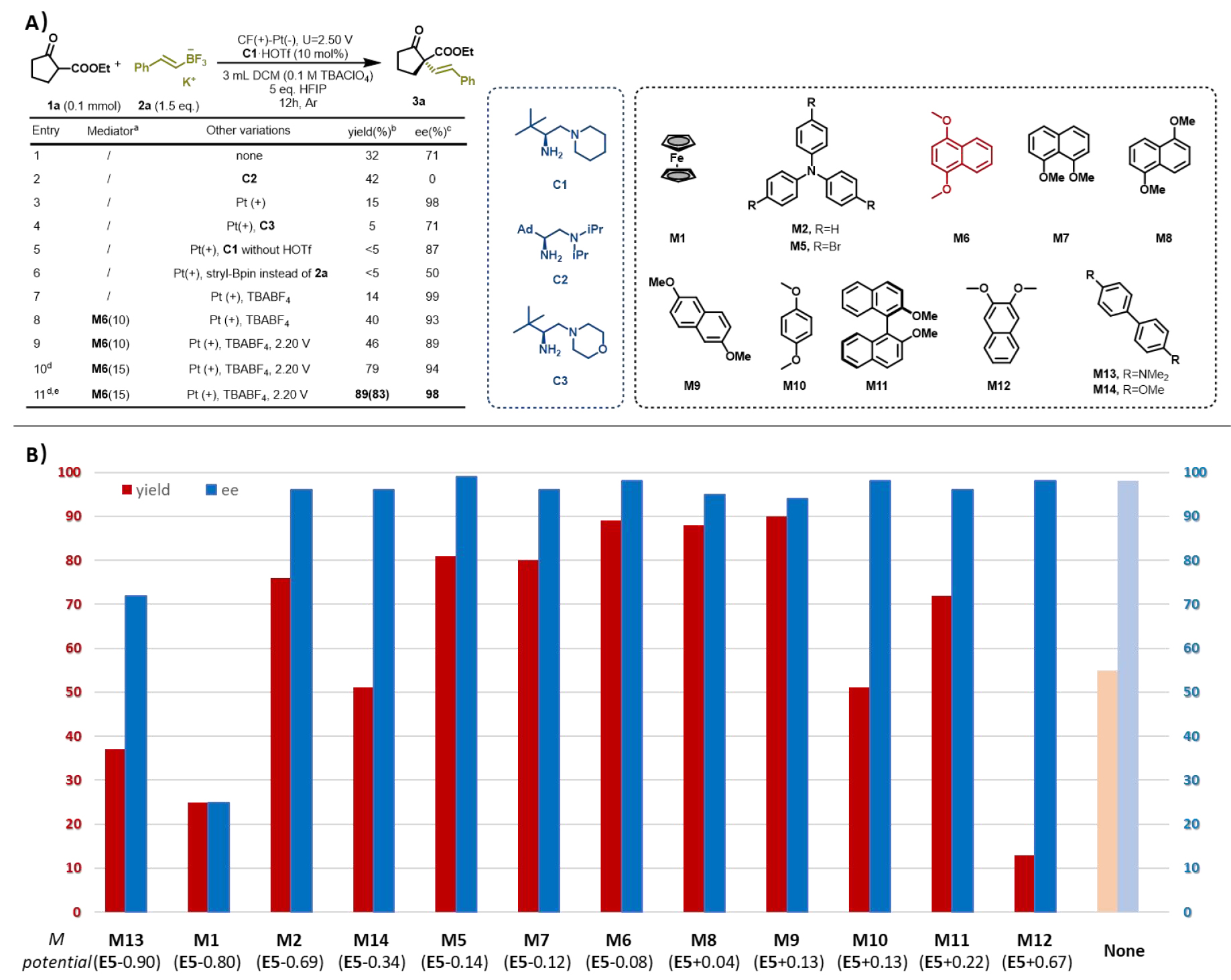
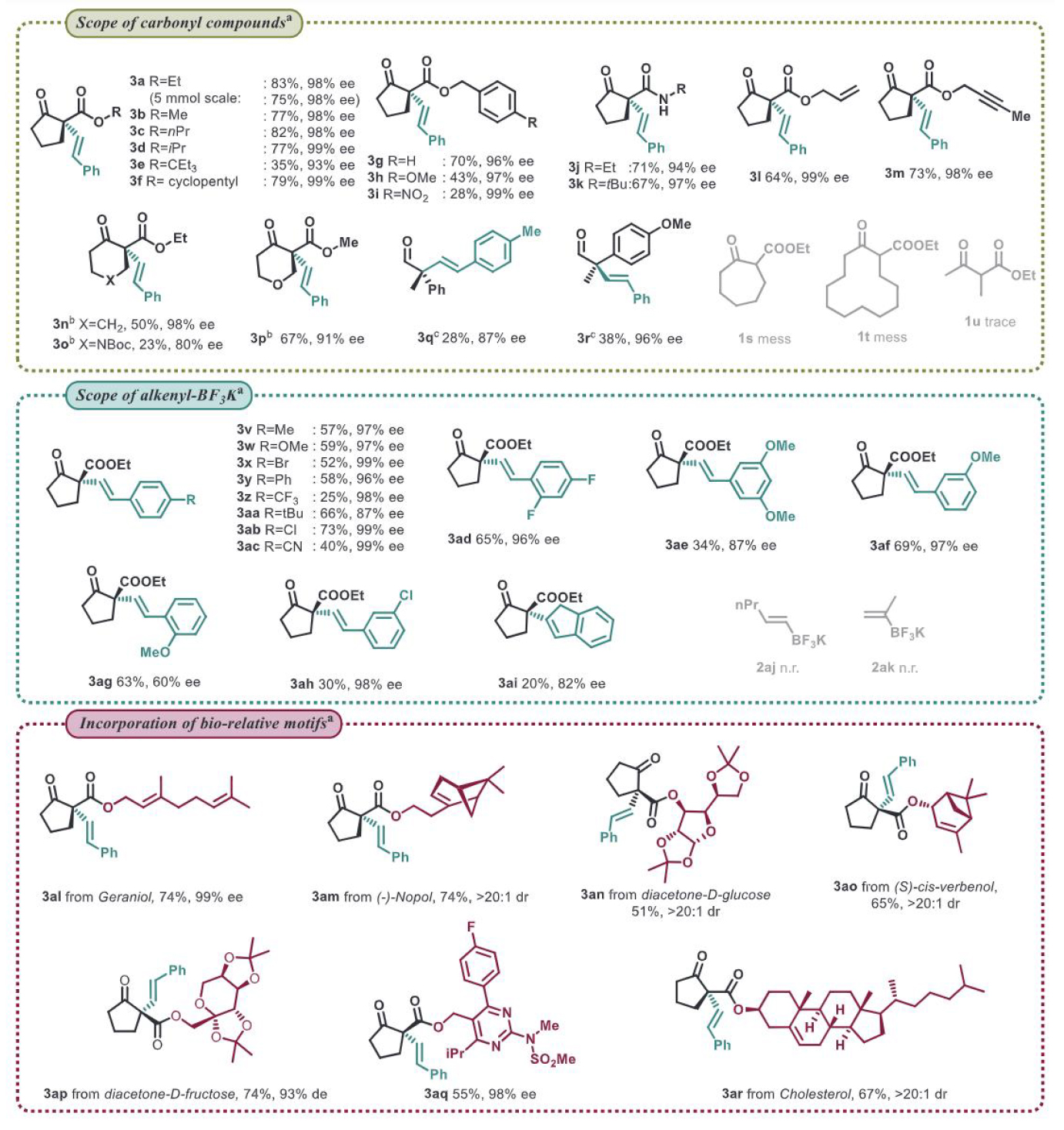
在底物方面,這種電化學偶聯方法對不同類型的酮酯、支鏈醛、不同取代基的苯乙烯均具有非常高的對映選擇性。雖然該過程涉及自由基中間體,簡單的不飽和碳碳鍵也可以兼容于該反應體系中。該方法還可兼容不同種類天然產物官能團,這展示了反應體系極強的兼容性和控制能力。這樣高水平的手性控制也是目前亞胺基自由基不對稱轉化的最好結果。
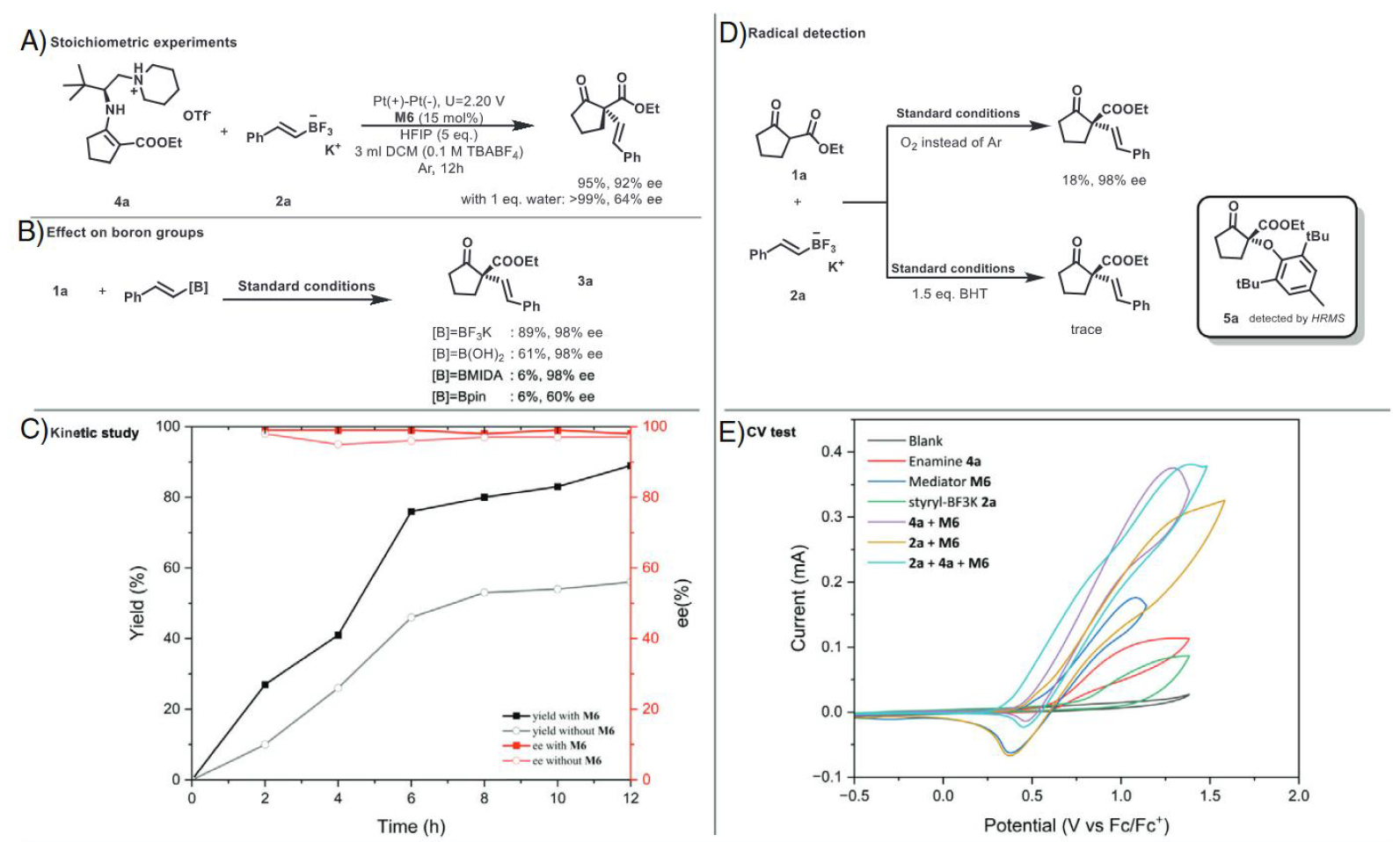
機理研究中,烯胺的當量轉化實驗證明了催化過程涉及烯胺中間體,而非烯醇反應。改變硼官能團的種類證實了陰離子形式的BF3K對產率和手性控制的重要性。通過監測反應歷程,證實了1,4-二甲氧基萘作為Mediator對反應效率提升的關鍵作用。自由基捕獲和抑制實驗證明了反應經歷自由基中間體。CV測試表明,烯胺應是電化學中被氧化的活性中間體,而且在1,4-二甲氧基萘的存在下可以觀察到顯著的催化電流。
進一步的自由能分析為反應的手性控制提供了線索。降低催化劑叔胺側鏈的pKa會顯著降低反應的立體選擇性,而增強催化劑中共軛酸的酸性會顯著增強立體選擇性。這都說明了高度質子化的叔胺側鏈的重要性。溶劑線性自由能分析(https://luoszgroup.com/index.php/deep-synthesis/)可以獲得對映選擇性和溶劑酸度尺度(Catalán’s SA)之間的良好相關性,這強調了過渡態中離子相互作用的重要性。
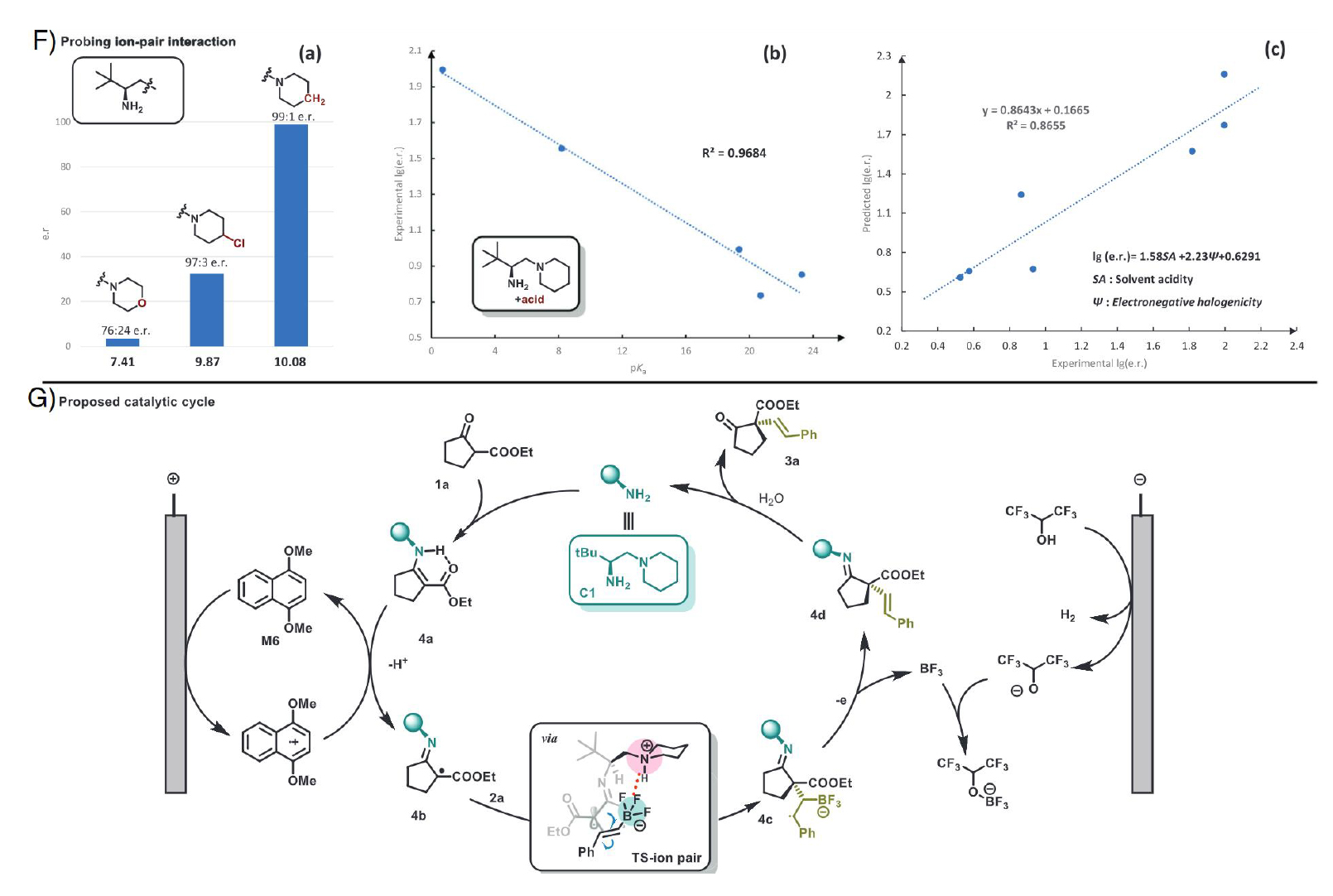
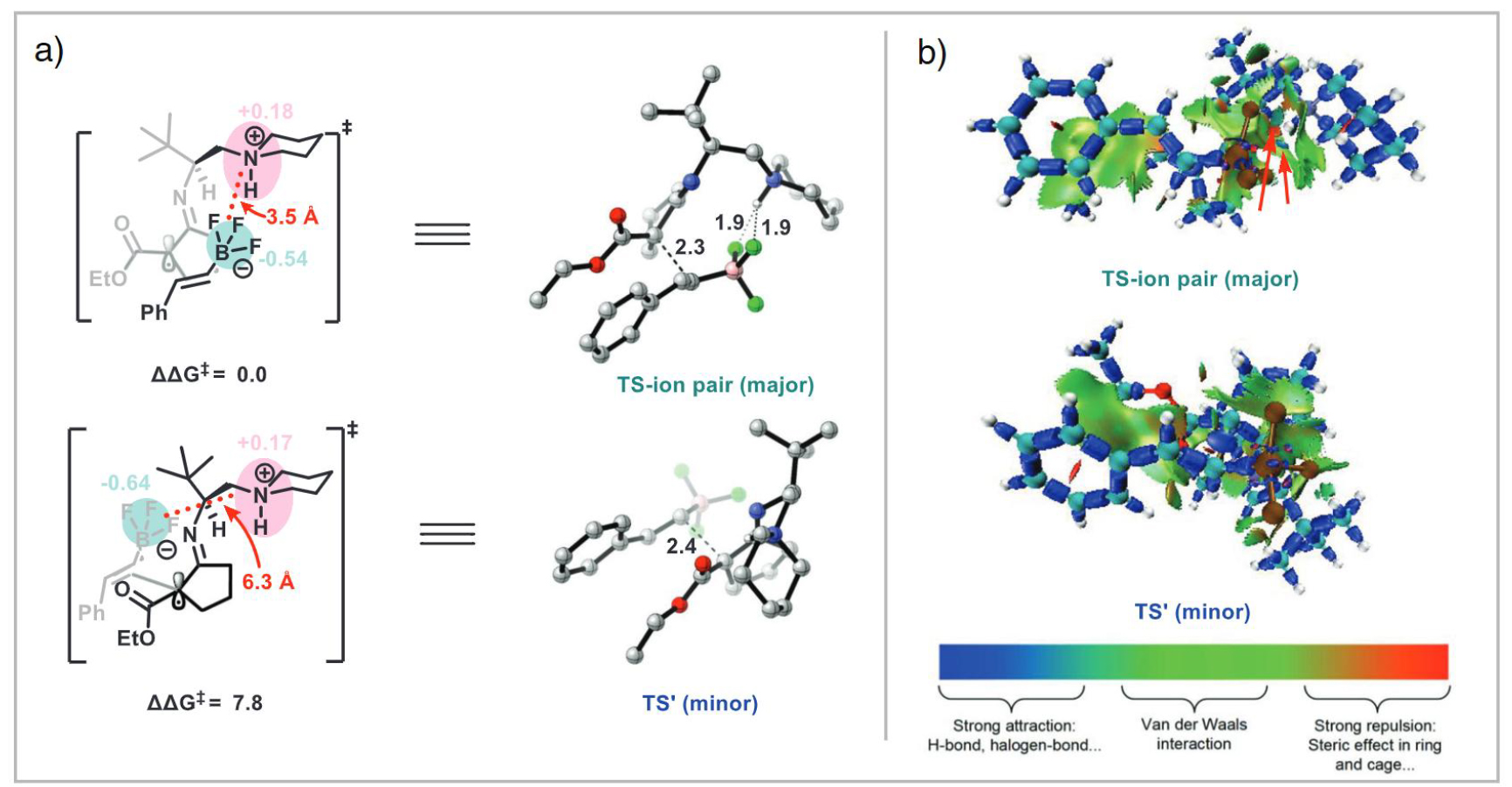
綜合以上分析,提出了如上圖所示的催化循環:原位生成的烯胺中間體4a經電化學氧化生成α-亞氨基自由基4b。隨后,在質子化的哌啶陽離子和三氟硼酸陰離子之間的離子對相互作用的輔助下進行自由基加成,隨后經氧化脫硼得到目標產物。富電子萘的存在可以有效地介導氨基催化中間體之間的相間電子轉移,從而提高整體反應效率。離子相互作用的過渡態被DFT計算進一步支持。在過渡態中,由于靜電吸引,質子化哌啶上的H原子與F原子之間的距離顯著縮短,使得優勢過渡態比另一種過渡態低7.8 kcal/mol。為了進一步探索過渡態結構中的弱相互作用,IRI分析揭示了離子對之間微妙的靜電相互作用。
總結
作者通過烯胺氧化還原介體定位策略發現1,4-二甲氧基萘作為新型redox mediator能夠有效促進烯胺中間體的陽極氧化。手性伯胺和萘的協同催化作用對多種羰基化合物具有高水平對映選擇性。機理研究揭示了質子化催化劑與陰離子底物之間獨特的離子對相互作用。這一發現有望推動氨基催化電化學轉化領域的進一步發展。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn