

正文
手性1,2-二醇是藥物、農用化學品和精細化學品領域中合成多種功能化合物的重要中間體。為此,人們開發了多種合成手性1,2-二醇的方法,包括生物催化和化學催化。化學催化方法包括烯烴的Sharpless雙羥基化反應、環氧化合物的水解動力學拆分、1,2-二醇的酰化/烷基化動力學拆分,以及α-羥基酮的不對稱硼氫化、硅氫化、轉移氫化和氫化反應。其中,不對稱氫化因其原子經濟性和操作簡便性成為最具吸引力的方法(圖1a)。
長期以來,不對稱氫化領域由釕、銠、鈀和銥等貴金屬催化劑主導。盡管近年來釕和銥催化劑在合成手性1,2-二醇中取得進展(圖1b),但貴金屬的不可持續性、高昂成本和潛在環境毒性促使研究者轉向錳、鐵、鈷、鎳和銅等豐產金屬。然而,豐產金屬催化的α-羥基酮不對稱氫化合成手性1,2-二醇的研究尚未見報道。
作者所在團隊長期致力于豐產金屬催化的不對稱氫化反應(最新文獻:Ni:J. Am. Chem. Soc.2025,147, 342-352;Nat. Commun.2024,15, 5482;Angew. Chem. Int. Ed.2023,62, e202214990;Cu:Angew. Chem. Int. Ed.2025,64, e202416313;Angew. Chem. Int. Ed.2023,62, e202306380;Co:JACS Au.2023,3, 2981;Angew. Chem. Int. Ed.2023,62, e202217871)。此前,作者所在團隊已利用手性鈷催化劑實現了C=C和C=N鍵的高效不對稱氫化(Org. Lett.2024, 26, 769;Angew. Chem. Int. Ed.2023, 62, e202303488;Angew. Chem. Int. Ed.2023, 62, e202217871;Chem. Eur. J.2022, 28, e202201517)。基于此,團隊嘗試挑戰鈷催化C=O鍵的不對稱氫化這一難題(JACS Au.2023,3, 2981)。文獻調研表明,鈷催化酮的不對稱氫化仍處于早期階段:現有催化體系在同時實現高催化活性和強立體控制上存在不足,反應普適性和催化效率也有限。多齒配體鈷催化體系通過“配體促進策略”(如NH效應)可高效氫化簡單酮類(圖1c左),而雙齒配體催化劑則通過“底物促進策略”(如導向基效應),在官能化酮類化合物的氫化中表現更優(圖1c中)。例如,雙膦配體和氨基導向基的協同作用實現了α-氨基酮的高效氫化。然而,將導向基由氨基替換為羥基時,反應的催化活性和對映選擇性都顯著下降,這可能是羥基的弱配位能力和較小位阻所致。為此,亟需開發新型促進策略以突破這一局限。
在鈷/雙膦配合物催化官能化酮的氫化反應的成功案例中,羧酸鈷(如乙酸鈷和硬脂酸鈷)表現出優于其他鈷鹽的活性和對映選擇性(JACS Au.2023,3, 2981;Chem Catal.2024, 4, 100999)。作者推測,羧酸根水解生成的羧酸可能在催化循環的關鍵過渡態中發揮雙重作用:其羰基與底物羥基形成氫鍵以增強配位,羥基與底物羰基形成氫鍵以提高還原活性,同時羧酸的引入優化了立體控制環境。基于此,作者提出“添加劑促進策略”(羧酸效應,圖1c右),開發了鈷/雙膦配合物與羧酸添加劑協同的高效催化體系,實現了α-羥基酮的高產率和高對映選擇性氫化。
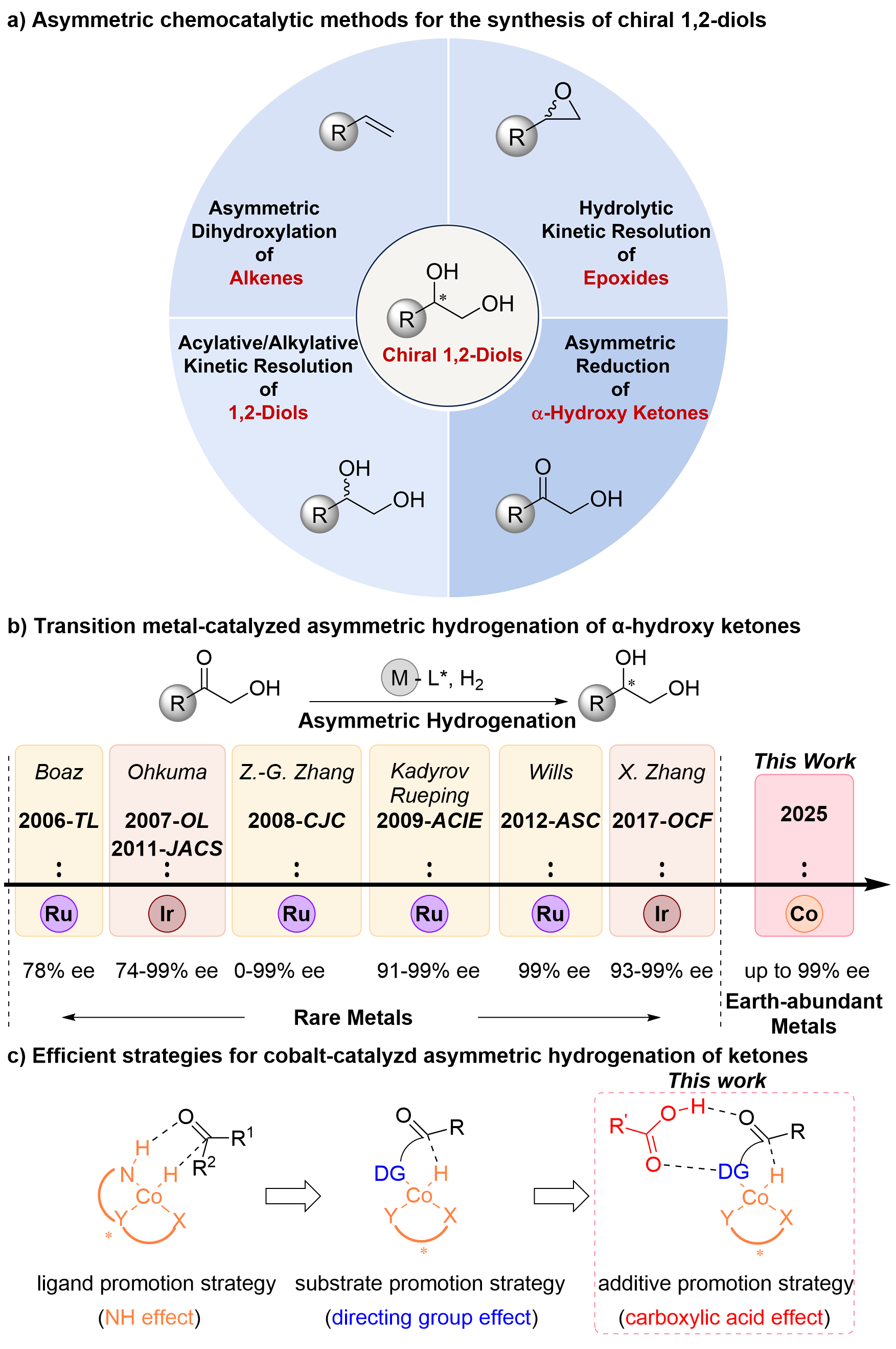
圖1. 手性1,2-二醇的化學催化合成
作者研究以α-羥基苯乙酮(1a)為模板底物,篩選了多種鈷鹽和手性雙膦配體。和預期結果相同,醋酸鈷為最優鈷鹽。配體中,(S,S)-Ph-BPE(L2)可提供最高對映選擇性(88% ee,圖2a)。進一步考察添加劑時發現,羧酸(尤其是苯甲酸衍生物)顯著提升了反應效率(圖2b)。水楊酸使產物2a的ee值達到98%,略優于苯甲酸(97% ee)。再對其他反應參數如反應溶劑、氫氣壓力和溫度進行了優化,優化后的條件為:乙酸鈷(6 mol%)、(S,S)-Ph-BPE(5 mol%)、水楊酸(10 mol%)、氫氣(50 bar)、甲苯溶劑、70°C反應。將反應時間延長到48小時,產物2a的轉化率>99%,ee值達到98%。
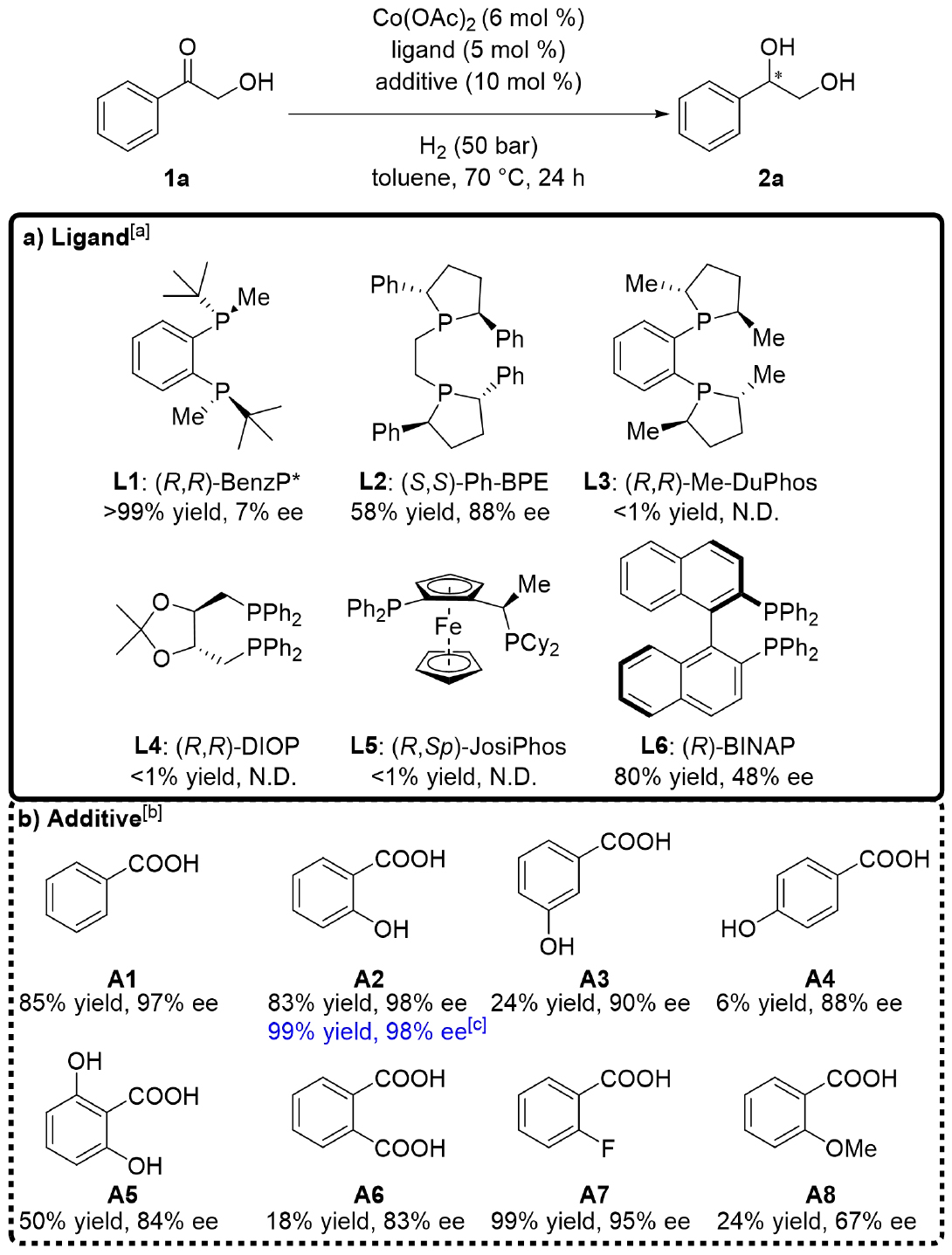
圖2. 條件篩選
隨后作者考察了α-羥基酮的底物范圍(圖3)。對位由供電子或吸電子基團取代的底物均能以高收率和高ee值(85–99%)生成產物(2b–2j)。鄰位取代芳基底物的對映選擇性較低(2k,87% ee),間位取代底物(2l–2o)與對位取代結果類似。雙取代底物(2p–2s)則表現良好(收率92–98%,ee值92–99%)。萘環和雜環底物(2t–2w)的氫化同樣高效,產物2u的絕對構型經單晶X射線衍射確認為R型。
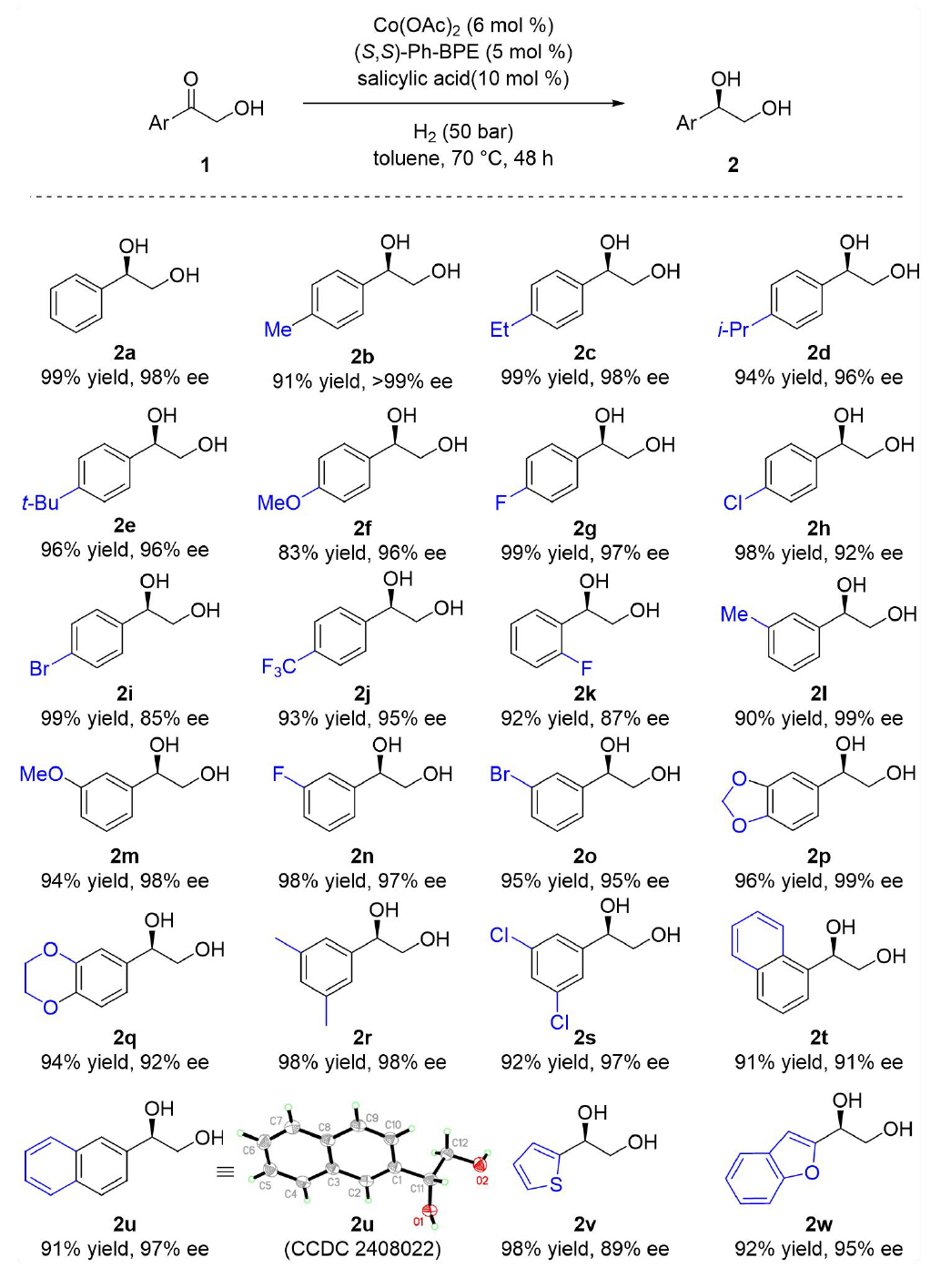
圖3. 底物拓展
為證實反應合成應用價值,作者進行了克級規模反應(圖4a)和產物衍生化(圖4b)。1,2-二醇2a與碳酸二甲酯反應生成3(64%收率,99% ee),與對甲苯磺酰氯保護后得到4(85%收率,98% ee)。4可一步轉化為環氧化物5(92%收率,99% ee)和硫醚6(47%收率,98% ee),其中5是治療膀胱過度活動癥藥物米拉貝隆的關鍵中間體。硫醚6可被乙酸酐酯化生成7(89%收率,97% ee),7可作為手性硫醚助劑,在具有潛在治療效果的1,2-順式甘露糖的合成中發揮作用。此外,通過磺化、分子內威廉姆森醚化及環氧化物開環胺解等步驟,完成了NMDA受體拮抗劑(R)-(-)-Eliprodil的全合成(產物10,97% ee)。
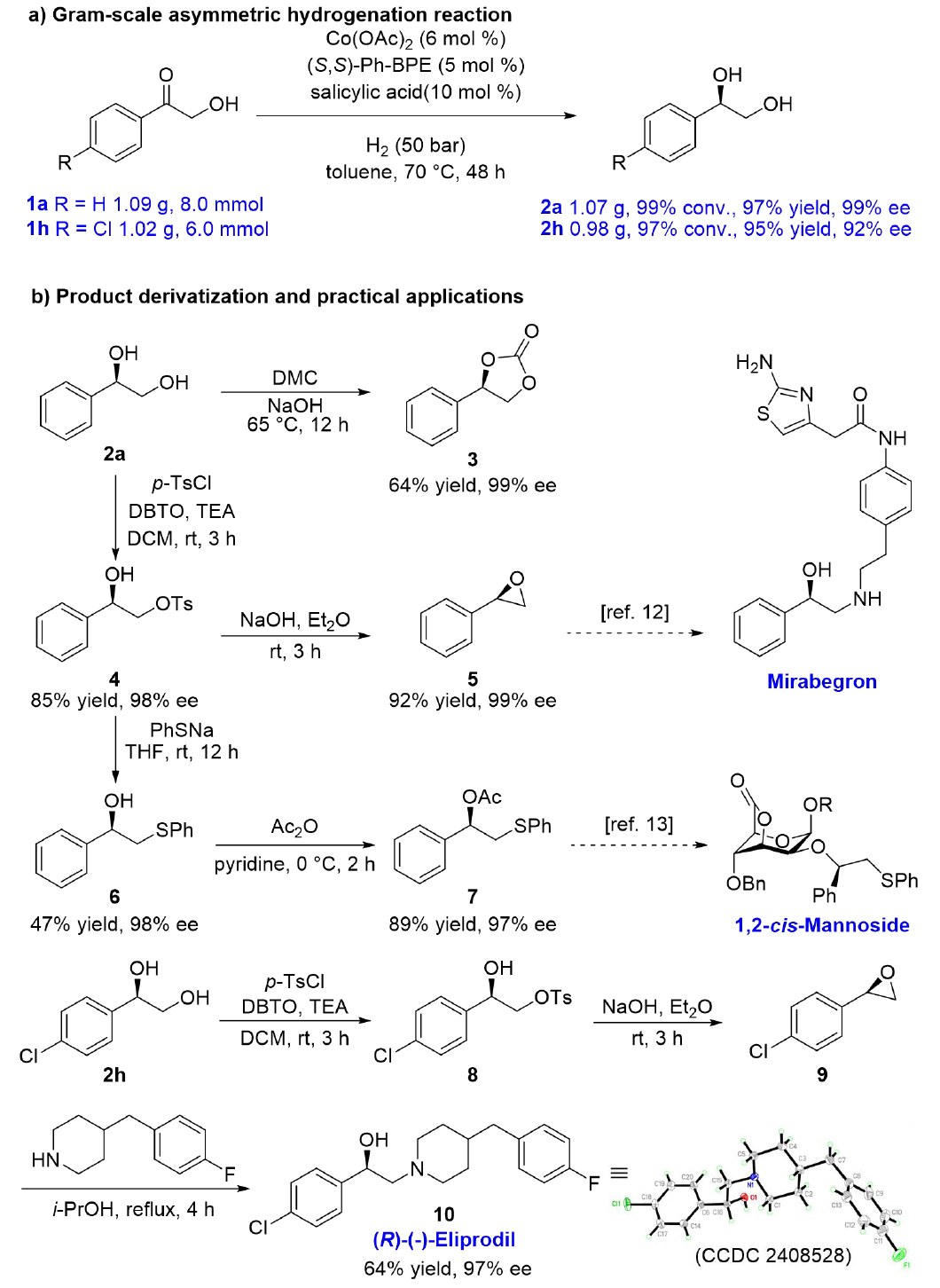
圖4. 克級反應、產物衍生化和應用
機理研究表明,底物α-羥基對活性和對映選擇性至關重要:酯化或甲基化底物的反應效率顯著下降。苯甲酸替換為苯甲酸甲酯時,ee值降至89%,與無添加劑條件(88% ee)接近,表明羧酸的質子對羰基活化和立體控制起關鍵作用(圖5a)。DFT計算支持非氧化還原鈷(II)催化循環和羧酸/羥基協同促進的氫化模型(圖5b),這與此前作者在α-氨基酮底物的催化機理的發現一致。鈷配合物A經歷氫解,原位生成活性鈷氫物種C。隨后負氫轉移到1a的羰基碳上,由D經由過渡態TS生成E。E釋放優勢構型為R的產物2a,并重新生成A。圖5c表明在關鍵過渡態中,水楊酸通過多重氫鍵與底物和鈷氫物種相互作用。兩個過渡態的ΔΔG?為2.0 kcal/mol,R構型因多出一個氫鍵而具有更低的能壘(圖5c和5d)。
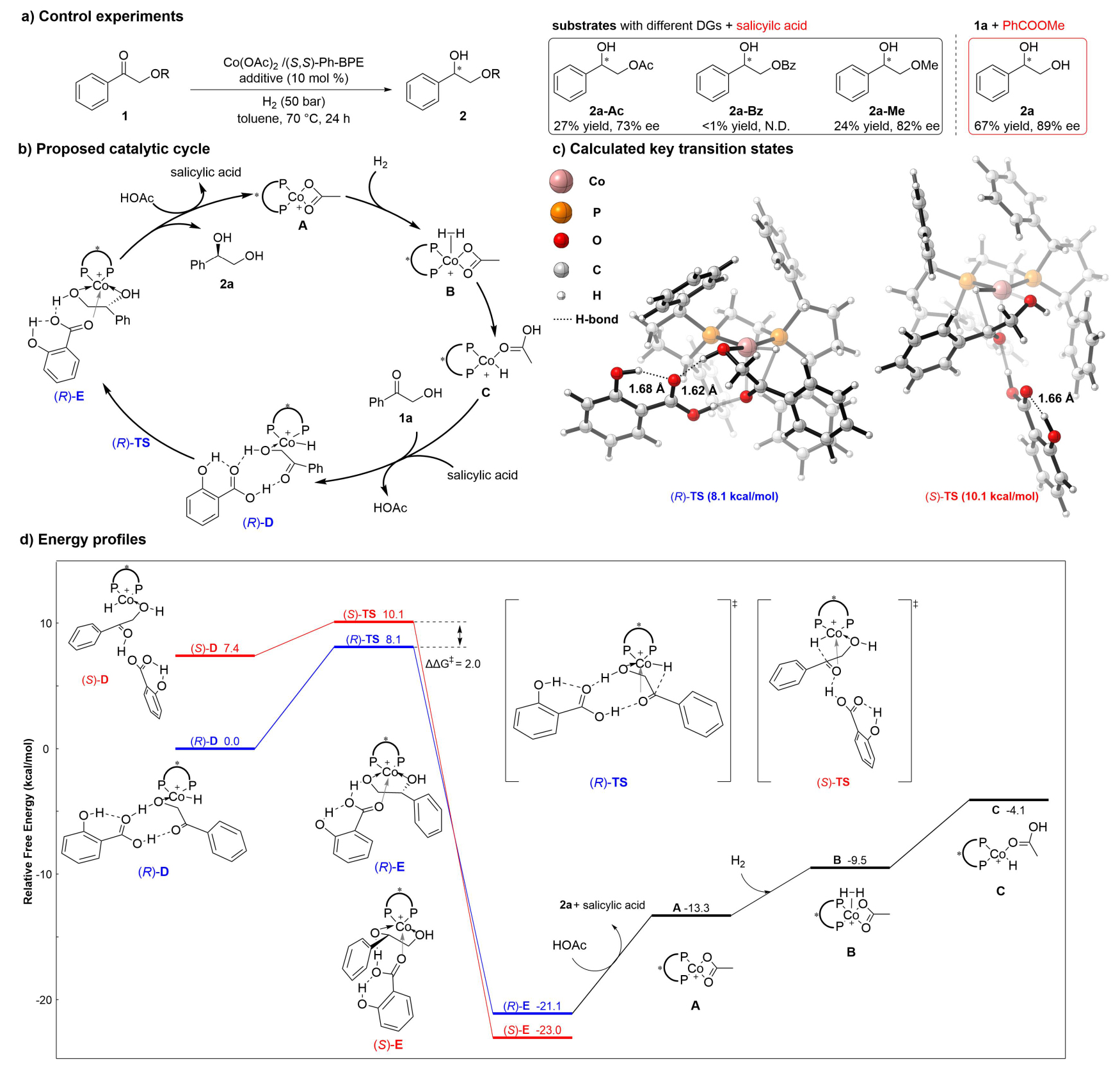
圖5. 催化機理
總結
綜上所述,張萬斌團隊開發了首例鈷催化α-羥基酮不對稱氫化反應,通過羧酸添加劑促進策略高效合成手性1,2-二醇。機理研究表明,羧酸通過雙重氫鍵增強底物配位與羰基活化,并優化立體控制環境。該策略為豐產金屬催化不對稱氫化提供了新思路。上述研究成果近期發表在Angew. Chem. Int. Ed.上,上海交通大學藥學院碩士生宋雨茜和博士生鄒雅詩為論文的第一作者,化學化工學院張萬斌教授和藥學院張振鋒研究員為論文的通訊作者。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn