

(圖片來源:J. Am. Chem. Soc.)
正文
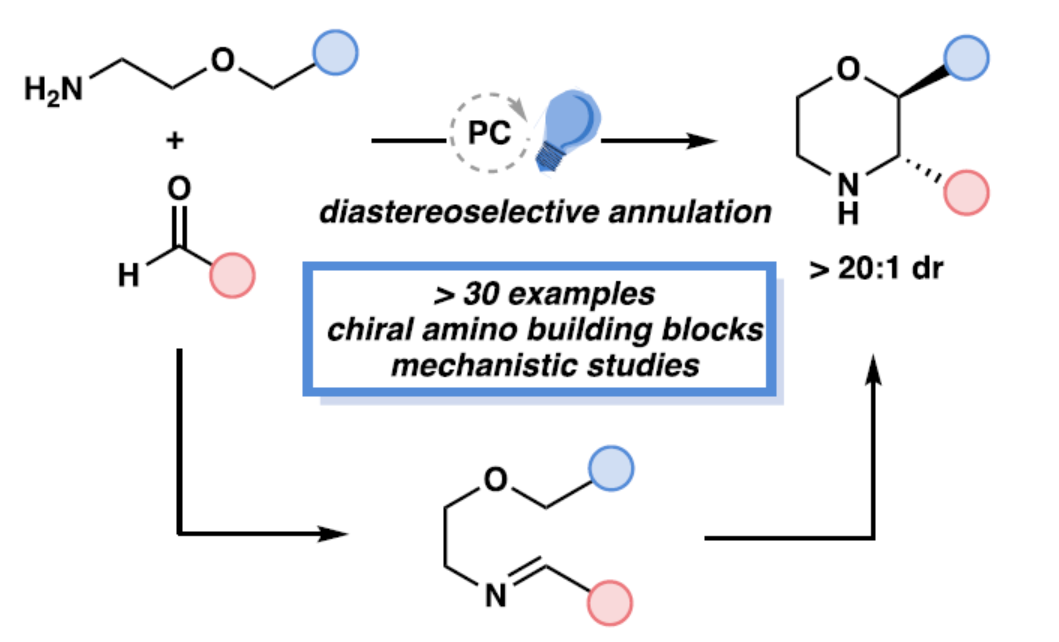
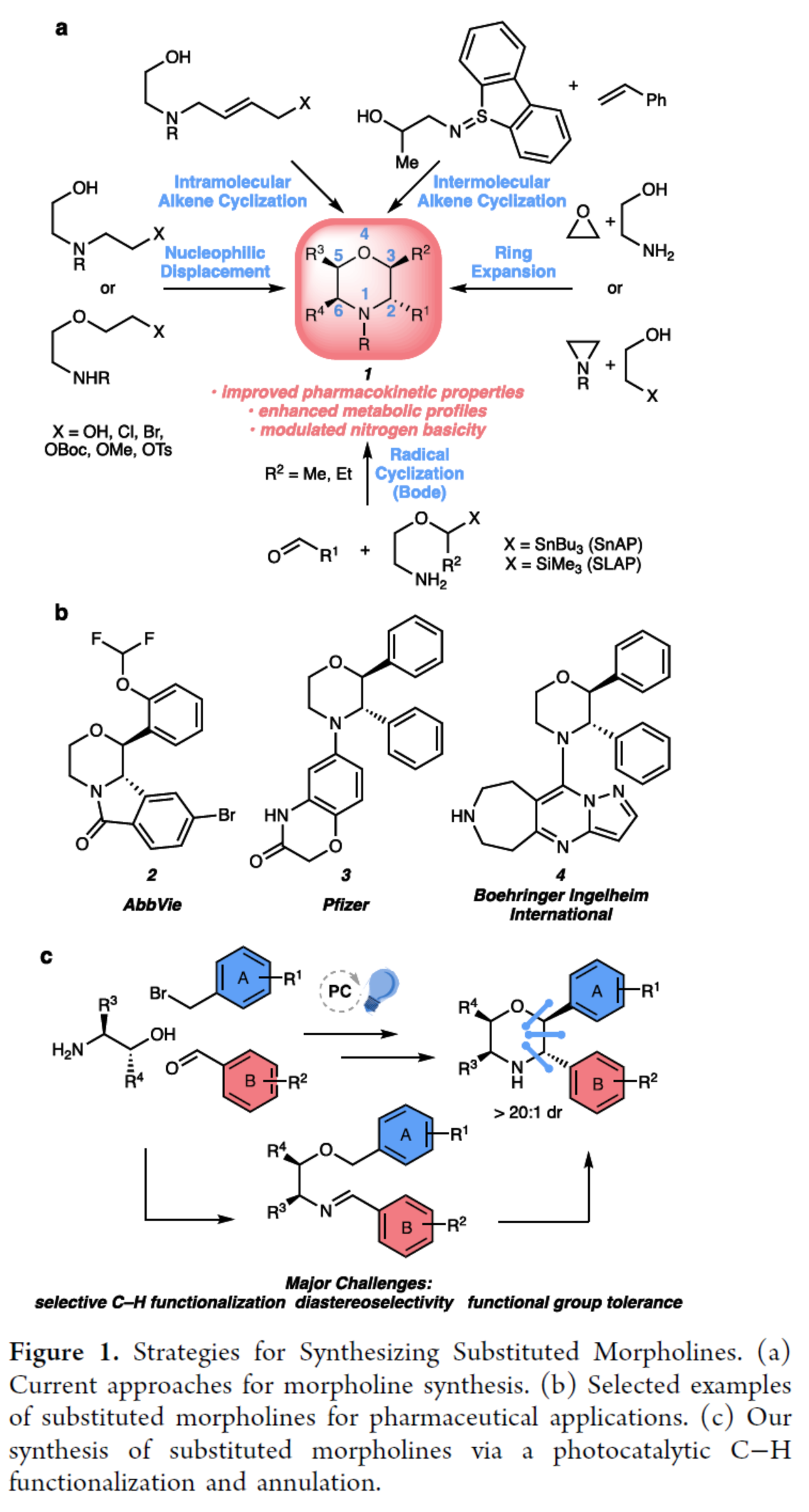
N-雜環骨架廣泛存在于各類已上市的藥物分子等中。其中,嗎啉(1)具有許多類似藥物的物理性質,如良好的溶解性、滲透性和穩定性,從而使其成為具有藥用價值的N-雜環化合物(Figure 1a)。前期,化學家們開發了多種合成取代嗎啉的方法,如親核置換、環擴張、分子內和分子間烯烴的環化以及自由基環化(Figure 1a)。然而,上述的反應常需在氮原子上引入保護基團,并且僅能形成一個手性中心。此外,2,3-trans-二取代嗎啉(2?4)在藥物發現中是一類先導化合物。目前,嗎啉的非對映選擇性合成領域最先進的方法是Bode團隊開發的SnAP(錫胺策略)和SLAP(硅胺策略)反應,這些方法避免了上述合成途徑的局限性(Figure 1a)。然而,該策略依賴經錫基和硅基基團預官能團化的試劑,且需經多步合成,從而限制了嗎啉產物中官能團的類型及取代模式。同時,Bode方法在底物范圍中存在一個顯著缺點,即無法以高度非對映選擇性的方式合成2,3-二取代嗎啉類化合物,而這類結構對于獲得二取代嗎啉分子(2?4)至關重要。近日,美國德克薩斯大學西南醫學中心Uttam K. Tambar與比利時魯汶大學Ludovic Troian-Gautier團隊開發了一種模塊化策略,利用易得起始原料可直接制備具有多樣化取代模式的官能團化嗎啉衍生物?(Figure 1c)。該策略通過非對映選擇性的光催化C–H鍵官能團化/成環反應?,實現了對多個未保護官能團化嗎啉的快速合成,并為復雜嗎啉骨架的構建提供了通用斷鍵策略?。此外,該策略還可實現其它N-雜環化合物的合成,如哌啶和吡咯烷衍生物。歡迎下載化學加APP到手機桌面,合成化學產業資源聚合服務平臺。
(圖片來源:J. Am. Chem. Soc.)
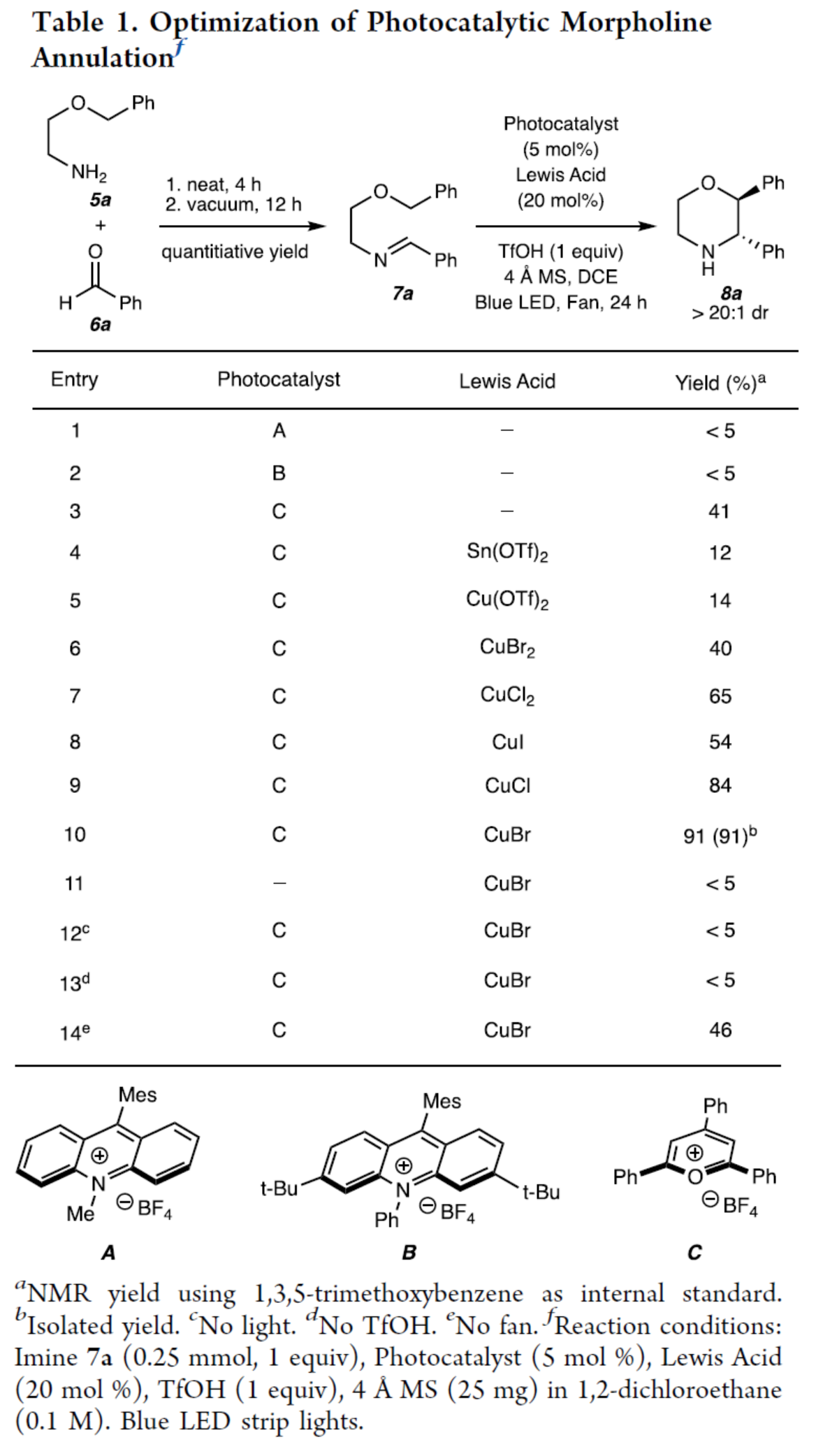
首先,作者以2-芐氧基-1-乙胺(5a)與苯甲醛(6a)經縮合反應生成的亞胺中間體(7a)作為模型底物,對反應條件進行了篩選(Table 1)。當以2,4,6-三苯基吡喃鎓四氟硼酸鹽(C,TPP·BF4)(5 mol %)作為光催化劑,CuBr(20 mol %)作為Lewis酸,TfOH(1.0 equiv)作為Br?nsted酸,4 A MS作為添加劑,藍色LED(467 nm)作為光源,在DCE溶劑中反應,可以91%的收率得到嗎啉產物8a,dr > 20:1。
(圖片來源:J. Am. Chem. Soc.)
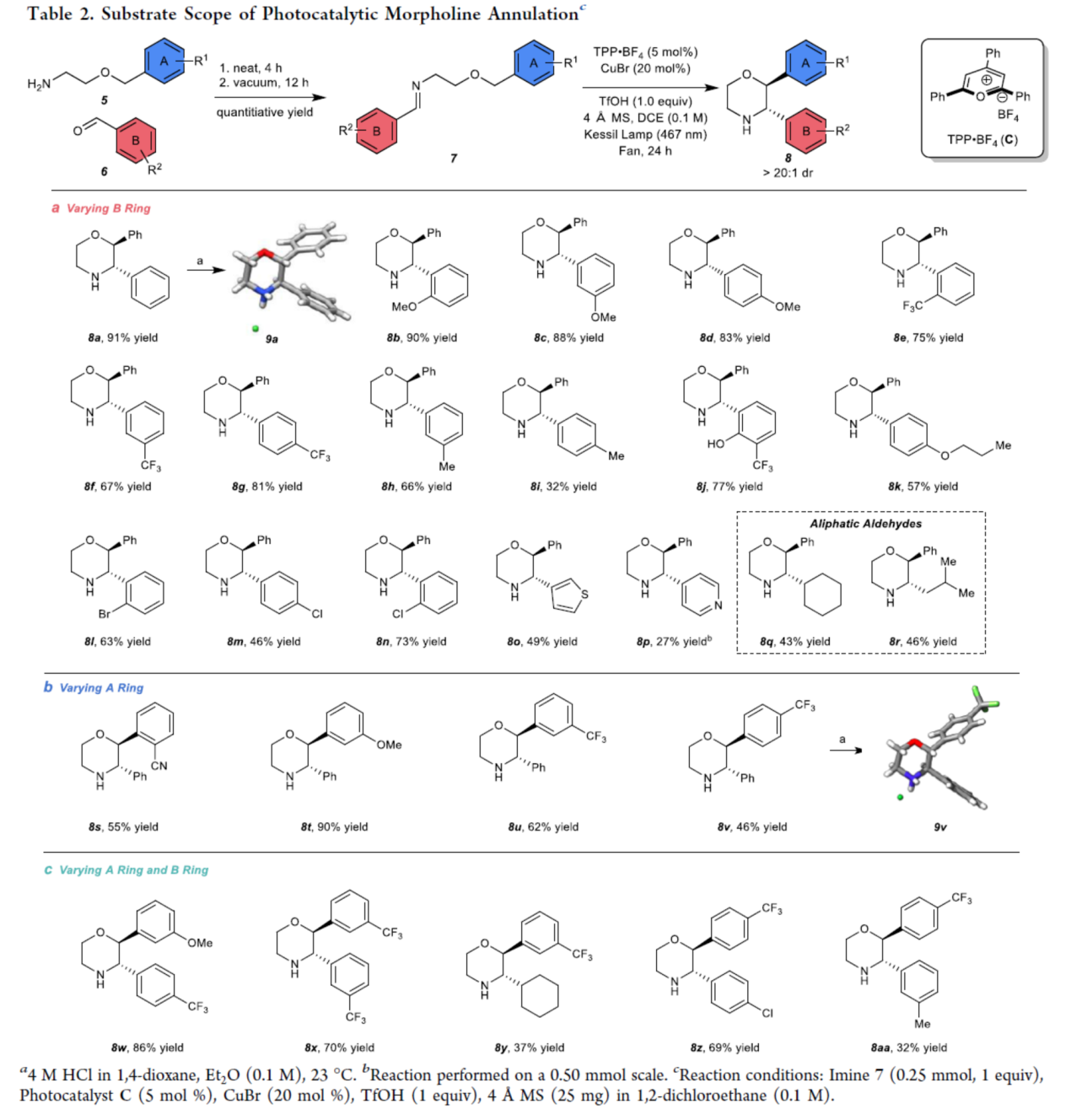
在獲得上述最佳反應條件后,作者對底物范圍進行了擴展(Table 2)。首先,一系列不同電性取代的苯甲醛與雜芳基醛,均可順利反應,獲得相應的產物8a-8p,收率為27-91%。同時,脂肪族醛,也是合適的底物,如8q(收率為43%)和8r(收率為46%)(Table 2a)。其次,當2-芐氧基-1-乙胺底物5中的芳基上含有-CN、-OMe與-CF3時,也能夠順利進行反應,獲得相應的產物8s-8v,收率為27-91%。其中,嗎啉產物8v主要非對映異構體的相對立體化學通過9vHCl鹽的X-射線晶體分析得到證實(Table 2b)。此外,作者還合成了其它幾種2,3-二取代嗎啉,其中A和B環都被取代,如8w-8z和8aa,收率為32-86%(Table 2c)。
(圖片來源:J. Am. Chem. Soc.)
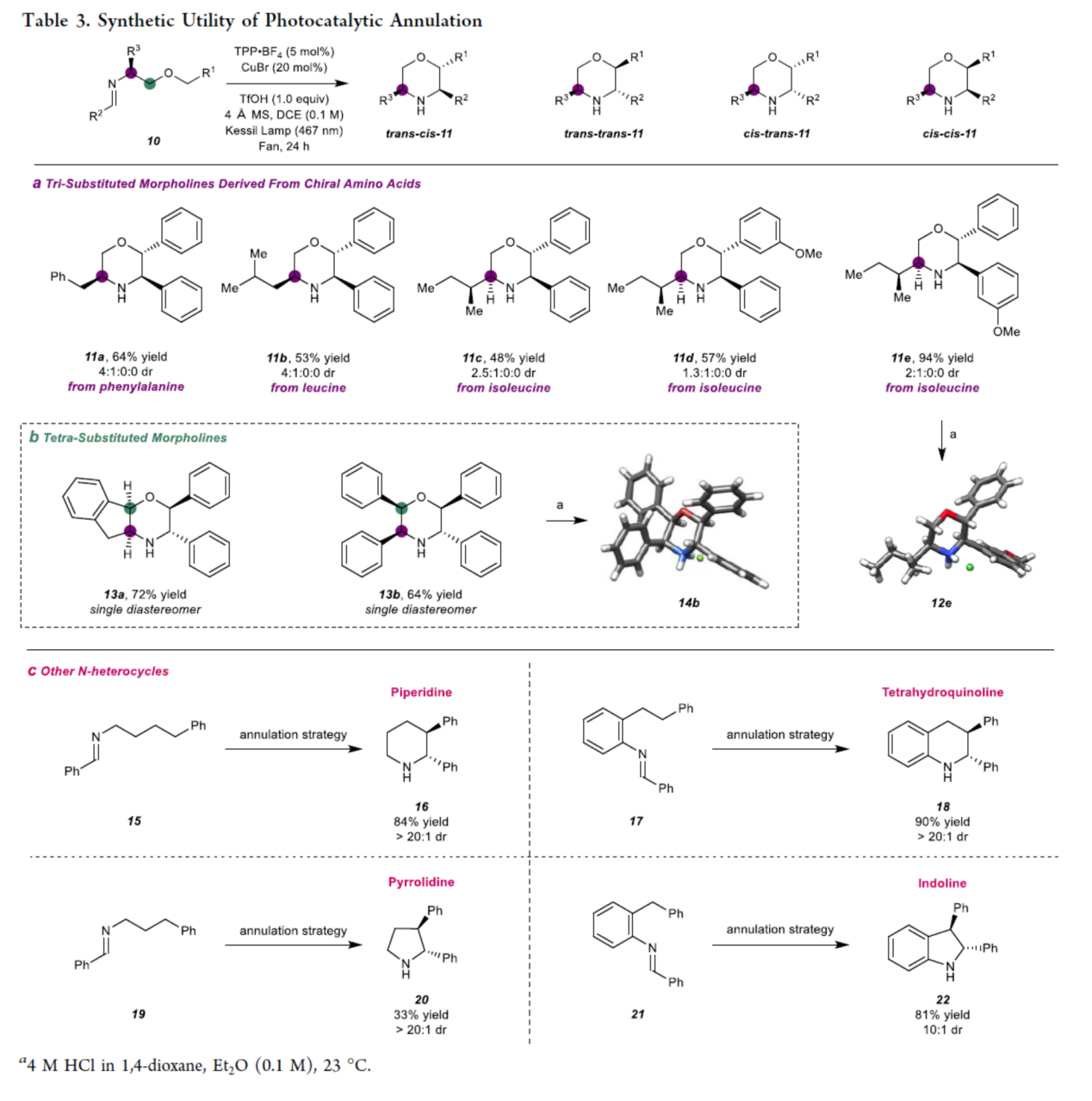
緊接著,作者對反應的實用性進行了研究(Table 3)。首先,采用手性氨基酸生成的亞胺中間體(10)為底物,可進一步合成三取代嗎啉(11)中4種潛在立體異構體,如trans?cis、trans?trans、cis? trans和cis?cis。例如,苯丙氨酸、亮氨酸、異亮氨酸衍生的亞胺中間體,均可順利進行反應,獲得相應的三取代嗎啉產物11a-11e,收率為48-94%,dr為1.3:1:0:0-4:1:0:0(Table 3a)。其次,采用(1R,2S)-(+)-cis-1-氨基-2-茚醇衍生的亞胺中間體為底物,還可以72%的收率得到單一非對映體的四取代嗎啉產物13a。類似的,采用(1R,2S)-(?)-2-氨基-1,2-二苯乙醇為底物,可以64%的收率得到單一非對映體的四苯基取代嗎啉產物13b(Table 3b)。此外,利用上述的環化策略,作者還合成了幾種N-雜環化合物,如無保護的哌啶(16)、四氫喹啉(18)、吡咯烷(20)和吲哚啉(22)(Table3c)。
(圖片來源:J. Am. Chem. Soc.)
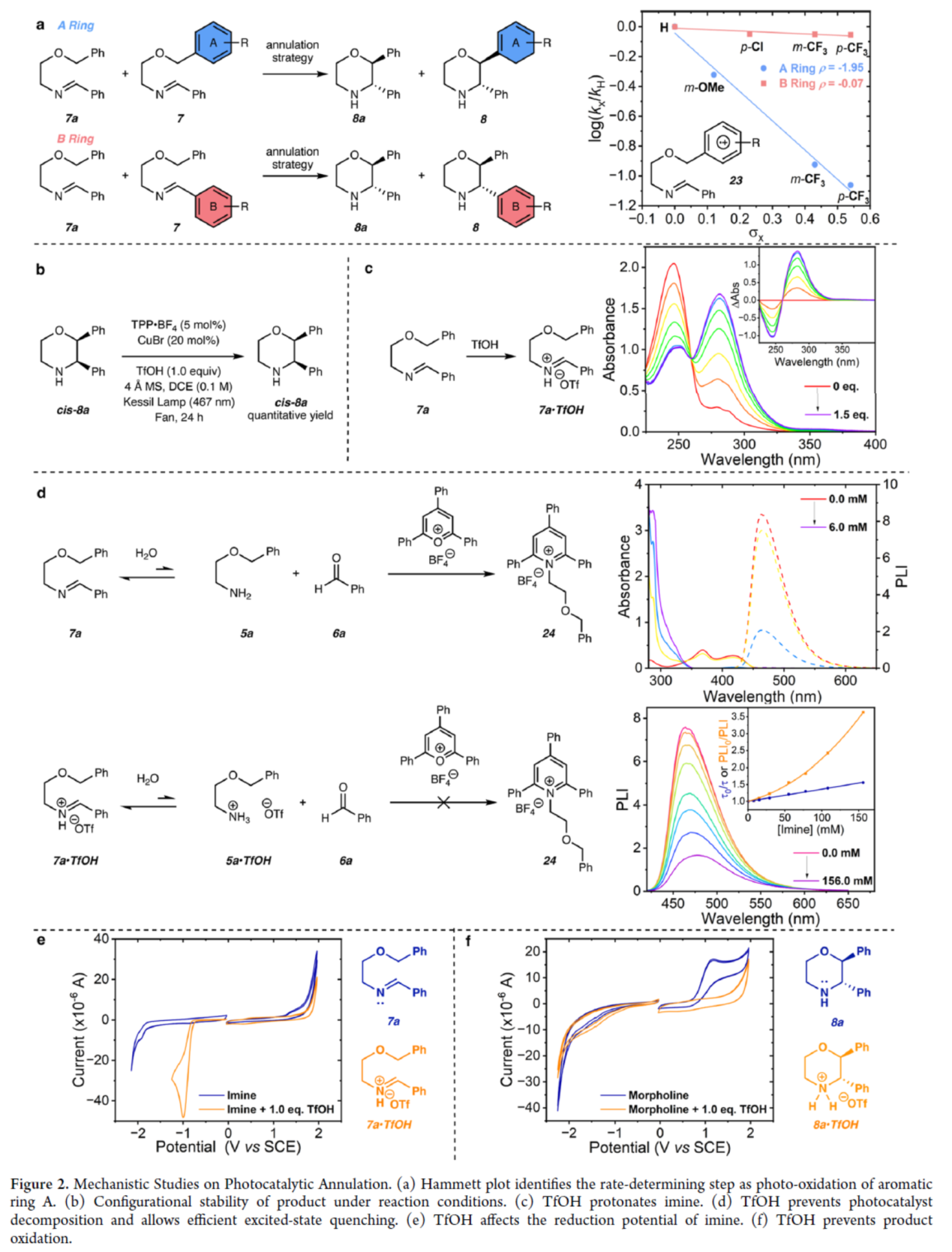
隨后,作者還對反應機理進行了進一步的研究(Figure 2)。首先,Hammett圖研究結果表明,反應的速率決定步驟是A環光化學氧化時形成自由基陽離子中間體(23)的過程(Figure 2a)。反應條件下產物的構型穩定性研究結果表明,trans-嗎啉類化合物的高非對映選擇性并非源自光催化的差向異構化(Figure 2b)。其次,UV?vis滴定實驗表明,TfOH可完全質子化亞胺(7a),形成亞胺離子(7a·TfOH)(Figure 2c)。同時,TfOH可以防止光催化劑分解,并允許有效的激發態淬滅(Figure 2d)。此外,CV實驗結果表明,TfOH可能會影響亞胺(7a)的還原電位(Figure 2e),并且TfOH可防止嗎啉產物的氧化(Figure 2f)。
(圖片來源:J. Am. Chem. Soc.)
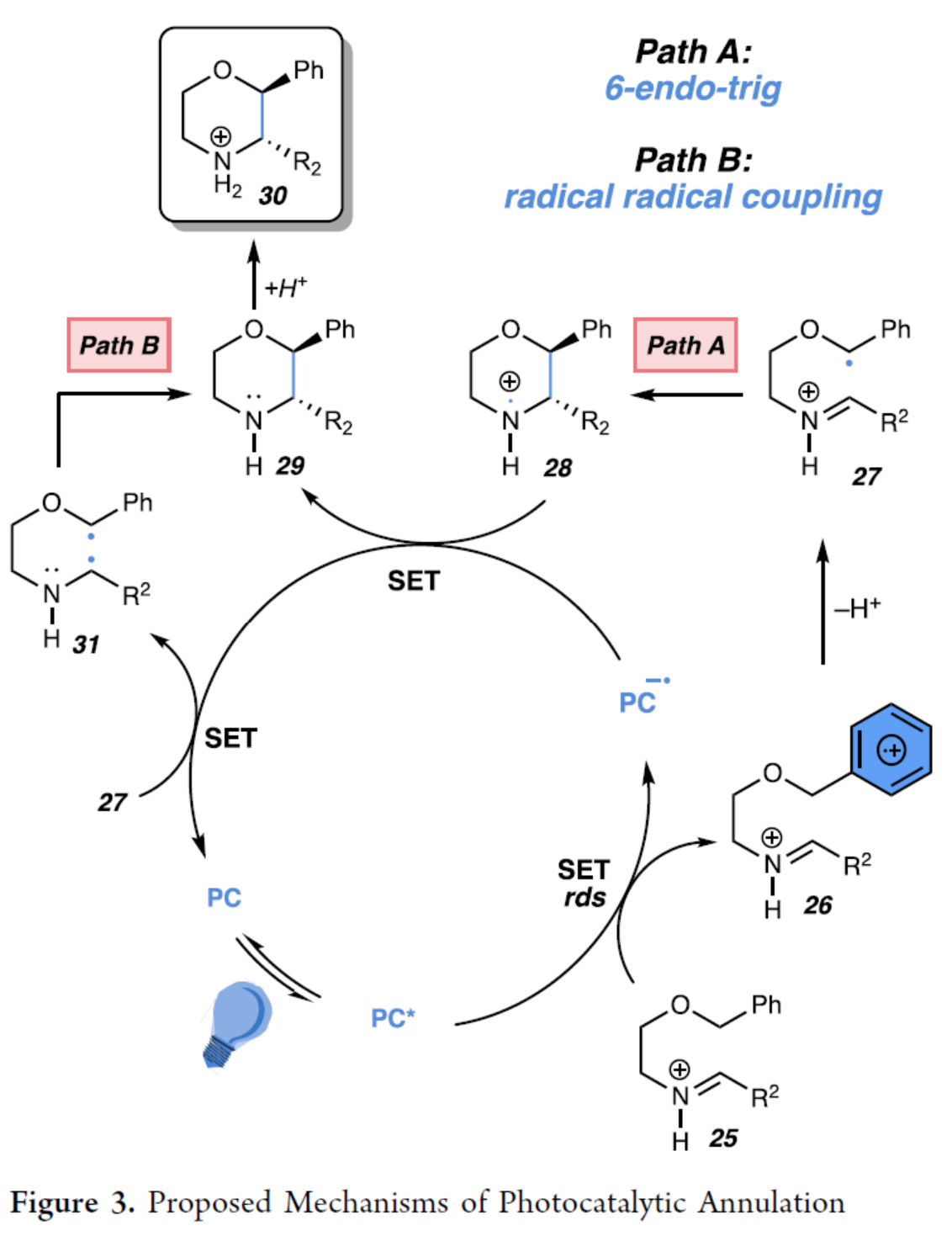
基于上述的研究以及相關文獻的查閱,作者提出了一種合理的催化循環過程(Figure3)。首先,在TfOH存在下,亞胺(7a)質子化后生成亞胺離子(25)。光催化劑C的激發態壽命足以與亞胺離子(25)進行雙分子電子轉移,生成單還原光催化劑和氧化自由基陽離子(26),其中自由基位于A環上。Hammett圖分析顯示,氧化自由基陽離子(26)的形成是速率決定步驟。其次,自由基陽離子(26)經去質子化,生成形成芐基自由基(27)。現階段,作者提出了兩種可能得途徑。在Path A中,芐基自由基(27)經6-endo-trig環化,生成氮基自由基陽離子(28)。隨后,通過單電子還原從而生成嗎啉產物(29),并再生光催化劑C,以完成催化循環。嗎啉與TfOH的質子化產生中間體(30),可防止產物發生不希望的氧化。在Path B中,芐基自由基(27)經單電子還原以,生成雙自由基中間體(31),并再生光催化劑C。隨后,雙自由基中間體(31)經自由基-自由基偶聯,從而獲得嗎啉產物(29)。此外,基于熱力學上有利氮基自由基陽離子的生成、光誘導電子轉移后生成低濃度的自由基將有利于分子內6-endo-trig環化以及亞胺離子在熱力學上不利于還原等因素,Path A更為合理。
(圖片來源:J. Am. Chem. Soc.)
總結
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn