



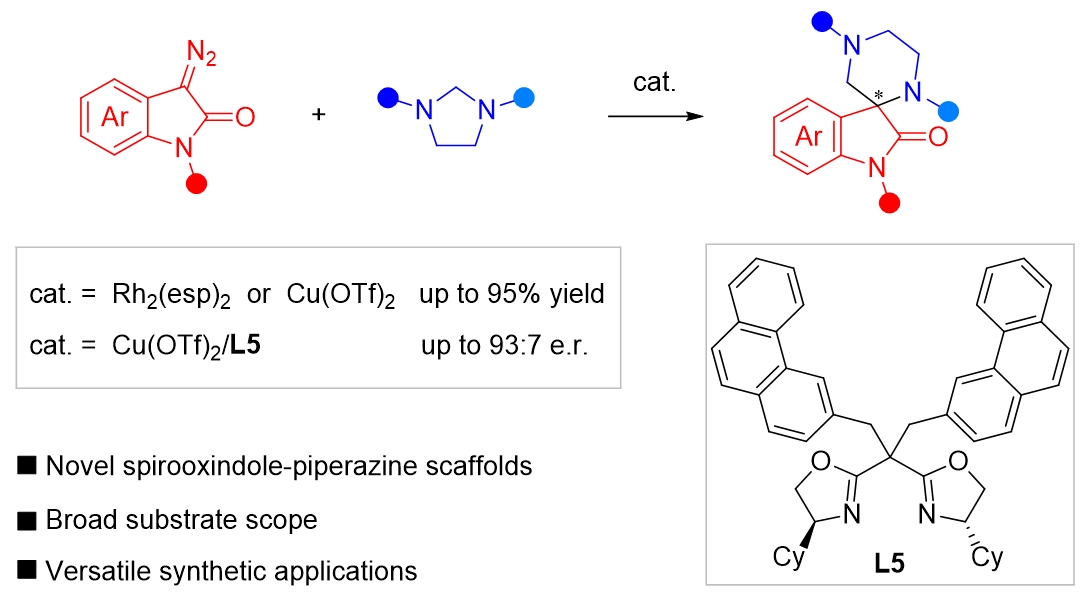
圖1 催化(5+1)環(huán)加成反應(yīng)構(gòu)建哌嗪-螺氧化吲哚骨架
正文
研究背景:螺環(huán)氧化吲哚骨架在天然產(chǎn)物和藥物分子中具有廣泛分布,其中六元氮雜環(huán)螺氧化吲哚因其顯著的生物活性而備受關(guān)注。哌嗪作為一種重要的氮雜環(huán)結(jié)構(gòu),在藥物化學(xué)領(lǐng)域具有廣泛應(yīng)用。然而,哌嗪-螺氧化吲哚結(jié)構(gòu)的合成具有較大難度,這在一定程度上限制了其在藥物研發(fā)中的應(yīng)用。重氮吲哚酮的(n+1)環(huán)加成反應(yīng)是構(gòu)建螺氧化吲哚骨架的一種直接方法,其中(2+1)和(4+1)環(huán)加成反應(yīng)已有較多研究,但關(guān)于高階(n>4)環(huán)加成的探索相對(duì)較少。基于此,作者設(shè)想通過(guò)重氮吲哚酮與咪唑烷之間的(5+1)環(huán)加成反應(yīng)來(lái)構(gòu)建目標(biāo)骨架,并致力于解決該反應(yīng)的不對(duì)稱(chēng)合成等問(wèn)題。
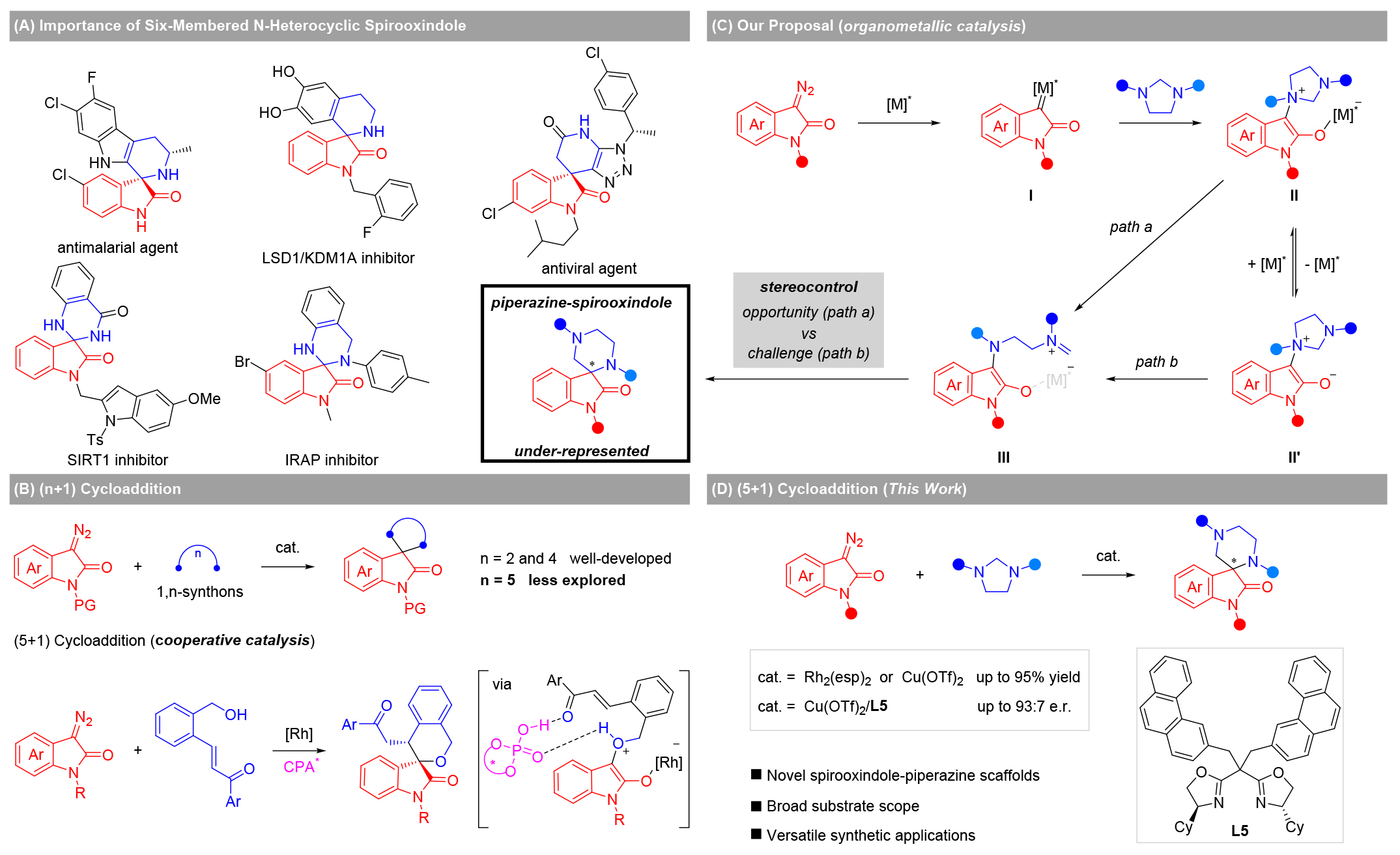
圖2 研究背景
消旋條件優(yōu)化:課題組以研究重氮吲哚酮1a與咪唑烷2a的形式上的(5 + 1)環(huán)加成反應(yīng)為起始點(diǎn)。首先篩選了銠、金、鈀、銀等貴金屬,令人滿意的是,以Rh?(esp)?為催化劑,在室溫下的二氯甲烷中,通過(guò)注射泵在1小時(shí)內(nèi)緩慢地將1a加入到2a中,能以90%的產(chǎn)率得到所需的螺氧吲哚-哌嗪產(chǎn)物3(條件A)。此外,進(jìn)一步篩選催化劑發(fā)現(xiàn)廉價(jià)金屬Cu(OTf)?是一種有效的催化劑,在室溫下的二氯甲烷中能以60%的產(chǎn)率得到產(chǎn)物3。隨后對(duì)其他反應(yīng)參數(shù)進(jìn)行了優(yōu)化,包括溶劑、溫度和催化劑負(fù)載量。最關(guān)鍵操作的是提高了反應(yīng)溫度,在密封管中80℃下反應(yīng),產(chǎn)物3的產(chǎn)率可達(dá)85%(條件B)。
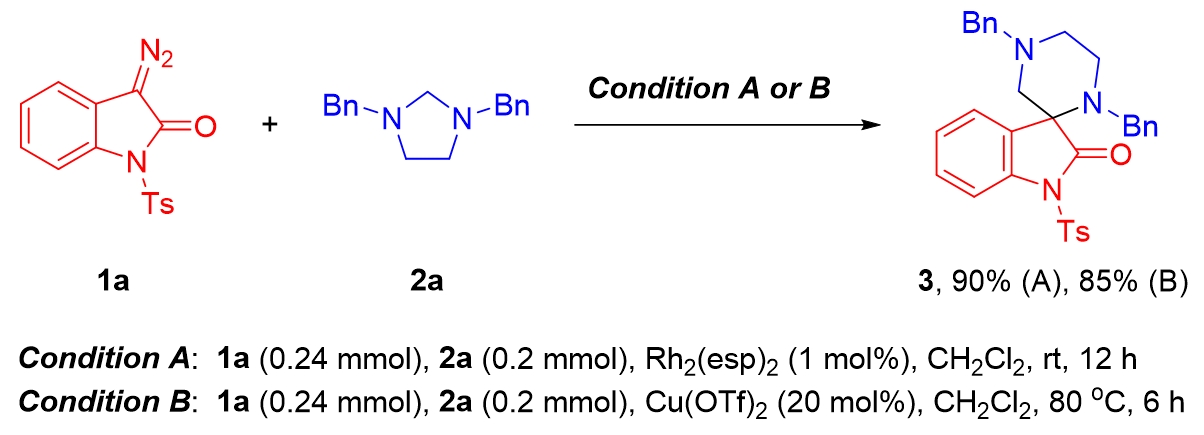
圖3 最優(yōu)反應(yīng)條件
底物拓展:重氮吲哚酮的N-保護(hù)基可在條件A和B下靈活調(diào)控,均以良好產(chǎn)率生成產(chǎn)物(3-8)。芳環(huán)含單取代給電子基(甲基、甲氧基)或吸電子基(鹵素、硝基)的底物,在條件A(45%-91%)和條件B(33%-75%)下均高效轉(zhuǎn)化(9-26)。多取代芳基及大位阻萘基環(huán)底物亦成功兼容(27-29),且銅催化劑活性普遍低于銠體系。此外,1-重氮-2-茚滿酮、3-重氮苯并呋喃酮及苯并[b]噻吩酮等重氮化合物同樣適用,銠催化可高效構(gòu)建螺環(huán)產(chǎn)物(30-32),顯著優(yōu)于銅催化體系。隨后對(duì)咪唑烷底物研究表明:對(duì)稱(chēng)N-烷基咪唑烷在銠催化下產(chǎn)率高達(dá)95%(產(chǎn)物33-35),而銅催化需以HFIP替代CH?Cl?方能實(shí)現(xiàn)高效轉(zhuǎn)化。相比之下,對(duì)稱(chēng)N-芳基咪唑烷因親核性弱、溶解性差,在兩種條件下均反應(yīng)緩慢(產(chǎn)物36-37,中等產(chǎn)率)。2-甲基咪唑烷僅生成微量不可分離的非對(duì)映異構(gòu)體混合物(38),而4,4-二甲基咪唑烷專(zhuān)一生成單區(qū)域異構(gòu)體39a。三類(lèi)不對(duì)稱(chēng)N-取代咪唑烷(N-芐基/甲基、N-芐基/芳基、N-芳基?/芳基?)均適配該反應(yīng),銠催化對(duì)前兩類(lèi)底物展現(xiàn)出更優(yōu)區(qū)域選擇性(產(chǎn)物40-41),而N-芳基?/芳基?體系在兩種條件下選擇性相近(產(chǎn)物42)。
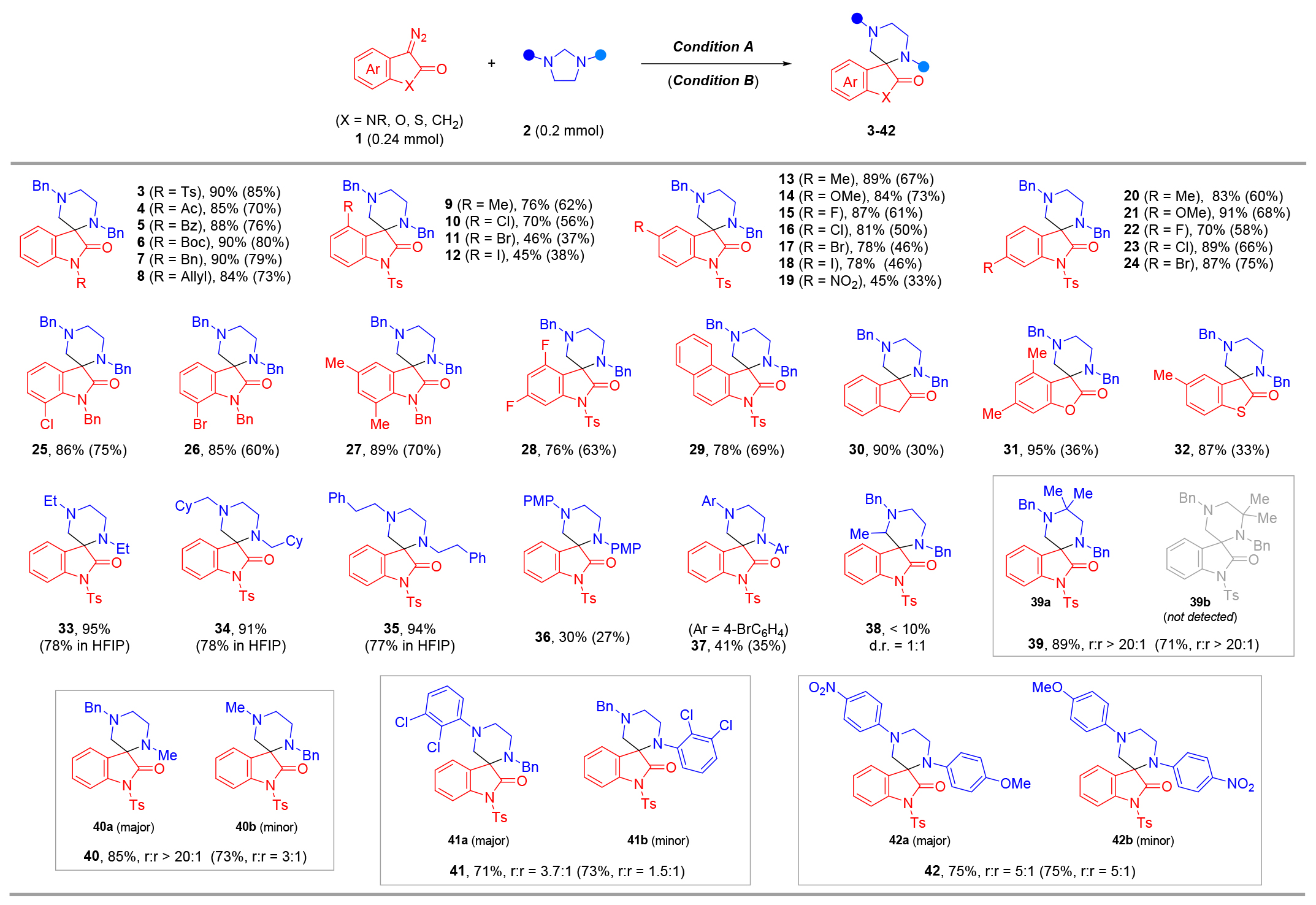
圖4 底物拓展
轉(zhuǎn)化應(yīng)用:在銠催化條件下(條件A),成功進(jìn)行了克級(jí)規(guī)模的合成實(shí)驗(yàn),結(jié)果穩(wěn)定(方案A)。此外,該方法對(duì)多種官能團(tuán)具有良好的耐受性,為后續(xù)修飾提供了豐富的機(jī)會(huì)。例如,鹵素官能團(tuán)(如芳基溴)兼容性良好,可用于Suzuki、Sonogashira、Heck和Rosenmund-von Braun等過(guò)渡金屬催化的交叉偶聯(lián)反應(yīng),生成多樣化的螺氧吲哚產(chǎn)物43-48(方案B)。
產(chǎn)物的選擇性N-脫保護(hù)易于實(shí)現(xiàn)(方案C):產(chǎn)物3在室溫下用濃硫酸處理,幾乎定量脫去對(duì)甲苯磺酰基(Ts)生成產(chǎn)物49;產(chǎn)物3與氯甲酸α-氯乙酯在二氯甲烷中反應(yīng),隨后在甲醇中回流,可選擇性脫去遠(yuǎn)端的N1-芐基保護(hù)基,幾乎定量生成產(chǎn)物50a。產(chǎn)物50a的結(jié)構(gòu)通過(guò)X射線衍射分析確認(rèn),證實(shí)了對(duì)遠(yuǎn)端N1-芐基的選擇性脫保護(hù)(CCDC 2285029)。
此外,還嘗試將得到的N1-脫保護(hù)產(chǎn)物用作平臺(tái)分子,以衍生出具有藥物結(jié)構(gòu)的分子。在驗(yàn)證了N-烷基化、炔丙基化和磺酰基化取代反應(yīng)(產(chǎn)物40b、51、52和53)的可行性后,可輕松地將不同的藥效基團(tuán)組裝起來(lái),分別得到與Cyclizine、Sildenafil、Imatinib和Aripiprazole相關(guān)的螺氧吲哚衍生物(產(chǎn)物54-57)。這些轉(zhuǎn)化反應(yīng)展示了我們所開(kāi)發(fā)方法在合成方面的潛在應(yīng)用價(jià)值。
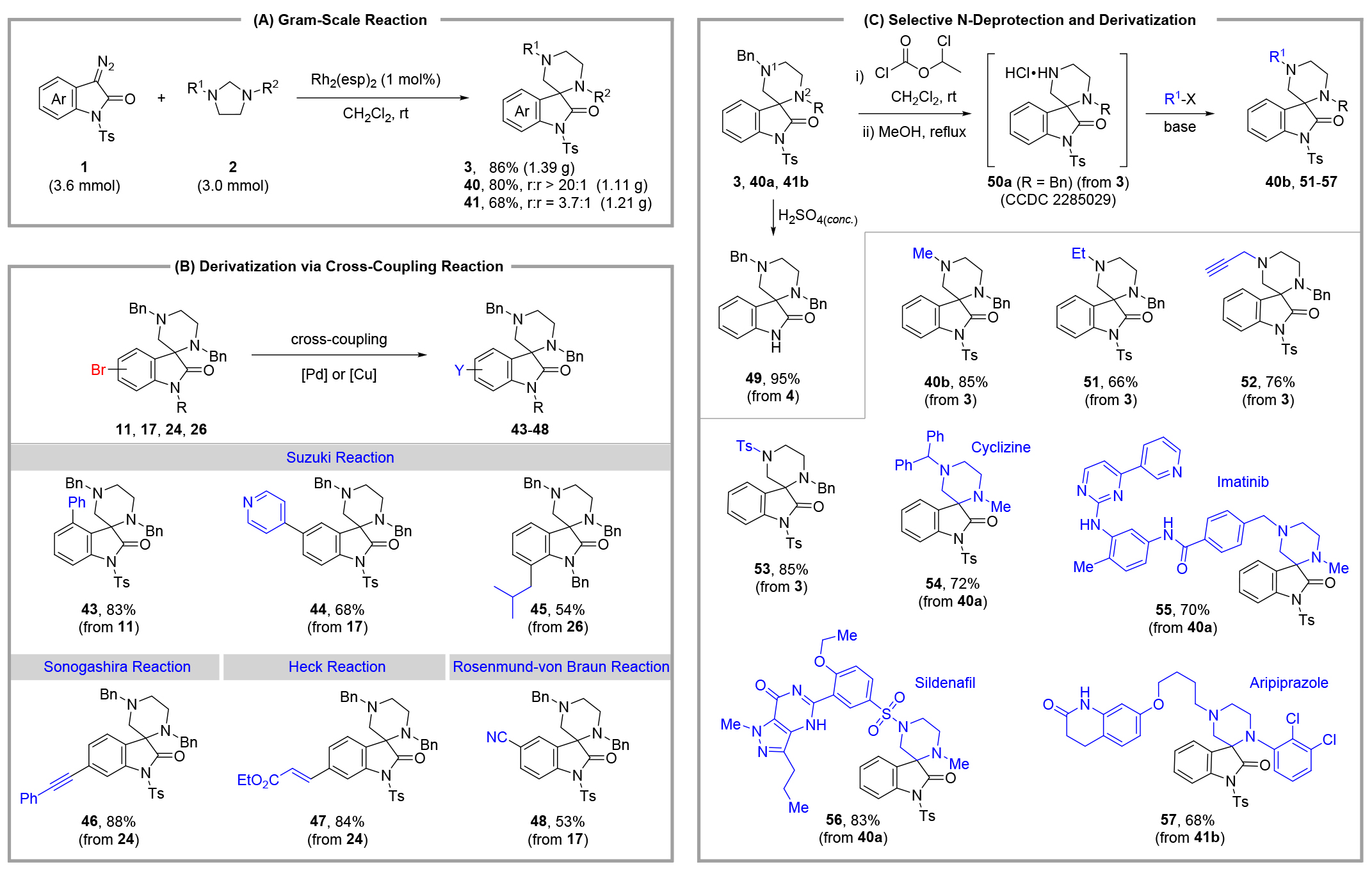
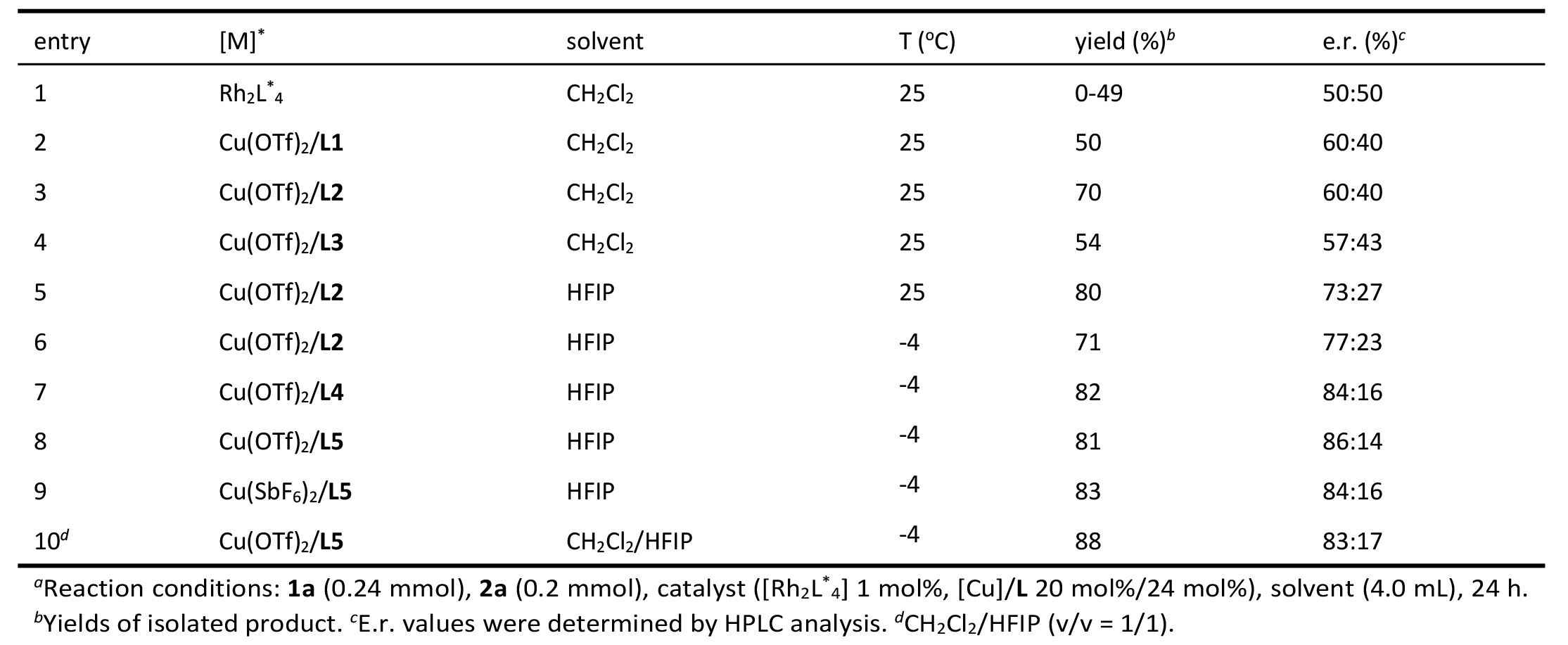
圖5 轉(zhuǎn)化應(yīng)用
不對(duì)稱(chēng)探索:在探索不對(duì)稱(chēng)合成光學(xué)活性螺氧吲哚-哌嗪類(lèi)化合物的過(guò)程中,課題組首先評(píng)估了多種手性銠催化劑(Rh?(S-DOSP)?、Rh?(S-PTTL)?、Rh?(S-NTTL)?、Rh?(R-BTPCP)?)在重氮氧吲哚1a與咪唑烷2a的(5+1)環(huán)加成反應(yīng)中的性能,但未能實(shí)現(xiàn)立體選擇性控制。隨后轉(zhuǎn)向Cu(Ⅱ)/BOX催化體系,發(fā)現(xiàn)Cu(OTf)?/Cy-BOX(配體L1)組合可獲得60:40的對(duì)映體比例(表1,條目2)。進(jìn)一步測(cè)試了更多BOX配體,發(fā)現(xiàn)Cy-SaBOX L2表現(xiàn)更優(yōu),產(chǎn)率和對(duì)映選擇性均佳(表1,條目3)。使用HFIP作為溶劑時(shí),對(duì)映體比例提升至73:27(表1,條目5),低溫條件進(jìn)一步優(yōu)化對(duì)映選擇性至77:23(表1,條目6)。通過(guò)合成不同側(cè)鏈的Cy-SaBOX配體,發(fā)現(xiàn)2-萘基衍生的L4對(duì)映體比例達(dá)84:16(表1,條目7),而3-菲基衍生的L5表現(xiàn)最佳,產(chǎn)率為81%,對(duì)映體比例達(dá)86:14(表1,條目8)。Cu(OTf)?/L5的晶體結(jié)構(gòu)已確定(CCDC 2414952)。其他銅催化劑或共溶劑體系未能帶來(lái)進(jìn)一步改善(表1,條目9-10)。
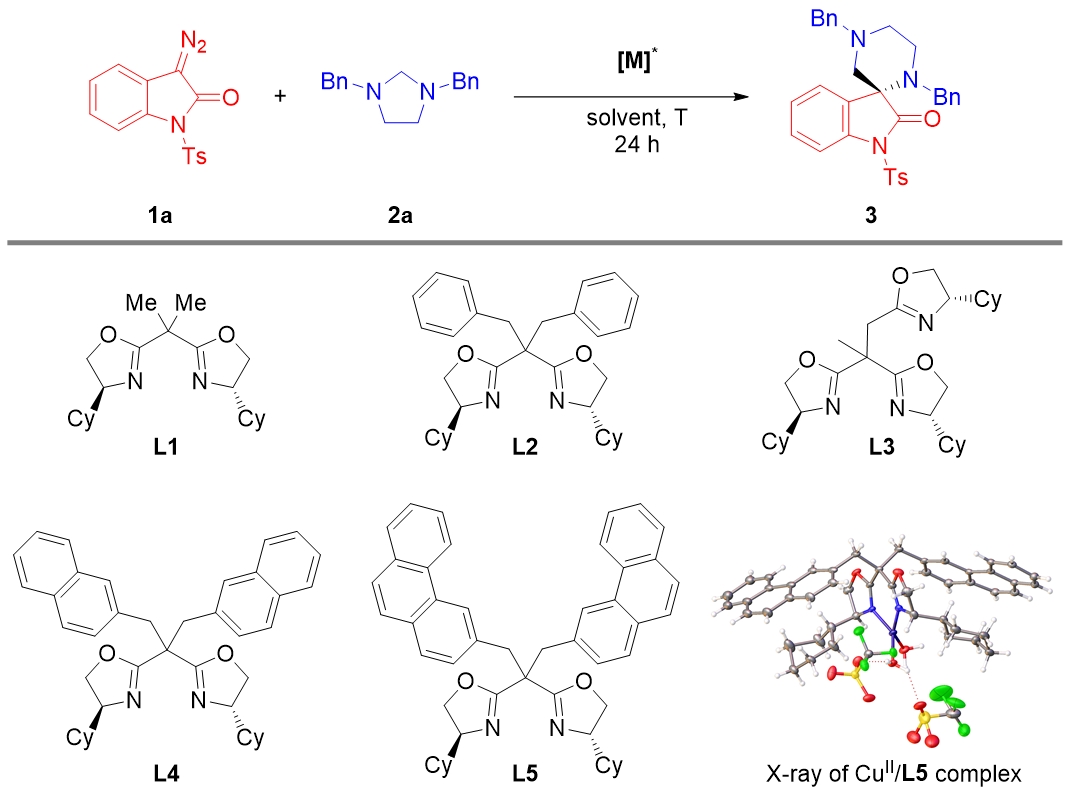
表1 不對(duì)稱(chēng)條件探索
為了進(jìn)一步提高對(duì)映選擇性,在Cu(OTf)?/L5催化體系下,于六氟異丙醇(HFIP)中,在-4℃的條件下研究了兩種底物的保護(hù)基效應(yīng)。帶有乙酰基或芐基的重氮氧吲哚所得到的對(duì)映選擇性較差(產(chǎn)物4和7)。除了對(duì)甲苯磺酰基外,還測(cè)試了其他幾種磺酰基(產(chǎn)物58-60),其中1-萘基磺酰基得到的結(jié)果稍好一些(產(chǎn)物60)。對(duì)于N-烷基和N-芳基咪唑烷,反應(yīng)進(jìn)行得非常緩慢,且立體選擇性控制效果不佳(產(chǎn)物34和36)。還評(píng)估了其他幾種芐基(產(chǎn)物61-63),其中4-甲氧基芐基(PMB)得到的e.r.為91:9(產(chǎn)物61)。當(dāng)帶有1-萘基磺酰基的重氮氧吲哚和帶有PMB保護(hù)基的咪唑烷在不對(duì)稱(chēng)反應(yīng)條件下反應(yīng)時(shí),以77%的產(chǎn)率和93:7的對(duì)映體比例得到了目標(biāo)產(chǎn)物64。
隨后,針對(duì)一系列選定的典型底物研究了這種催化不對(duì)稱(chēng)(5+1)環(huán)加成反應(yīng)的普適性。對(duì)于C5/C6位取代的重氮氧吲哚(產(chǎn)物66-71),獲得了較好的對(duì)映選擇性,而C4位取代的重氮氧吲哚僅實(shí)現(xiàn)了中等程度的立體選擇性控制(產(chǎn)物65)。此外,碳取代的咪唑烷與該反應(yīng)具有良好的兼容性,得到了產(chǎn)物72和73,產(chǎn)率和立體選擇性都在可接受的范圍內(nèi)。遺憾的是,在不對(duì)稱(chēng)反應(yīng)條件下,重氮氧吲哚與六氫嘧啶幾乎不發(fā)生反應(yīng)(產(chǎn)物74)。
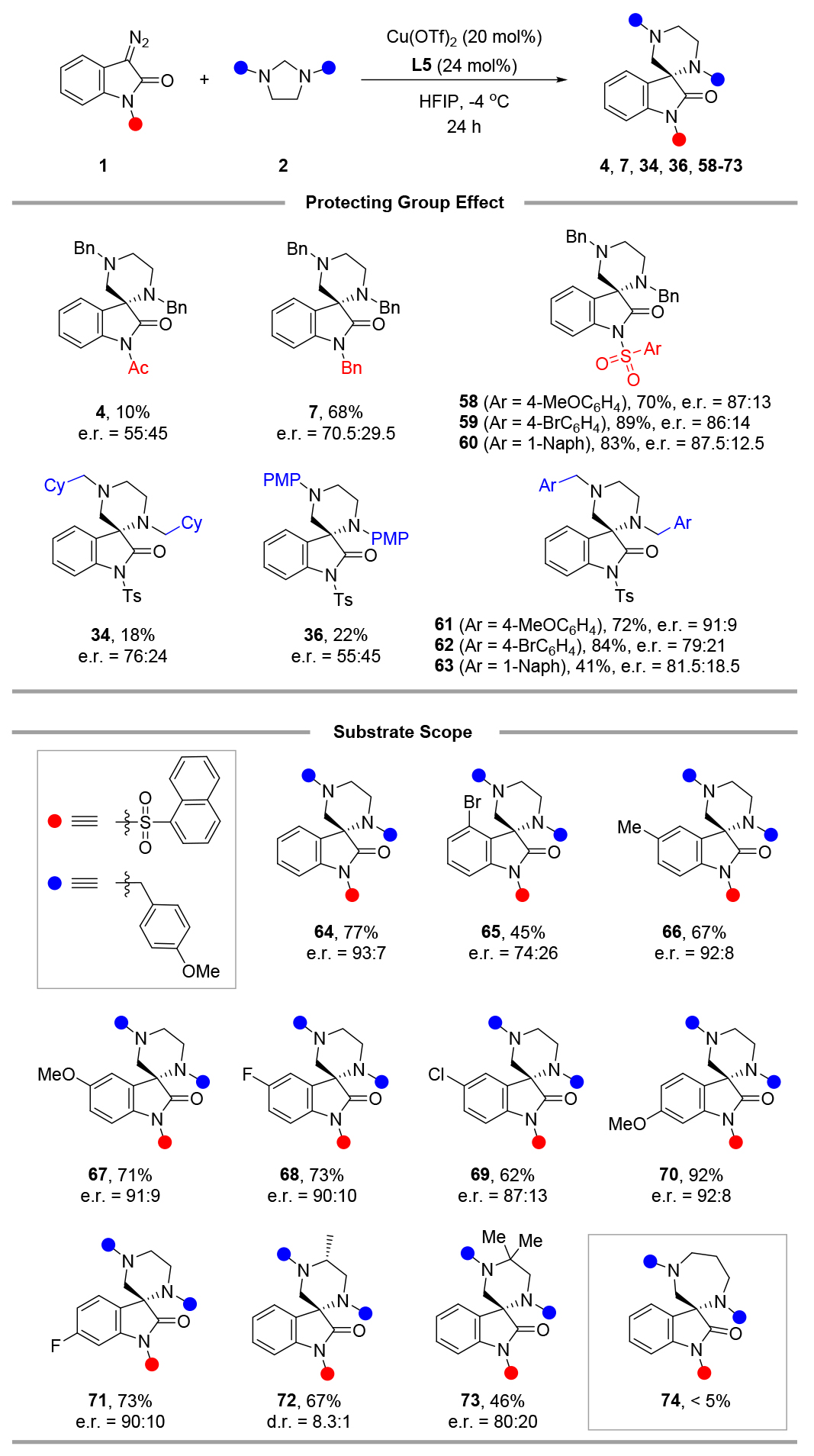
圖6 保護(hù)基篩選及底物拓展
此外,基于Cu(OTf)2/L5配合物的晶體結(jié)構(gòu)、Cu(II)/雙噁唑啉(BOX)/二羰基配合物的平面四邊形幾何構(gòu)型 ,以及所提出的逐步環(huán)化機(jī)理,初步提出了一個(gè)可行的模型來(lái)解釋該反應(yīng)中的對(duì)映選擇性(圖7)。由于與配體上的環(huán)己基取代基之間的空間位阻相互作用較小,通過(guò)烯醇鹽對(duì)亞胺離子雙鍵的選擇性從Re面進(jìn)行分子內(nèi)加成,主要生成了R構(gòu)型的產(chǎn)物。
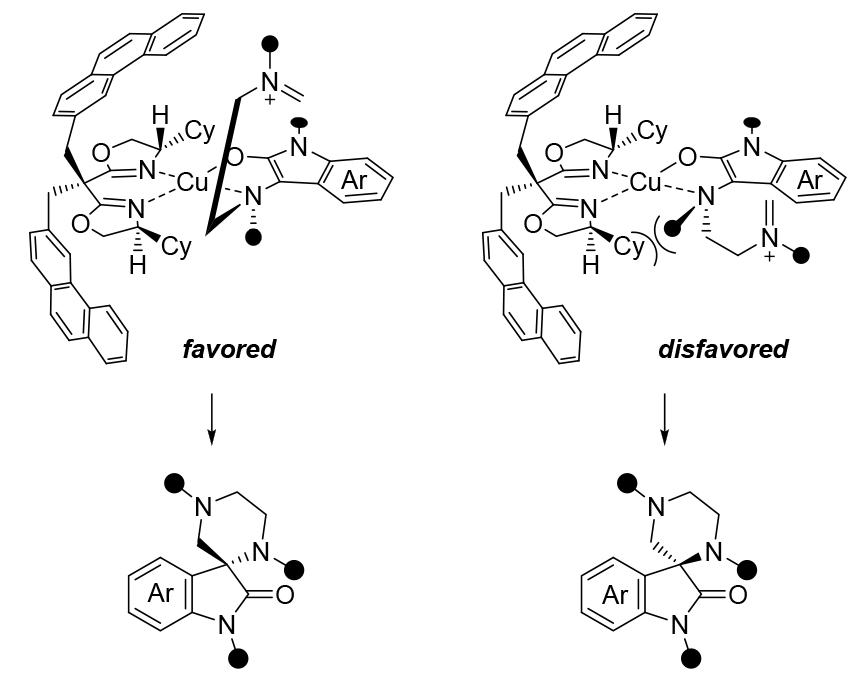
圖7立體選擇性的可能模型
總結(jié) 綜上所述,開(kāi)發(fā)了重氮氧吲哚與咪唑烷的催化(5 + 1)環(huán)加成反應(yīng),建立了一種通用且高效的策略,在銠或銅的催化作用下,以中等至優(yōu)異的產(chǎn)率構(gòu)建了一系列螺環(huán)氧化吲哚-哌嗪化合物庫(kù)。此外,已實(shí)現(xiàn)了對(duì)所得產(chǎn)物的多種轉(zhuǎn)化,從而獲得了更復(fù)雜甚至具有藥物衍生性質(zhì)的螺環(huán)氧化吲哚。重要的是,通過(guò)使用Cu(OTf)2和SaBOX配體L5,也實(shí)現(xiàn)了該反應(yīng)的不對(duì)稱(chēng)合成。本報(bào)告證明,銠和銅都是該反應(yīng)的有效催化劑,并且在涉及重氮卡賓-葉立德中間體的催化不對(duì)稱(chēng)反應(yīng)中,銅比銠更具優(yōu)勢(shì)。 作者簡(jiǎn)介 五邑大學(xué)藥學(xué)與食品工程學(xué)院彭士勇課題組成立于2017年,研究方向?yàn)榻饘儆袡C(jī)化學(xué),不對(duì)稱(chēng)合成。現(xiàn)已在ACS Catal.,Org. Lett.,J. Org. Chem.等期刊發(fā)表相關(guān)學(xué)術(shù)論文40余篇,主持國(guó)家自然科學(xué)基金,廣東省自然科學(xué)基金、廣東省教育廳、五邑大學(xué)高層次人才項(xiàng)目5項(xiàng),詳見(jiàn)課題組主頁(yè):https://www.x-mol.com/groups/peng_shiyong
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來(lái)源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請(qǐng)作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn