

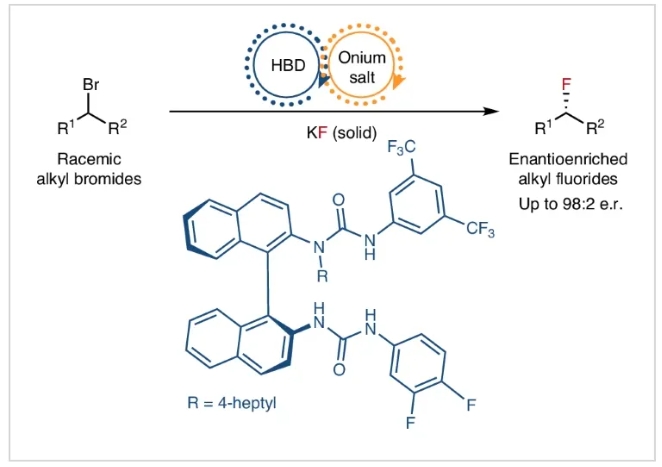
正文
催化對映收斂親核取代反應是一類極具價值的轉化反應,但其在實施過程中卻異常困難。特別是親核氟化反應,主要是由于其低溶解度、高吸濕性和布朗斯臺德堿性,且使用廉價的堿金屬氟化物作為氟化試劑時尤為具有挑戰性。近期,英國牛津大學Véronique Gouverneur課題組、英國愛丁堡大學Guy C. Lloyd-Jones課題組與美國科羅拉多州立大學Robert S. Paton課題組提出了一種解決方案,即使用協同氫鍵相轉移催化來實現催化對映收斂親核取代反應。其利用手性雙脲氫鍵供體與鎓鹽相結合所形成的手性三元復合物來對外消旋的芐基溴化物和α-溴代酮進行對映選擇性識別,從而高對映選擇性的得到氟化產物(Fig. 1)。歡迎下載化學加APP到手機桌面,合成化學產業資源聚合服務平臺。
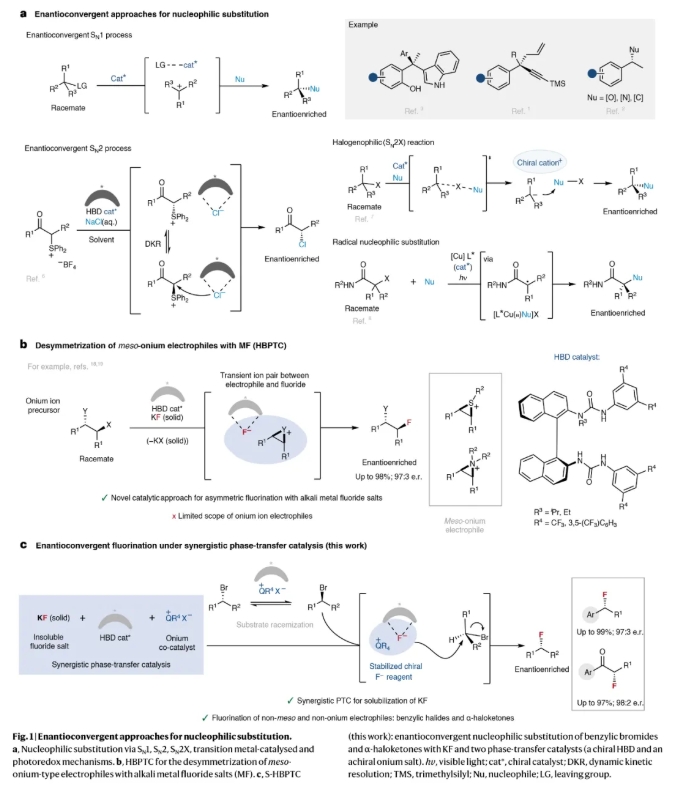
(圖片來源:Nat. Catal.)
首先,作者以外消旋的二級芐溴rac-1a作為模板底物對反應進行探索(Fig. 2)。通過對反應條件進行的一系列篩選,作者發現當使用rac-1a (1.0 equiv), (S)-3h (10 mol%), Ph4P+I- (10 mol%), KF (2.5 equiv), 在對二甲苯 (0.25 M)中, 15 oC反應72小時,可以以76%的產率, 92.5:7.5 e.r.得到產物2a(entry 9)。
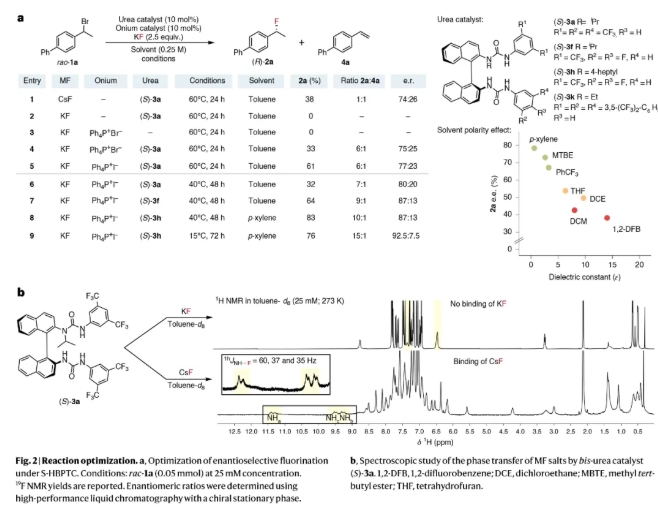
(圖片來源:Nat. Catal.)
在確立了最優條件之后,作者對一系列底物進行了評估,以探究該對映收斂轉化反應的應用范圍,并初步了解其反應機制(Fig. 3)。雙苯環骨架上不同電性的取代基對產物的對映選擇性影響甚微(2a-2c)。基于1-萘結構的底物(2h-2p, 2x和2y)在氟化反應中表現出最高的對映選擇性(高達97:3 e.r.)。常見的官能團,包括酰胺(2f)、醚(2c和2w)、芳基鹵化物(2b, 2r和2w)以及羧酸酯(2ag)和磺酸酯(2v),在反應條件下均表現出良好的耐受性。反應條件的溫和性體現在對親氟官能團的耐受性上,包括硼酸頻哪醇酯(2t)和三甲基硅基(2u)。烷基鏈的變化表明,從甲基到正丙基的長度增加對取代與消除反應的影響較小,氟化產物的分離收率高達86%,對映選擇性高達96:4 e.r.(2h, 2l和2p)。除了基于苯基的底物,反應條件進一步擴展至一系列O-和N-雜芳環結構的氟化,包括喹啉(2x和2y)、吲哚(2z)、吲唑(2aa)、苯并呋喃(2ab和2ac)和苯并噻吩(2ad)。最后,作者對更復雜的生物活性分子類似物進行了對映匯聚氟化,包括喹唑啉(2af;65%收率;78:22 e.r.)、非諾貝特(2ag;54%收率;93:7 e.r.)和塞來昔布衍生物(2ah;83%收率;93.5:6.5 e.r.)。盡管在芳環上存在間位取代基時反應活性和對映選擇性得以保持(2g),但對于具有大位阻鄰位(2ai)或α-位取代基(2ak和2aj)的底物,反應活性有所下降。反應條件也不適用于叔芐基底物(2al)的氟化,該底物主要發生消除反應生成相應的烯烴副產物。
基于S-HBPTC(協同氫鍵相轉移催化)在合成對映體富集的芐基氟化物方面的成功應用,作者進一步考察了其對其他親電試劑的氟化反應。作者選擇α-鹵代酮作為研究對象,因為目前所有合成對映體富集的α-氟代酮的方法都依賴于原子經濟性較差的親電氟化試劑(例如N-氟代苯磺酰亞胺)。令人欣慰的是,僅需對體系進行微調,使用 (S)-3k和Et4N+I?作為鎓鹽,即可實現α-溴代酮9a與KF的催化氟化反應,收率達65%,對映選擇性為95:5 e.r.。由于底物在低極性溶劑中的溶解性較差,作者選擇乙腈作為該轉化的溶劑。在優化的反應條件下,多種α-溴代酮均表現出良好的反應活性和對映選擇性,無論是吸電子基團還是供電子基團(10c和10f–10k)。具有較長烷基鏈的α-氟代酮在較高反應溫度下也能以良好的收率和對映選擇性制備(10l和10m)。值得注意的是,具有1-萘骨架的酮表現出最高的對映選擇性,這進一步證實了具有擴展π-體系的親電試劑的氟化過程(10d和10e)。
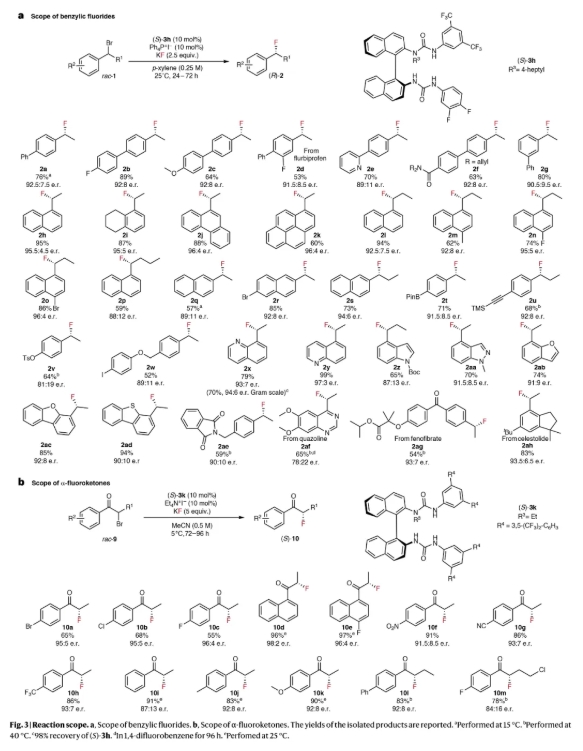
(圖片來源:Nat. Catal.)
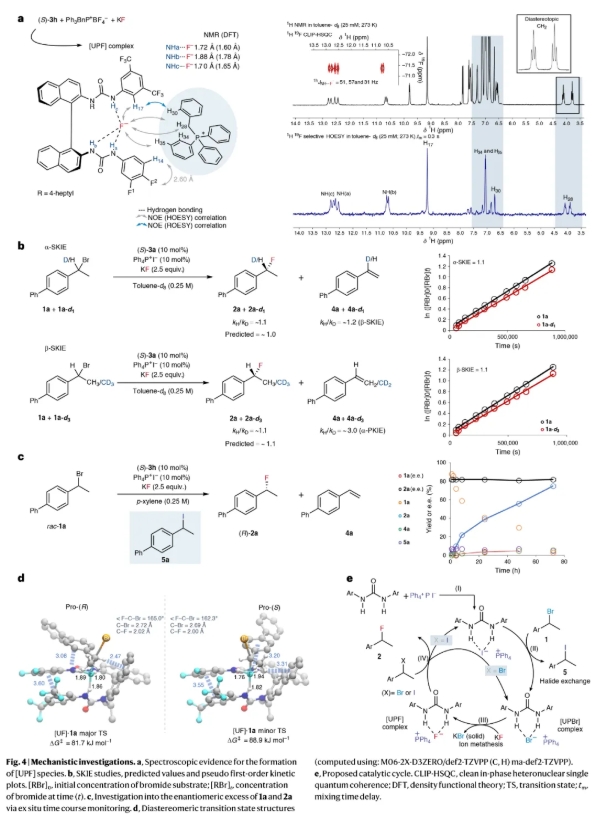
為了深入了解催化劑的協同作用,作者進行了初步的機理研究(Fig. 4)。通過核磁,作者得出脲和鏻鹽能夠溶解氟化鉀,從而形成一個動態穩定的單一三元氫鍵復合物(Fig. 4a)。此外,作者還探討了當使用鎓碘鹽而非鎓溴鹽作為共催化劑時,反應速率適度提升的原因,以及[UPF]物種與親電試劑之間非共價相互作用的本質。本研究以芐基溴化物為研究對象,因其反應機理較為復雜;而對于α-鹵代酮類底物,則可以排除SN1機制的可能性,因此也排除了與碳正離子中間體形成離子對的可能性。隨后,作者進行了動力學同位素效應研究(Fig. 4b)。通過對時間-濃度數據的分析,作者發現溴化物(1a和1a-dn)的消耗遵循近似一級動力學,生成氟化物(2a和2a-dn)和烯烴(4a和4a-dn)的比例保持恒定。這表明兩種產物均通過同一反應路徑的不可逆分配生成,從而可以估算出氟化加成(α-SKIE ≈ 1.1,β-SKIE ≈ 1.1)和消除反應(β-SKIE ≈ 1.2,α-PKIE ≈ 3.0)產生的動力學同位素效應(KIE)。KIE數據并不支持芐基底物發生顯著的電荷分離電離,而是更符合在S-HBPTC條件下對二甲苯中對映匯聚氟化反應的SN2-類似過程,這一結論進一步得到了通過計算過渡態結構預測的KIE值的支持。這些數值可以與1b或1b-d3在二氯甲烷中與四丁基氟化銨進行的非催化均相反應的KIE值進行比較,其中氟化加成的β-SKIE約為1.5,消除反應的α-PKIE約為5.8,該反應的動力學特征更符合SN1/E1過程。
在對二甲苯中,S-HBPTC條件下的氟化反應遵循SN2-類似機制,要求芐基底物(1a)能夠高效外消旋化,以獲得高產率和高對映選擇性。反應監測表明,1a在整個反應過程中保持外消旋狀態(Fig. 4c),這表明底物的外消旋化速率超過了氟化速率,α-溴代酮9a也觀察到了類似的趨勢。在沒有催化劑的情況下,作者并未檢測到對映體富集的芐基溴化物1a(63:37 e.r.)的外消旋化。然而,在(S)-3f(10 mol%)存在下,作者觀察到了1a的外消旋化,而在Ph4P+I?(10 mol%)存在下,外消旋化程度較低。當對映體富集的1a同時暴露于HBD和鎓催化劑時,則發生了完全的外消旋化。在確定了[UPF]復合物的一些關鍵結構特征后,作者進一步研究了導致對映選擇性識別的催化劑-底物相互作用。通過計算rac-1a與(S)-3f衍生的[UF]反應的非對映過渡態結構,作者預測了生成(R)-2a和(S)-2a的活化自由能(ΔG?)分別為81.7和88.9 kJ mol?1(Fig. 4d)。根據Curtin-Hammett原理預測的對映選擇性在25°C時e.r.值為91:9,與實驗獲得的絕對構型和對映體富集水平高度吻合(Fig. 2a)。兩個競爭的過渡態均顯示出底物與催化劑脲之間的色散力主導的相互作用對芐基底物的穩定化作用。然而,主要和次要過渡態結構之間的一個關鍵區別在于,底物的芐基質子與(S)-3f的BINAM骨架之間存在強烈的直接CBnH-π相互作用。
基于上述實驗結果,作者提出了一個可能的催化循環(Fig. 4e)。該機制涉及在(S)-3h的促進下,rac-1a與Ph4P+I?之間的初始鹵素交換,生成芐基碘化物5a和[UPBr]復合物(I–II)。[UPBr]與KF發生離子交換,形成[UPF]物種(III)和KBr。值得注意的是,這一相轉移步驟通過光譜學手段從[UPBr]和KF中觀察到,但從[UPI]復合物中未觀察到,其原因是KBr的沉淀是催化循環中的熱力學驅動力(KBr晶格能 = 672 kJ mol?1;KI晶格能 = 632 kJ mol?1)。[UPF]向1a或5a傳遞氟離子,不可逆地生成對映體富集的芐基氟化物2a,并分別再生[UPBr]或[UPI](IV)。
(圖片來源:Nat. Catal.)
總結
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn