


背景介紹
氘在過去二十年中成為了藥物化學研究的主角。近年來,隨著氘代藥物的興起,人們對其在減少潛在毒性、提高代謝穩定性和改善藥代動力學特性方面的作用產生了極大興趣。目前,藥物通常通過細胞色素P450(CYP450)酶介導的氧化代謝,藥物代謝位點上的C-H鍵被更穩定的C-D鍵替代,特別是在α-位置與雜原子相鄰時,C-D鍵作為生物等效物具有增強藥物藥代動力學特性的潛力。這些研究促成了首例氘代藥物——氘代丁苯那嗪(deutetrabenazine)的成功研發。近年來,基于氘標記策略,已開發出幾種新型氘標記藥物,如氘克拉維替尼(deucravacitinib)、氘那非替尼(donafenib)、VV116和氘魯索替尼(deuruxolitinib),這些藥物在各種醫學應用中展現了廣泛前景。此外,氘標記在其他科學應用中也表現出極大的潛力,如代謝物研究、核磁共振(NMR)光譜學內部標準物質的使用,以及在合成有機化學中作為探針揭示反應機制等。因此,探索氘代分子的化學空間,為多學科領域內功能分子的創新與發現提供了有前景的路徑(見圖1a)
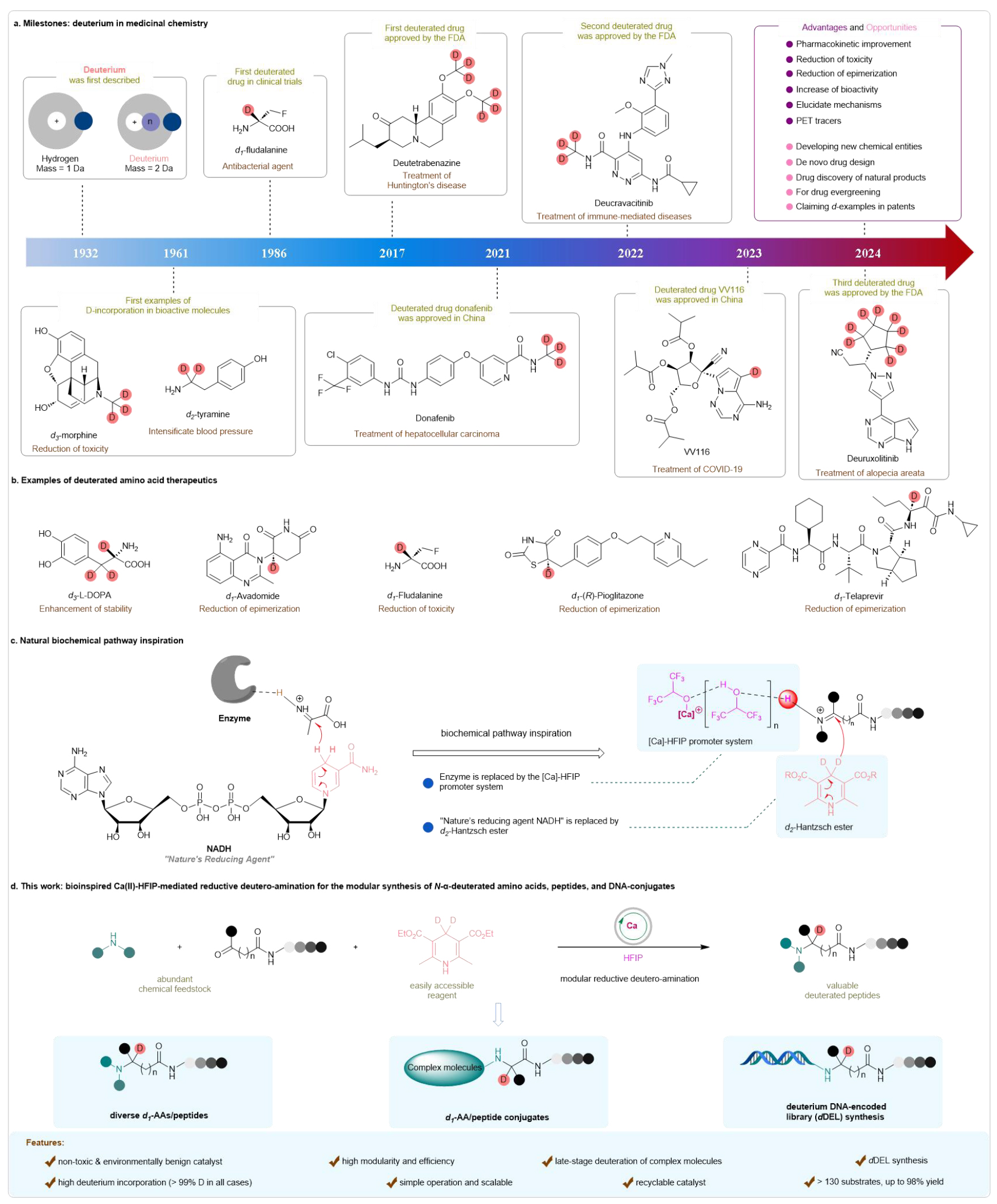
圖1. 研究背景及意義(來源:Nat. Commun)
氨基酸是生命的基本單元,廣泛存在于小分子藥物、肽類的治療藥物中。氘代氨基酸及其衍生物在闡明生物合成途徑、酶機制、肽/蛋白質結構、改善吸收分布代謝排泄(ADME)特性以及增強藥效方面顯示出廣泛的應用。此外,氘代的氨基酸藥物候選分子,尤其是在α-位置相對于氮的氘化,已被廣泛研究(見圖1b)。但是,現有的合成方法通常存在一些局限性,包括需要預先合成的復雜底物、苛刻的反應條件、使用貴金屬和/或毒性催化劑,以及氘代率低等。這些不足以滿足市場對高同位素純度(理想情況下超過98%)氘標記活性藥物成分(API)的需求。此外,多個氘原子的引入可能會導致化合物的物理性質(如溶解度和親脂性)發生意想不到的變化,進而可能影響血漿蛋白結合(如d?-咖啡因),以及吸收程度和/或速率的差異,同時也會增加整體成本。因此,在氘代氨基酸藥物發現領域,特別是在氘標記α-位置相對于雜原子的位點選擇性引入,保持最小氘原子數并達到較高的氘代率,對于提高藥代動力學特性至關重要。然而,這仍然是一個無法逾越的挑戰。受到生物還原胺化概念的啟發,該研究開發了一種仿生Ca(II)-HFIP催化的還原氘代胺化策略,以高產率和在α-位點選擇性構建了一系列氘代氨基酸,肽(見圖1c)。本研究的亮點如下:(1)在方法學方面,開發了仿生Ca(II)-HFIP介導的模塊化且高效的還原氘胺化策略,結合了三種易得的原料——氨基、酮酸酯和d?-HE,可以在溫和反應條件(室溫)下進行一鍋法合成N-α-氘代氨基酸;(2)在適用范圍方面,多種氨基酸、肽、藥物分子及其各種取代衍生物均具有良好的兼容性;(3)在催化劑回收方面,該催化劑具有較高的水溶性,便于回收;(4)在應用方面,該方法能夠應用于On-DNA合成實現DNA編碼的氘代多肽庫的構建(見圖1d)。
圖文解析
該團隊首先反應條件進行了優化,確定了最佳的反應條件:以5 mol%的Ca(NTf2)2作為催化劑,d2-HE1(1.5 eq)作為氘源,HFIP作為溶劑,在室溫下反應12小時(圖2)。值得注意的是,添加HFIP作為混合溶劑可顯著提高鈣催化的反應活性。研究團隊進一步探索了該體系的底物兼容性(圖3)。甲基、異丙基和叔丁基等基團得到了良好的耐受,并在優異的產率下提供了目標氘標記氨基酸(2-4)。鹵素取代的苯胺類化合物也與體系兼容,能夠提供相應的產物(5-8),產率為78%到98%,為進一步通過金屬催化交叉偶聯反應進行衍生化提供了機會。此外,該反應還適用于一系列電子結構各異的底物。給電子基團表現良好,能夠得到目標產物9和10。吸電子基團,如-CO2Me、-SF5、-OCF3、-CONH2、-CONHMe、-CONMe2、-CN、-NO2等取代的苯胺,都可以作為可行底物,獲得相應產物(11-18)。值得注意的是,在苯胺上引入可還原的官能團(如氰基、硝基、酰胺或酯基)時,反應表現出較高的化學選擇性。氘代氨基酸16的結構通過X射線晶體學進一步得到確認。苯環上取代基的位置對反應結果沒有顯著影響(見產物19和20)。此外,酮酸類化合物作為多功能底物,也能高效地產生相應的化合物(21-24),這些化合物在C端具有自由的羧基。進一步研究表明,二取代和三取代的苯胺也可以作為適宜的底物,順利生成相應的產物(25-29)。該策略不僅限于苯胺,2-萘胺也可以作為底物參與反應,得到相應的產物(30和31)。硫、氧和氮雜環化合物在此轉化過程中均能保持完整(32-34)。并且,初級烷基胺在反應條件下也能得到良好耐受,并能以優異的產率得到目標產物(35、36)。令人欣慰的是,發現二級芳基胺與開發的鈣(II)催化體系具有良好的兼容性。對稱(37-41)和不對稱的二芳基胺(42-45)、芳基-烷基胺(46、47)以及環狀胺(48-50)均能很好地耐受,得到了相應的d1-甘氨酸。重要的是,該策略能兼容二級烷基胺,產率良好(51、52)。該團隊進一步考察酮酸酯或酮酸,以合成多種天然/非天然的氘標記氨基酸衍生物。使用甲基丙酮酸作為原料,與不同的胺反應,順利得到了多種氘標記的丙氨酸衍生物(d1-Ala)(53-64)。多種烷基取代的酮酸酯/酸適用于氘代天然氨基酸衍生物的合成。如d1-苯丙氨酸(65)、d1-纈氨酸(66)、d1-酪氨酸(67)、d1-色氨酸(68)等。非天然氨基酸因能夠設計具有增強穩定性和功能性的蛋白質,在藥物發現中引起了廣泛關注。研究發現,乙基取代的酮酸酯、環狀酮酸酯以及較長碳鏈的酮酸酯可以作為可行的底物,成功合成了相應的氘標記非天然氨基酸衍生物(d1-UAAs 69-73),產率為74%到89%。
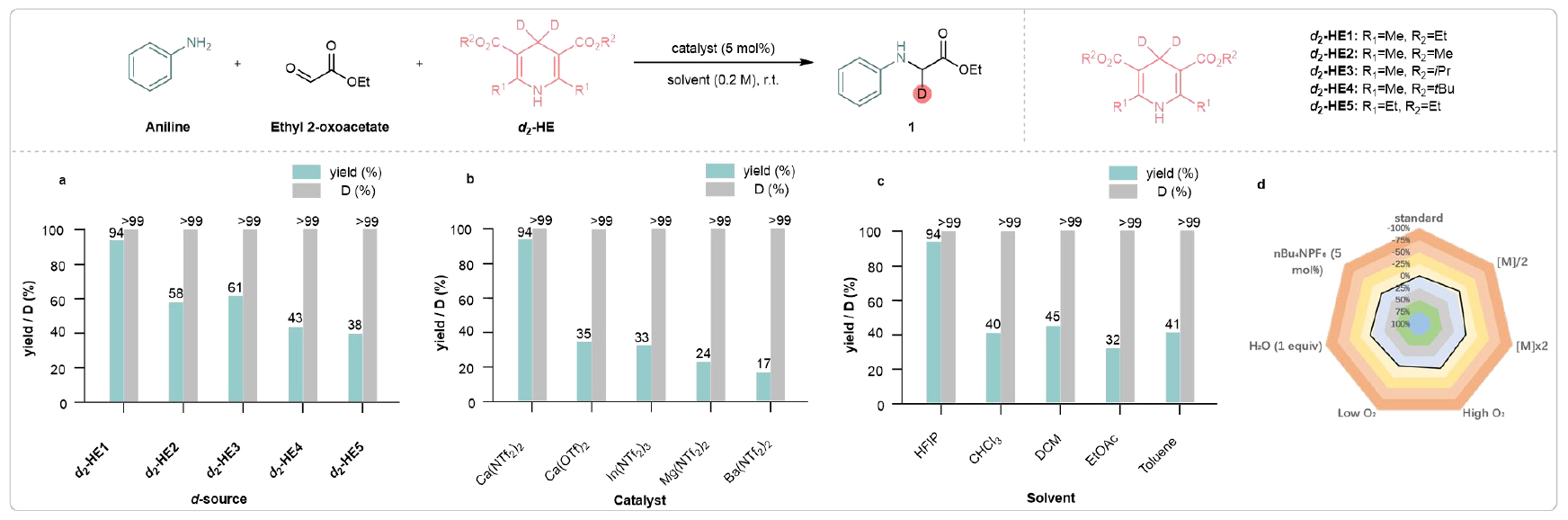
圖2. 條件優化(來源:Nat. Commun)
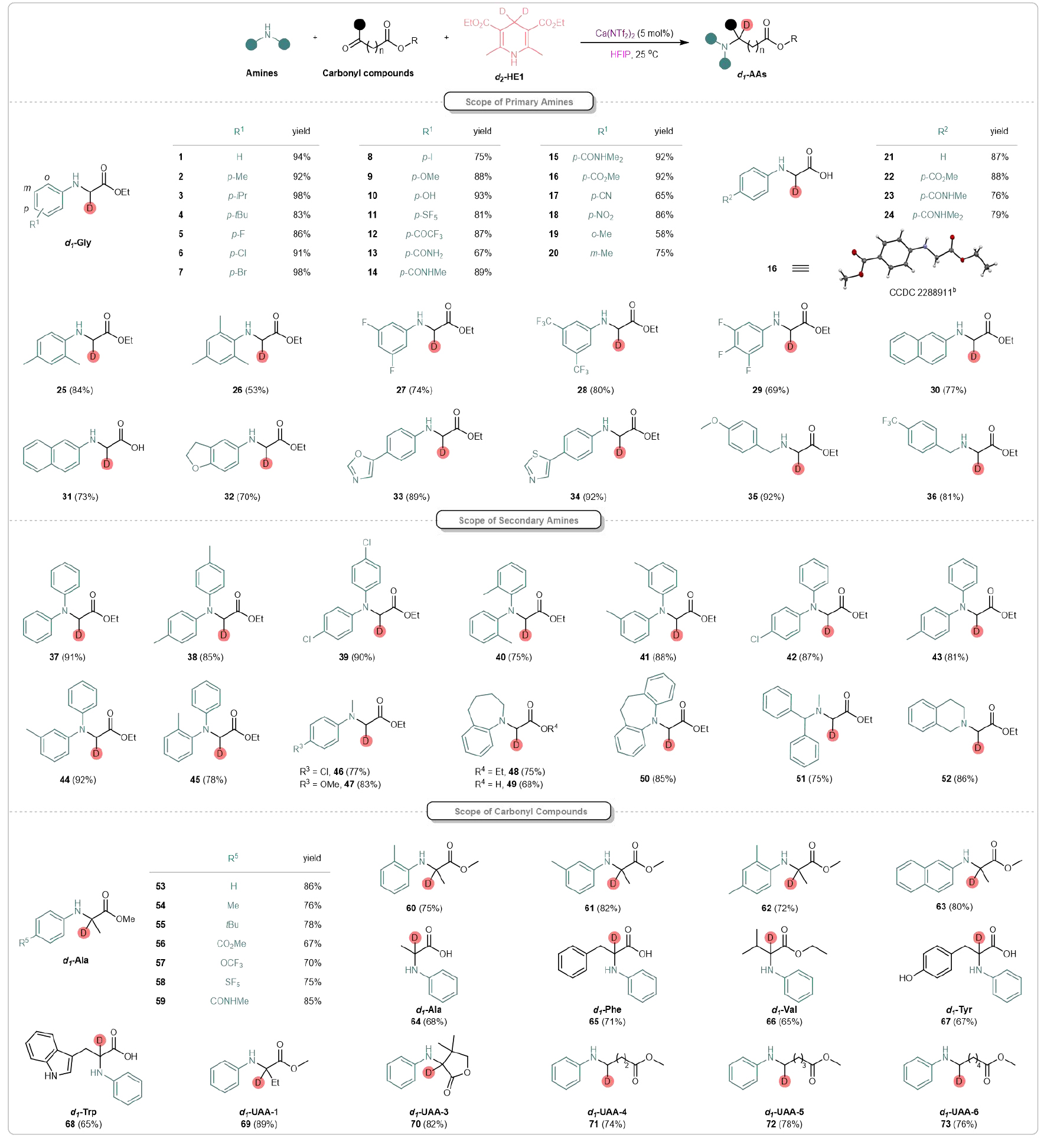
圖3. 氘代氨基酸及其衍生物的合成(來源:Nat. Commun)
該方法也適用于氘代多肽的合成(圖4)。首先,該研究團隊成功合成了一系列氘代的二肽衍生物(d1-Gly-Phe)(74-84)。83的結構通過X射線晶體學得到了確認。并且,該策略能夠完美保持原有骨架的手性。不同種類的氘代的二肽85-92成功合成,包含了如丙氨酸、異亮氨酸、酪氨酸、纈氨酸、苯丙氨酸和色氨酸等具有非極性側鏈的氨基酸,具有極性側鏈的絲氨酸,及具有堿性側鏈的賴氨酸等。該團隊進一步探討了增加鏈長對氘代肽類合成的影響,含有丙氨酸、苯丙氨酸、脯氨酸、甘氨酸和亮氨酸的氘標記三肽(95-98)可以在高產率下合成。并且,氨基酸如絲氨酸、酪氨酸、谷氨酸、脯氨酸、蛋氨酸和賴氨酸的親核殘基能夠與靶向共價抑制劑(TCIs)中存在的邁克爾受體型電親性靶點形成共價鍵,因此,這一合成潛力對于靶向共價藥物的發現具有重要價值。
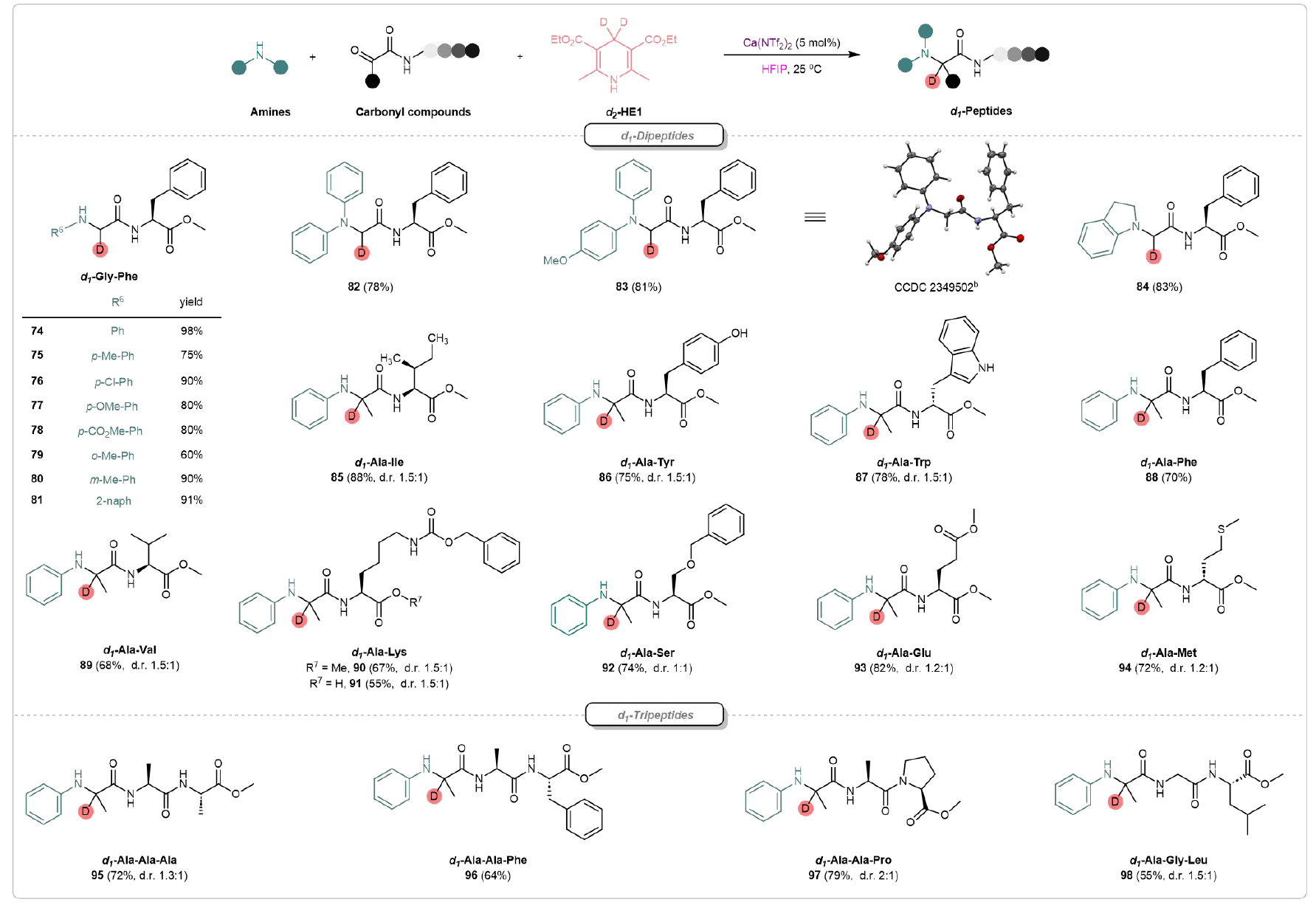
圖4. 氘代多肽的合成(來源:Nat. Commun)
復雜分子的后期功能化具有巨大的潛力,可以快速構建一系列新的藥物骨架。氨氯地平(Amlodipine)是一種鈣通道阻滯劑,廣泛用于臨床治療高血壓和冠狀動脈疾病。該團隊以其為底物,成功合成了相應的d1-氨氯地平-甘氨酸結合物(d1-Amlodipine-Gly)99(圖5)。隨后,底物普適性研究發現,磺胺甲噁唑(100)、苯佐卡因(101)、奧司他韋(102)、達普酮(103)、克唑替尼(104)、吲哚美辛(105)、氟比洛芬(106)、門布酮(107)、苯溴酸(108)、伊索替尼(109)、布洛芬(110)、吉非貝齊(111)、非布司他(112)等藥物分子都能兼容,得到相應的氘代氨基酸-藥物結合物。此外,天然產物如單甲基琥珀酸(113)、月桂酸(114)和吡啶丁酸(115)也能在該反應條件下順利反應,得到相應的產物,并具有良好的產率。
進一步研究發現,二肽與藥物骨架的連接反應也能高效進行,成功得到產物d1-Menbutone-Gly-Phe(116)和d1-Menbutone-Ala-Val(117)。值得注意的是,這些結果驗證了酰胺、鹵素、磺酰基、酯、酮以及雜環等官能團在該反應體系下都能保持穩定,未受到影響。毫無疑問,Ca(II)-HFIP介導的復雜分子后期修飾提供了一種高效且富有吸引力的策略,用于新化學實體的合成和潛在的藥物發現研究。
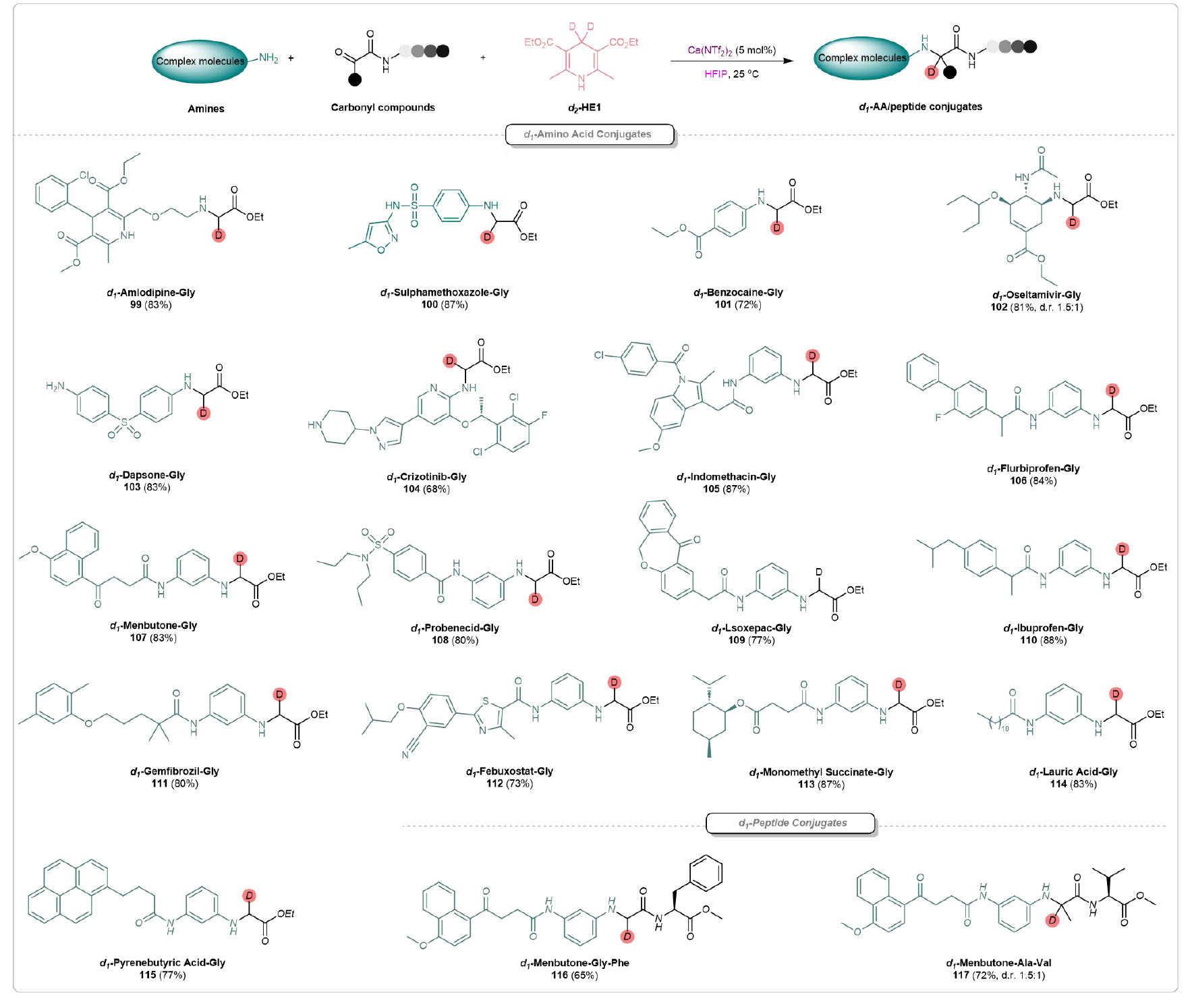
圖5. 復雜分子后期修飾(來源:Nat. Commun)
為了進一步研究氘標記引入化學實體是否能提高代謝穩定性,該團隊初步進行了人體微粒體代謝實驗,以評估代謝穩定性,選取68作為模型抗氧化化合物。在180分鐘的微粒體孵育后,殘留的68的量高于68-H。通過計算,68的半衰期也較68-H有所延長(68-H, t1/2 = 4.46 h;68, t1/2 = 5.91 h),這表明氘標記在氨基酸α位的引入明顯提高了代謝耐受性(見圖6a)。這些結果進一步證明了當前方法在促進氘標記氨基酸/肽類的位點選擇性合成方面的顯著價值。該方法的實用性通過成功的克級合成氘標記氨基酸1和d1-氨基酸結合物102(分別以90%和76%的產率)得到了進一步證明(見圖6b)。并且催化劑能夠回收利用(見圖6c)。
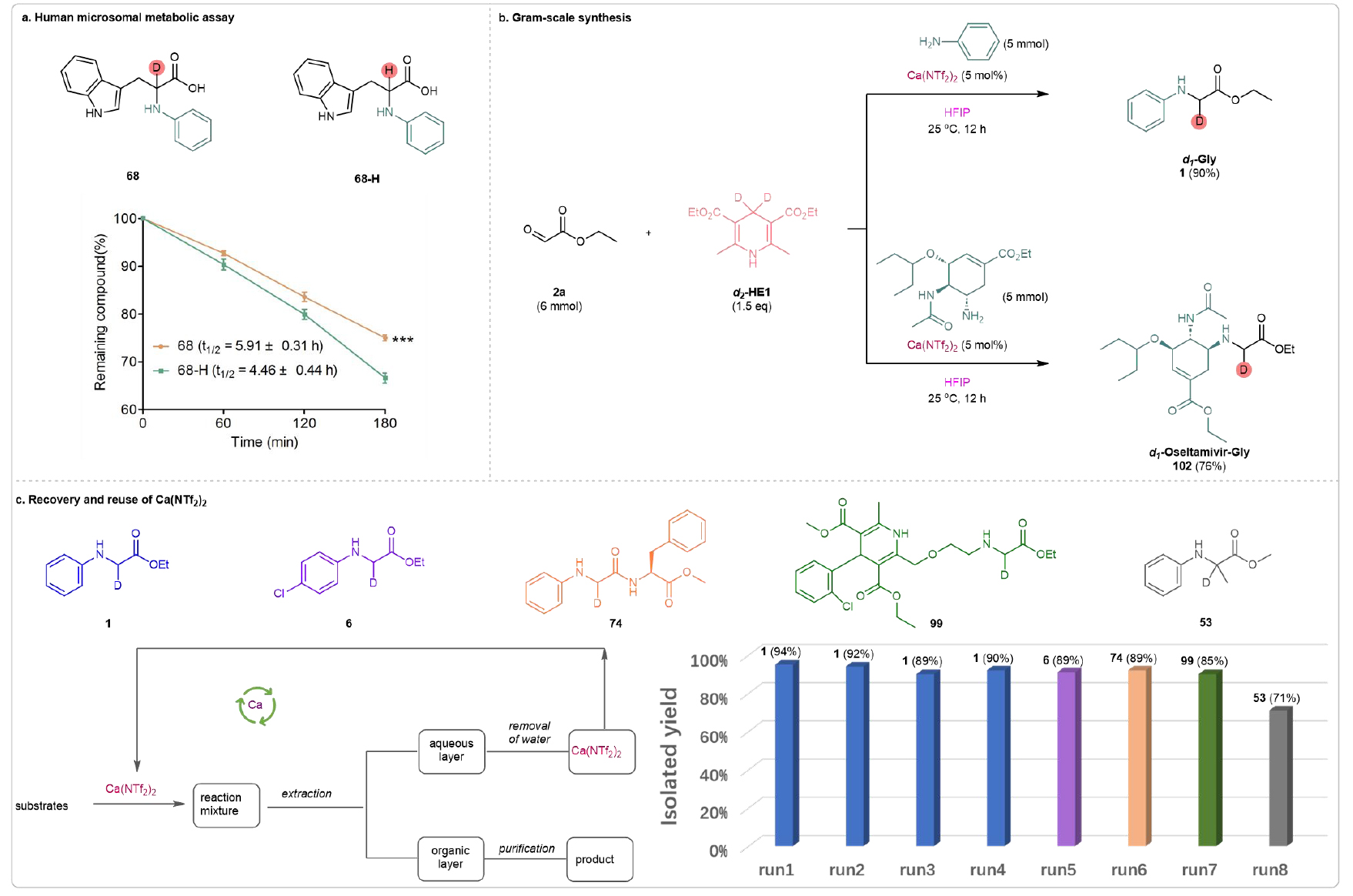
圖6. 代謝穩定性實驗及合成應用(來源:Nat. Commun)
為了更好地理解反應機理,該團隊進行了一系列對照實驗(見圖7a)。當加入自由基捕捉劑TEMPO時,反應依然順利進行,且產率未發生下降。AIBN是常用的自由基引發劑,但在標準條件下,使用AIBN并未提高反應產率。根據這些實驗,排除了自由基機制的可能性。隨后進行的氘代實驗表明,當使用d1-HE1或d2-HFIP時,未觀察到氘的引入,這表明產物中的氘來自于Hantzsch酯的4-D。因此,推測氘轉移反應可能遵循一種協同機制,類似于相關的氫轉移還原過程。在Hantzsch酯H-和D-Hantzsch酯的競爭反應中,觀察到了動力學同位素效應(kH/kD=4.8),這清楚地表明C-H鍵的斷裂是決速步。
基于以上結果,提出了一個可能的反應路徑,涉及Ca(II)-HFIP介導的還原氘代氨化的協同機制(見圖7b)。前的工作中,發現[Ca(NTf2)(HFIP)2]+,其中兩個HFIP分子與鈣離子配位,是最活躍的簇。對于具有O和N原子作為錨點的底物,通過Ca–O配位鍵和一個HFIP配體的N–H氫鍵形成螯合。第二個HFIP配體通過F–Ca和O–H鍵穩定該復合物。在當前情況下,這種配合物會生成物種A。隨后,d2-HE1對亞胺進行氘化,生成目標產物。最后,通過C的質子轉移再生催化劑,同時釋放D(通過NMR分析確認)作為副產物。為了驗證這一假設,我們首先進行了酸度研究,采用Child方法。將HFIP(2 eq)與Ca(NTf2)2結合,導致Hβ在7.26 ppm處出現最大化學位移變化(見圖7c)。這些結果驗證了Ca(II)-HFIP介導系統增強酸性的假設。同時,該團隊借助DFT理論計算,使用M06-2X/6-31+G(d,p)(SMD)計算了甲基(E)-2-(苯基亞胺)乙酸酯、1,4-二氫-2,6-二甲基-3,5-吡啶二甲酸二甲酯和上述復合物[Ca(NTf2)(HFIP)2]+(見圖7d)。如上所述的亞胺乙酸酯的激活確實使得Hantzsch酯的氫化物和HFIP的質子能夠同時轉移,并且自由能為16.7 kcal/mol,這一步驟的反應釋放了17.2 kcal/mol的能量。
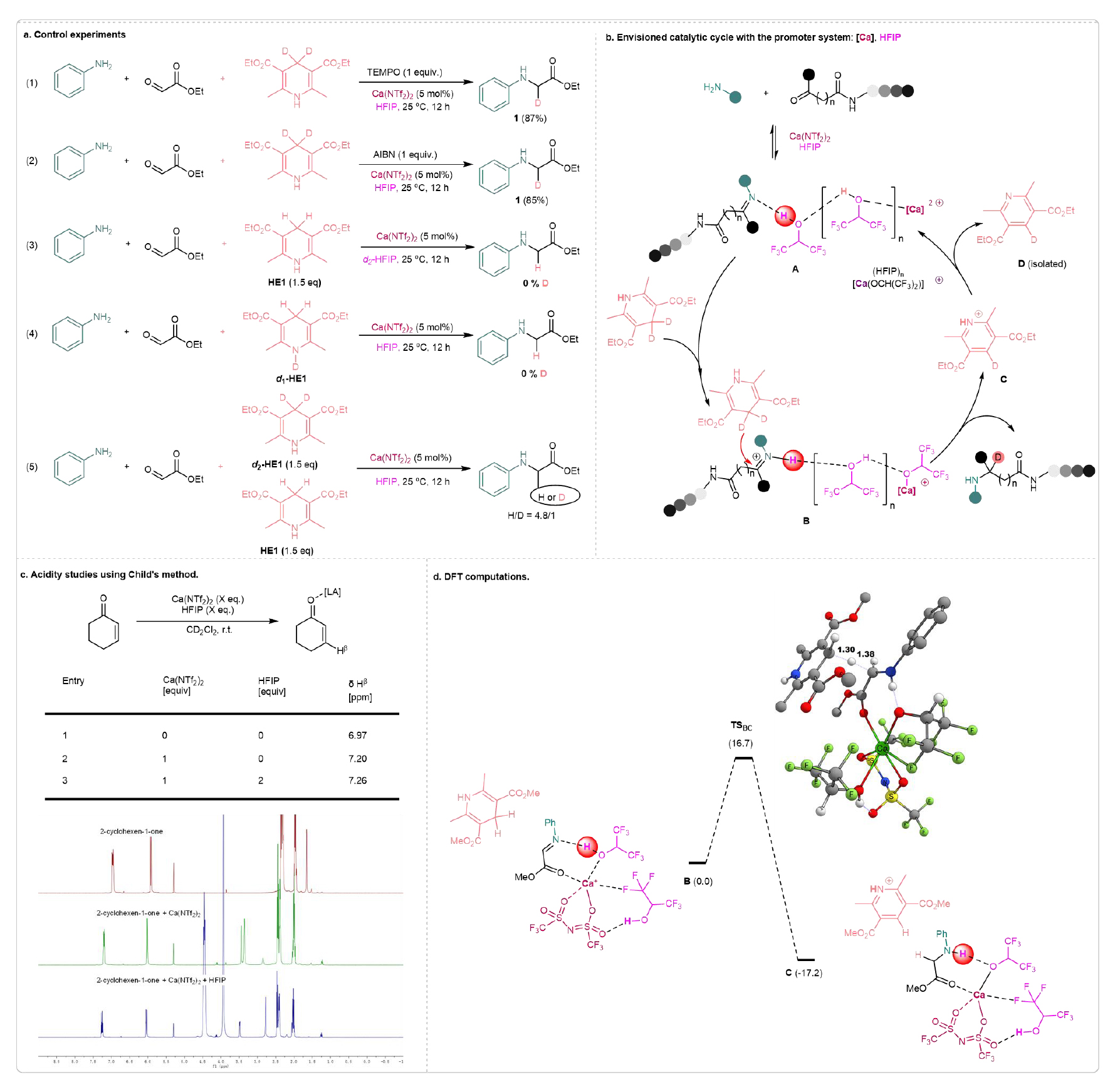
圖7. 機理研究(來源:Nat. Commun)
1992年,Lerner和Brenner提出了DNA編碼庫(DEL)技術,這是一項將化學與生物學無縫結合的革命性技術,在藥物發現領域具有重要意義。DEL通常通過多輪酶促DNA條形碼和DNA兼容化學反應構建。因此,推動DNA兼容反應的進展是DEL研究領域中的關鍵挑戰之一,極具挑戰。該團隊成功將開發的策略應用于DNA兼容的還原氘代胺化反應。通過合理設計,該團隊成功合成了多種DNA連接的d1-氨基酸/肽。正如圖8a所示,DNA連接的胺HP-1與不同的羰基化合物反應,成功生成了目標DNA-d1-AA連接物(118)、DNA-d1-UAA連接物(119-121)和DNA-d1-肽連接物(122)。值得一提的是,氨基苯環上取代基的位置對反應結果沒有顯著影響,尤其是meta取代的胺具有良好的兼容性,能夠生成所需的DNA連接物123-127,轉化率為44-95%。為了進一步探討該DNA上還原氘化胺化反應的普適性,我們合成了長鏈DNA連接的胺HP-2和HP-3,結果證明這些胺在與多種羰基化合物反應時,能夠得到所需的DNA連接的d1-AA/UAA/肽,轉化率為中等至良好(128-137)。
如前所述,Ca(II)-HFIP介導的DNA上還原氘代胺化能夠構建所需的DNA連接的d1-氨基酸,且具有附加的錨定–羧基。這一特性將促進它們在多樣性導向合成中的應用。為了全面評估該方法在化學分岐合成中的潛在應用,該團隊在DEL中調查了DNA-d1-復雜分子連接物的DNA上合成潛力。如圖8b所示,Ca(II)-HFIP介導的DNA連接胺(HP-1)與羰基底物的還原氘化胺化反應順利進行,得到DNA連接的d1-氨基酸(118),該產物在進一步與各種胺通過經典的酰胺化反應后,成功得到所需的DNA連接的d1-復雜分子(138和139),產率達到合成上有用的水平。這些結果證明了所開發策略的兼容性,并突出了其在DEL構建中的巨大潛力。
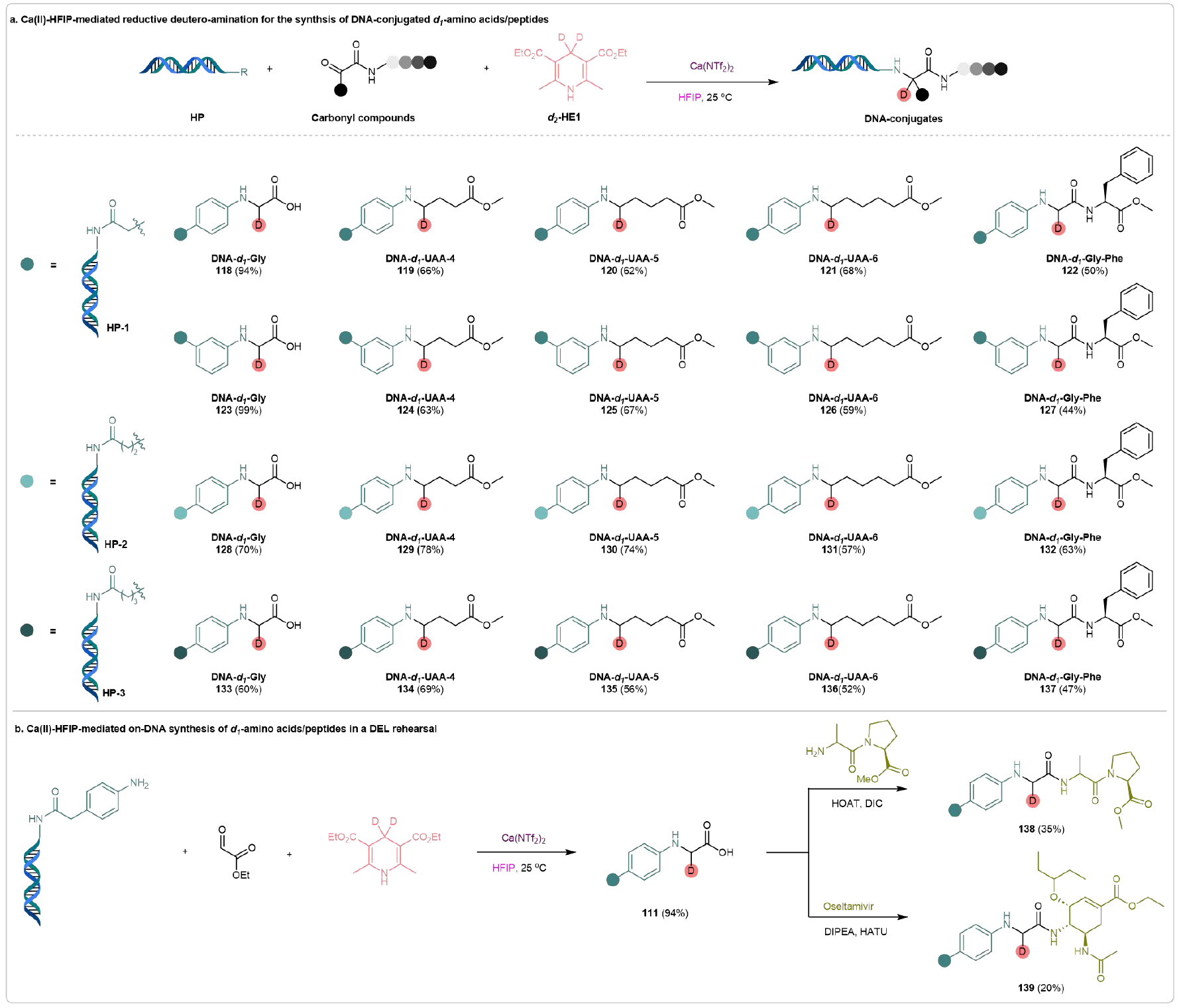
圖8. DNA偶聯d1-氨基酸/肽的合成及其多樣化轉化(來源:Nat. Commun)
總結
該團隊報道了一種通過仿生還原氘代胺化反應,直接合成氘代氨基酸/肽的方法。該方法利用地球豐度且環保的鈣基催化劑,在HFIP中以仿生d2-Hantzsch酯作為氘源,成功地實現了簡單酮酯與胺類的氘化反應。該策略具有溫和的反應條件、高產率、良好的底物適應性、優異的氘代水平以及α-位置至N-雜原子的位點選擇性氘化特點。催化劑的高水溶性使得其能夠被輕松回收,支持多次循環使用,充分體現了該協議的高效性和可持續性。通過其在克級合成和藥物分子及天然產物的后期氘化中的應用,已證明了該方法的實用性和穩健性。此外,所開發的氘標記策略在提高代謝穩定性方面也展現了其功能性。最后,鈣催化劑已成功應用于DNA編碼庫合成,實現了DNA標記的氘代氨基酸/肽/藥物的合成,這一進展展示了在合成氘代DNA編碼庫(dDEL)方面的巨大潛力,有望高效探索超大規模的氘代化學空間。
王勝東,教授、廣東省“珠江人才計劃”青年拔尖人才。2018年獲得雷恩第一大學博士學位;隨后于巴黎薩克雷大學從事博士后研究;2021年以南山學者特聘教授加入廣州醫科大學藥學院。研究興趣為綠色藥物合成策略的設計與開發、廉價金屬催化的有機方法學研究;以第一/通訊作者在Angew. Chem. Int. Ed.、Nat. Commun.、ACS Catal.、ChemSusChem、Org. Lett.等著名期刊上發表論文二十余篇。
易偉,呼吸疾病國家重點實驗室教授、廣州醫科大學藥學院副院長(分管科研);博士生導師、南山學者杰出人才、廣東省杰青、廣州市嶺南英杰;中科院青年創新促進會會員、中國藥學會會員、中國藥理學會會員、中國化學會會員。主要從事以結構為基礎、功能為導向的創新藥物設計與發現。迄今在Nature、Cell Res.、Chem、Angew. Chem. Int. Ed.、Adv. Sci.、ACS Catal.、Chem. Sci.、PNAS、APSB等國際著名期刊上已發表研究論文100余篇,總他引率4000余次,h指數大于40。申請國內外發明專利10余項(包括美國專利一項、PCT五項),其中部分已成功轉讓,總金額近800萬美元。
許紅濤,上海科技大學免疫化學研究所副研究員。研究工作聚焦于藥物化學生物學領域的基礎和應用研究,在DNA編碼化合物庫(DEL)的構建與篩選,生物大分子的選擇性修飾和工程化免疫細胞等方面積累了豐富的研究經驗。迄今在Angew. Chem. Int. Ed.、Nat. Commun.、Chem、Adv. Sci.、ACS Catal.、APSB等國際著名期刊上已發表研究論文100余篇。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn