

正文
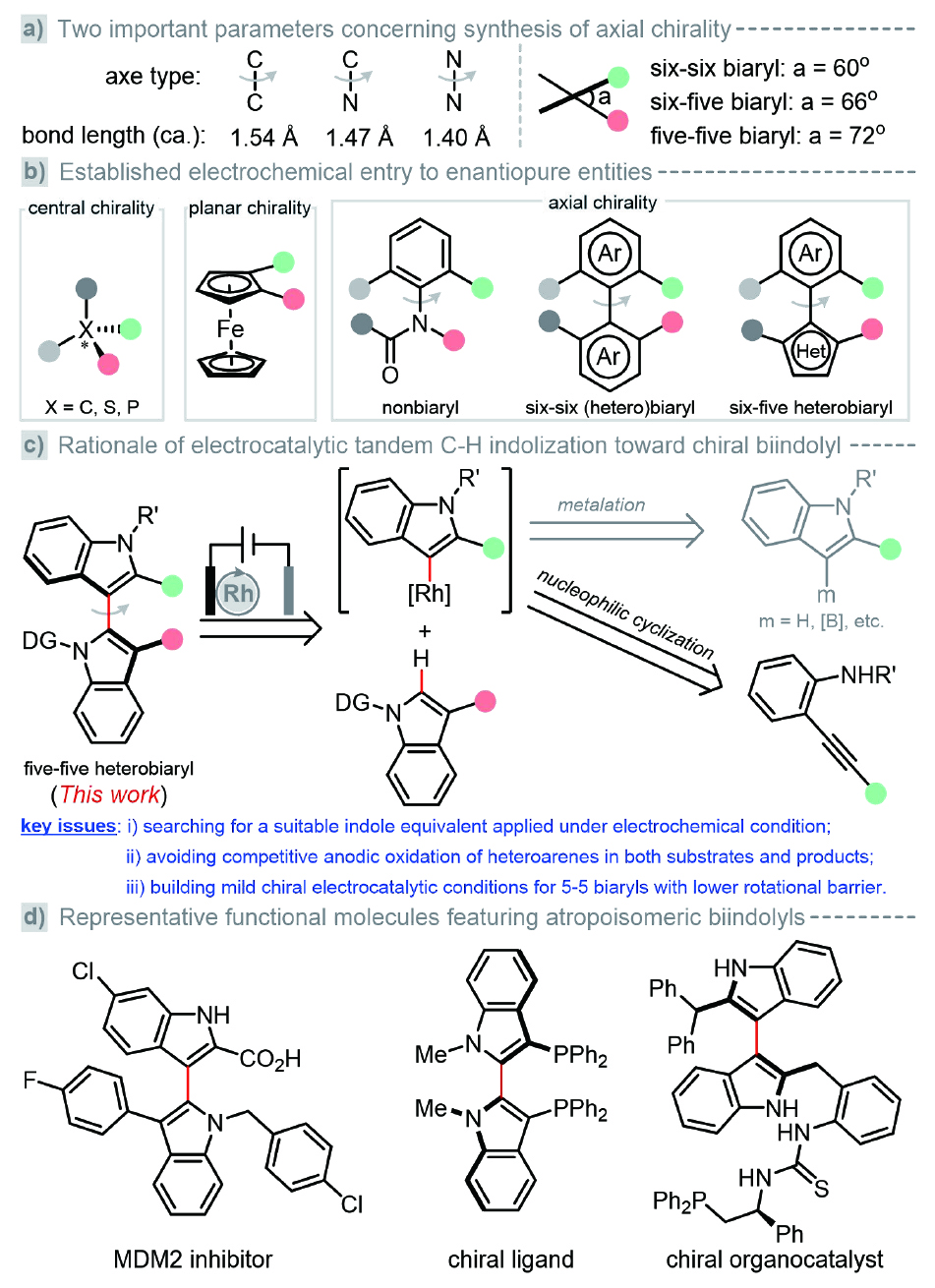
圖1. 電催化不對稱C?H功能化的研究背景及意義
針對上述轉化瓶頸,基于課題組前期在電化學C?H官能化方面的工作積累(Nat. Commun. 2024, 15, 7428; Green Chem. 2024, 26, 11524; ACS Catal. 2021, 11, 6626),并鑒于雙吲哚軸向手性異構體在化學、醫藥及材料科學中所扮演的重要角色。近日,廣州醫科大學藥學院曾中一教授聯合高輝、易偉教授發展了綠色溫和的電催化對映選擇性串聯C?H吲哚化反應,以精準構筑雙吲哚軸向手性骨架。該方案以N-磺酰基-2-炔基苯胺作為電化學兼容的吲哚等價體,無需額外添加化學氧化劑、且氫氣作為唯一副產物;通過融合實驗與密度泛函理論(DFT)計算進一步探究反應機制,揭示反應涉及Rh(III)?Rh(I)?Rh(III)催化循環且還原消除為反應的決速步驟及對映選擇性的決定步驟,為后續不對稱電催化串聯反應的設計與開發提供了重要參考。該成果于近期發表于《ACS Catalysis》 (DOI: 10.1021/acscatal.4c06594),廣州醫科大學為唯一完成單位。
為了驗證這一設想,作者首先選取N-甲苯磺酰基-2-炔基苯胺(2a)作為吲哚等價體(圖2),經過大量優化得到最優條件:5 mol% [Cp*RhCl?]?作為催化劑,nBu4NOAc作為電解質和堿,等體積比的MeOH/CHCl3作為混合溶劑,帶有兩根石墨氈(GF)電極的未分隔電解池在室溫下以2.0 mA恒電流電解6 h。在N-配位輔助下,多種(雜)芳烴可順利進行電催化串聯C?H吲哚化反應,為構建聯芳基骨架提供了統一且模塊化的方法,包括雙吲哚化合物(3, 4)、噻吩-吲哚類化合物(5)及芳基-吲哚類化合物(6?11);此外,烯基C?H鍵也能發生吲哚化反應(12)。
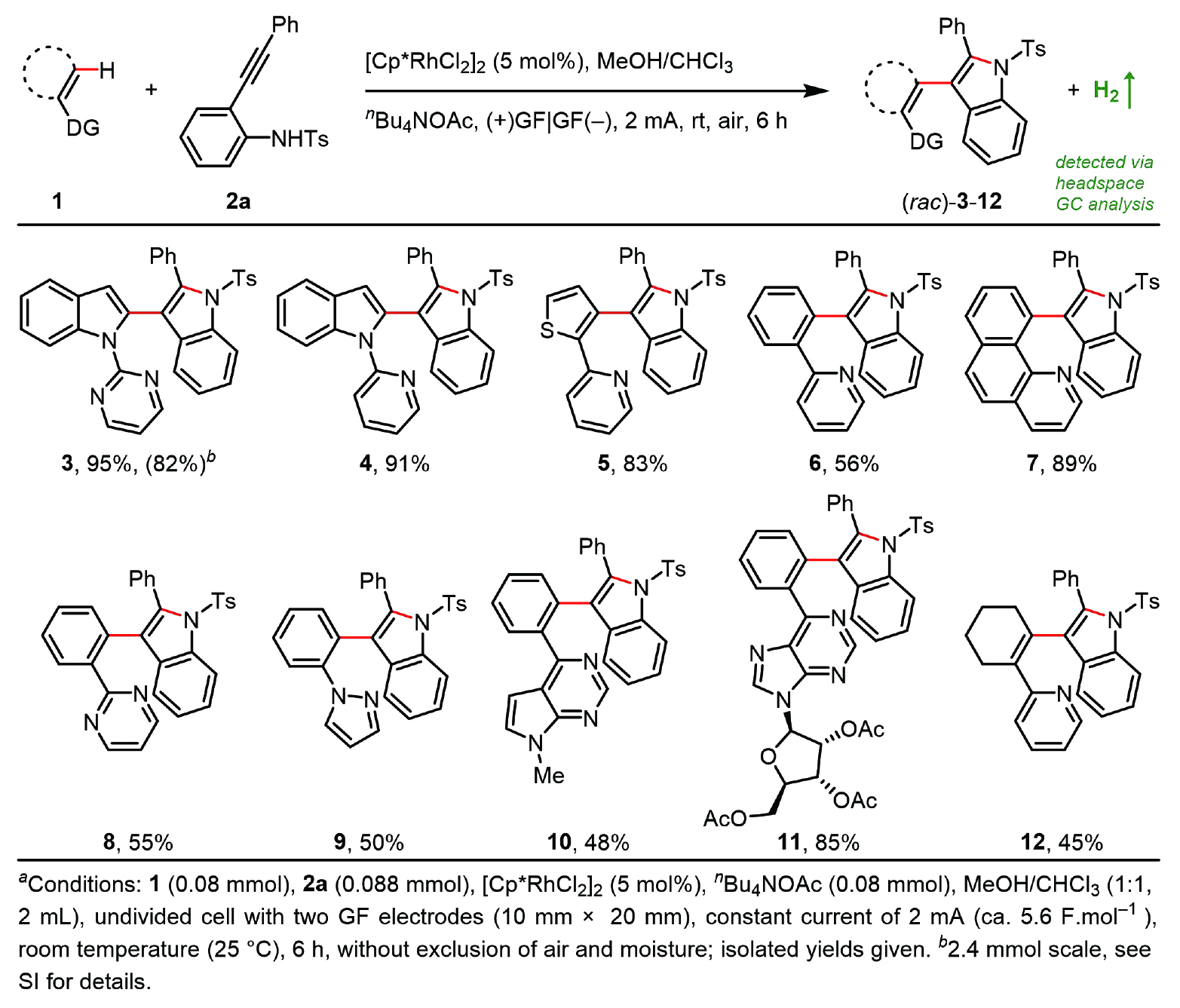
圖2. 電催化串聯C?H吲哚化的底物考察
在證明N-磺酰基-2-炔基苯胺可作為電化學兼容的吲哚等價體后,作者進一步探索反應的不對稱版本。為此,他們選取3-乙基吲哚1k與N-甲苯磺酰基-2-炔基苯胺2a作為對映選擇性反應的模板底物;在上述消旋版本的基礎上篩選并得到最終反應條件:5 mol% (R)-Rh1作為催化劑,nBu4NOAc作為電解質和堿,等體積比的MeOH/CHCl3作為混合溶劑,1-AdCO2H作為添加劑,帶有GF陽極和石墨(C)陰極的未分隔電解池在室溫下以2.0 mA恒電流電解6 h。在最優條件下,作者隨后探究反應的普適性(圖3)。末端為伯烷基(22?24)、仲烷基(25)、取代苯基(13 - 20)及雜芳基(21)的炔烴均能順利進行反應,以優異的對映選擇性和良好的產率得到相應的雙吲哚手性產物;同時該策略也廣泛適用于氮原子上帶有芳基(26?28)、烯基(29)和脂肪族(30)磺酰基的多種2-苯乙炔基苯胺底物。除乙基外,吲哚C3位的取代基還可拓展至正丁基(31)、芐基(32)和苯基(33);常見官能團,如氯(24)、溴(14)、硅基(15)、乙酰基(16)、三氟甲基(17)、三氟甲氧基(18)、酯基(19,23)、硝基(20)、噻吩基(21)和環丙基(25)都能很好地兼容。在2-嘧啶導向基的C5位引入甲基取代基也是可行的(34)。此外,異構的4-嘧啶基和2 -吡啶基被證明是有效的導向基團(35, 36);該電化學方法能使苯并喹啉也高效發生C?H吲哚化反應,盡管對映選擇性中等(37)。值得一提的是,以化合物3和13的放大合成為例,所開發的消旋和不對稱的電氧化偶聯反應均易于放大。
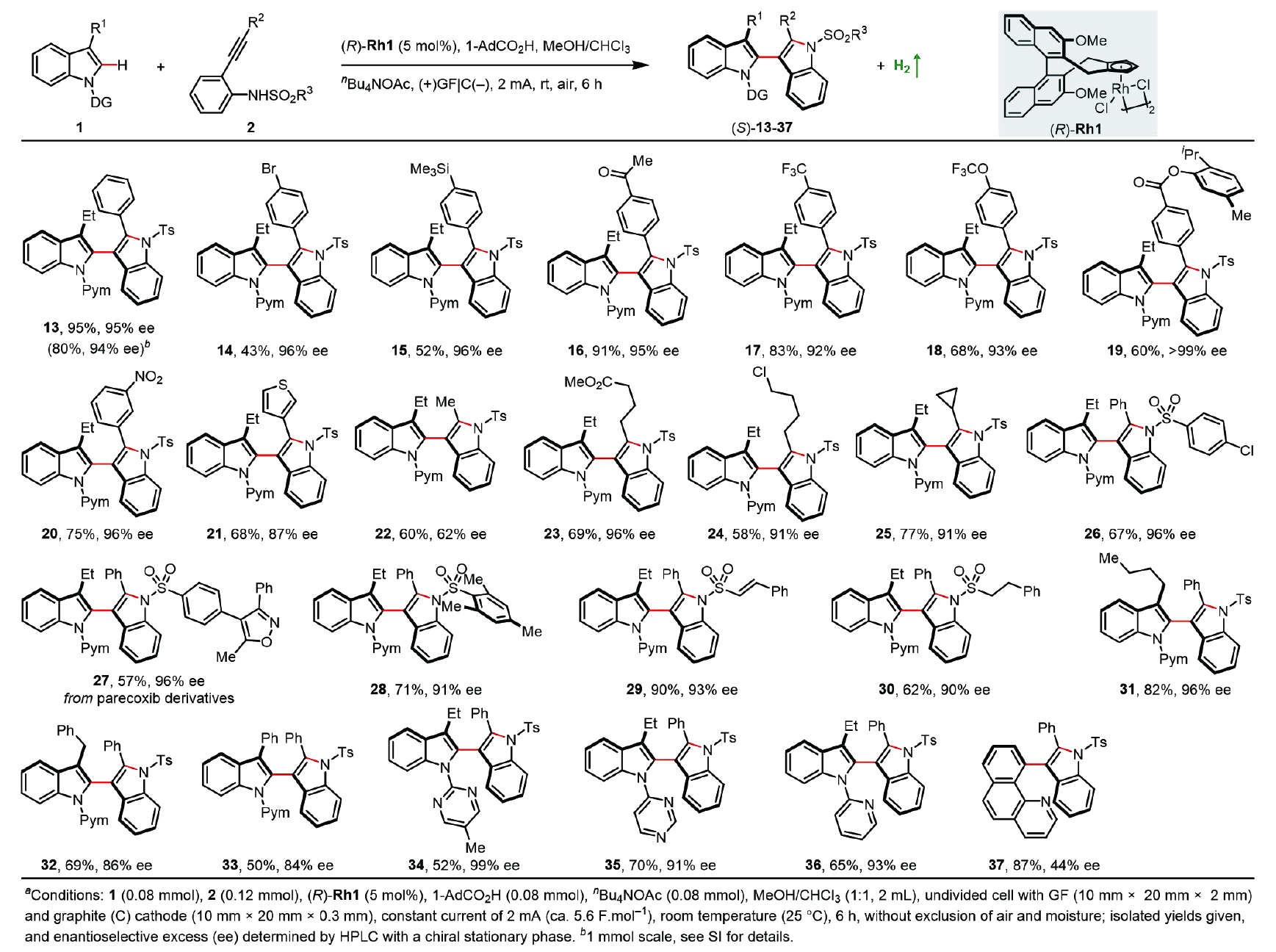
圖3. 電催化不對稱串聯C?H吲哚化反應的底物考察
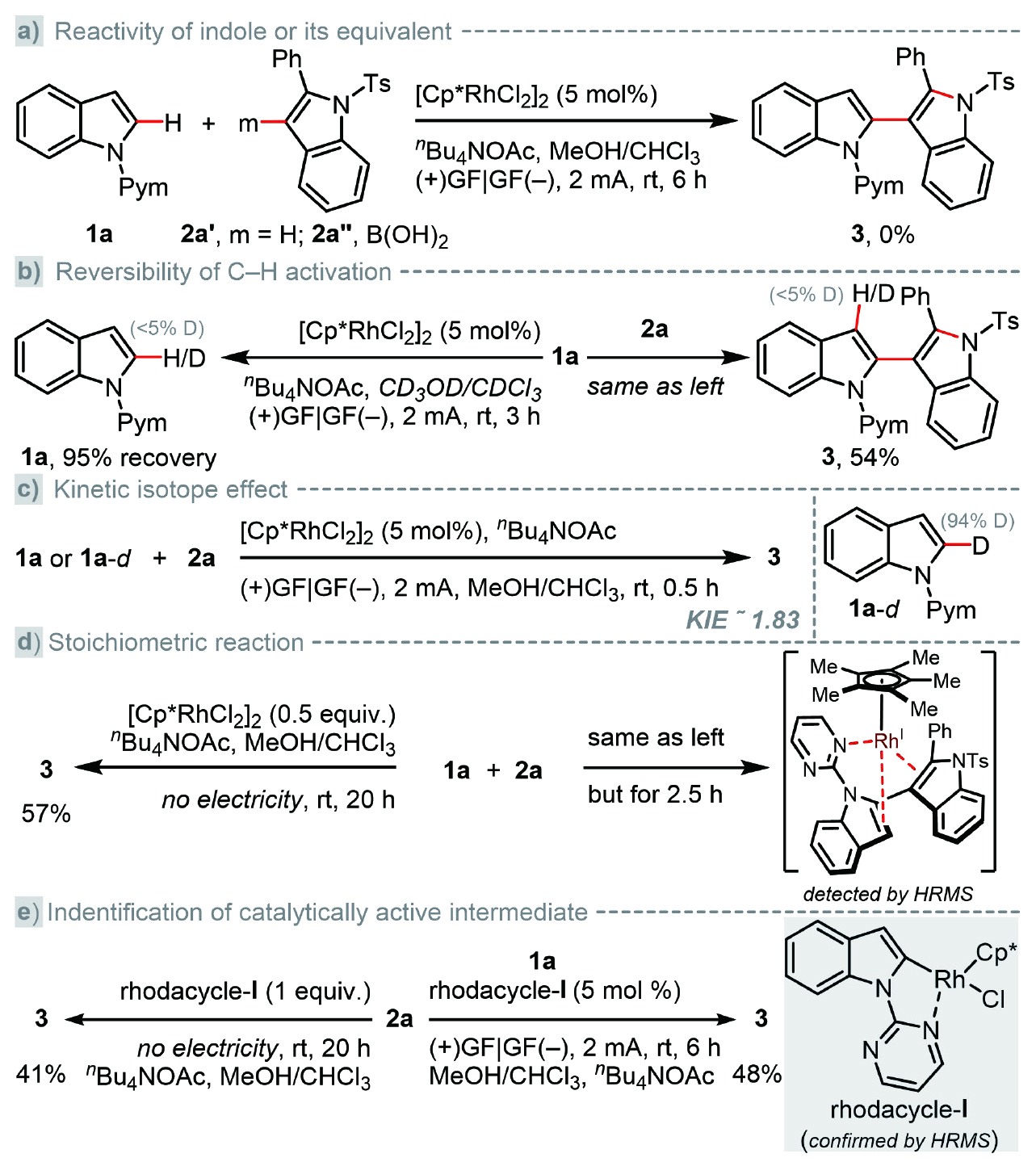
為了深入理解反應機理,作者首先開展了系列實驗。相應的C3位未取代/硼酯化吲哚均無法實現同樣的吲哚化反應,從而排除了質子化吲哚參與反應的可能性(圖4a);無論2-炔基苯胺存在與否,在CD?OD/CDCl?中均未能觀察到H/D交換,這表明C?H金屬化步驟是不可逆的(圖4b);動力學同位素實驗得出KIE值為1.83(圖4c),揭示C?H鍵斷裂可能未涉及決速步驟,這與其DFT計算結果相符;未通電條件下,產物產率與銠催化劑的量對應,以化學計量[CpRhCl?]?進行反應時所得產率為57%(圖4d,左),同時縮短反應時間能檢測到雙吲哚配位的Cp*Rh(I)配合物(圖4d,右),這意味著反應不經歷高價銠中間體[如Rh(IV)或Rh(V)];使用化學計量或催化量的銠環中間體I均可獲得中等產率,這清楚地表明其參與到該催化轉化過程中(圖4e)。
隨后,作者進行了詳細的DFT計算(圖5a)。選取活性催化劑Cp*Rh(OAc)?為起點,2-炔基苯胺2a先經歷去質子化,再經過分子內親核環化,經歷過渡態TS-1b生成INT-4b這一過程,因具有相當高的能壘(ΔG≠ = 42.9 kcal/mol)而被排除。相比之下,Rh(III)介導、OAc?輔助的歷經過渡態TS1的C?H鍵斷裂/金屬化過程,其自由能僅為15.4 kcal/mol,生成五元銠環中間體INT3;該陽離子銠物種作為Lewis酸協助與炔烴配位,并與2-炔基苯胺2a經過渡態TS2發生親核環化(ΔG≠ = 23.2 kcal/mol),得到雙吲哚金屬物種INT6。由于空間位阻效應,發生還原消除反應形成吲哚配位的Cp*Rh(I)需要較高自由能(26.8 kcal/mol,TS3);基于此,作者推測該電化學反應的決速步驟(RDS)是還原消除,而非C?H活化步驟。最后,在HOAc存在下,電化學促使Rh(I)氧化為活性Rh (III)催化劑,同時釋放產物和氫氣。此外,作者進一步對比了產生不同對映體所涉及的兩個關鍵過渡態TS3S和 TS3R之間的能量差;DFT計算表明,TS3S的自由能比TS3R低 2.4 kcal/mol,對應的模擬ee值> 95%(圖5b)。這一結果與其實驗觀察高度吻合,即實驗所得的(S)-構型產物具有優異的對映選擇性。
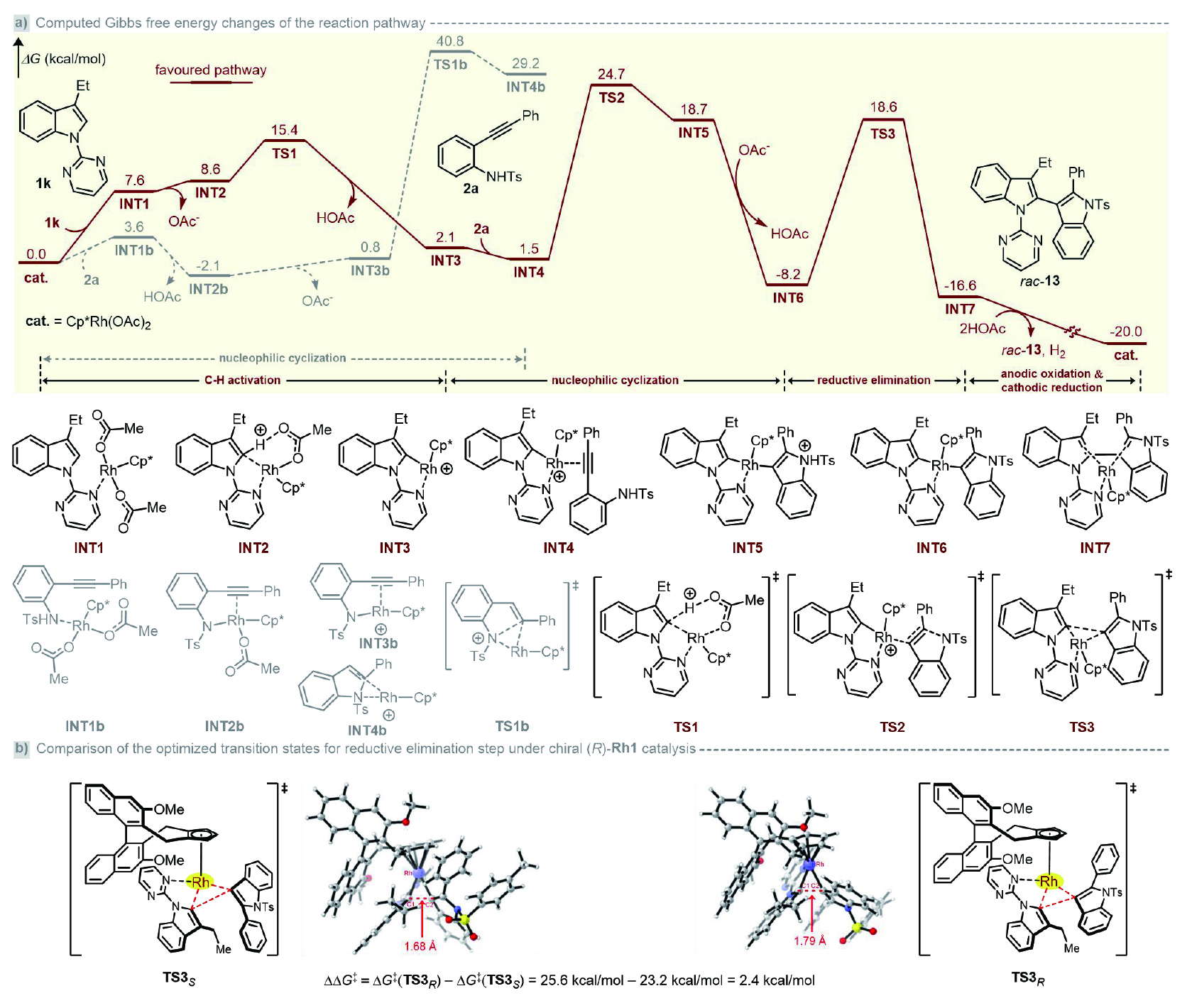
圖5. DFT計算
基于上述實驗結果,作者提出了一種合理的催化循環(圖6)。起初,[CpxRhCl?]?與nBu?NOAc或1-AdCO?H發生陰離子配體交換,生成手性催化劑CpxRhX?;該催化劑在堿的輔助下與3-乙基吲哚1k發生不可逆的C?H活化,形成五元銠環中間體B;隨后與2-炔基苯胺2a進行配位進而發生親核環化反應,生成雙吲哚銠物種D,D再經還原消除產生雙吲哚配位的CpxRh(I)配合物;最后歷經陽極氧化再生活性Rh(III)催化劑,同時生成具有軸向手性產物13;在陰極表面則釋放出氫氣副產物。
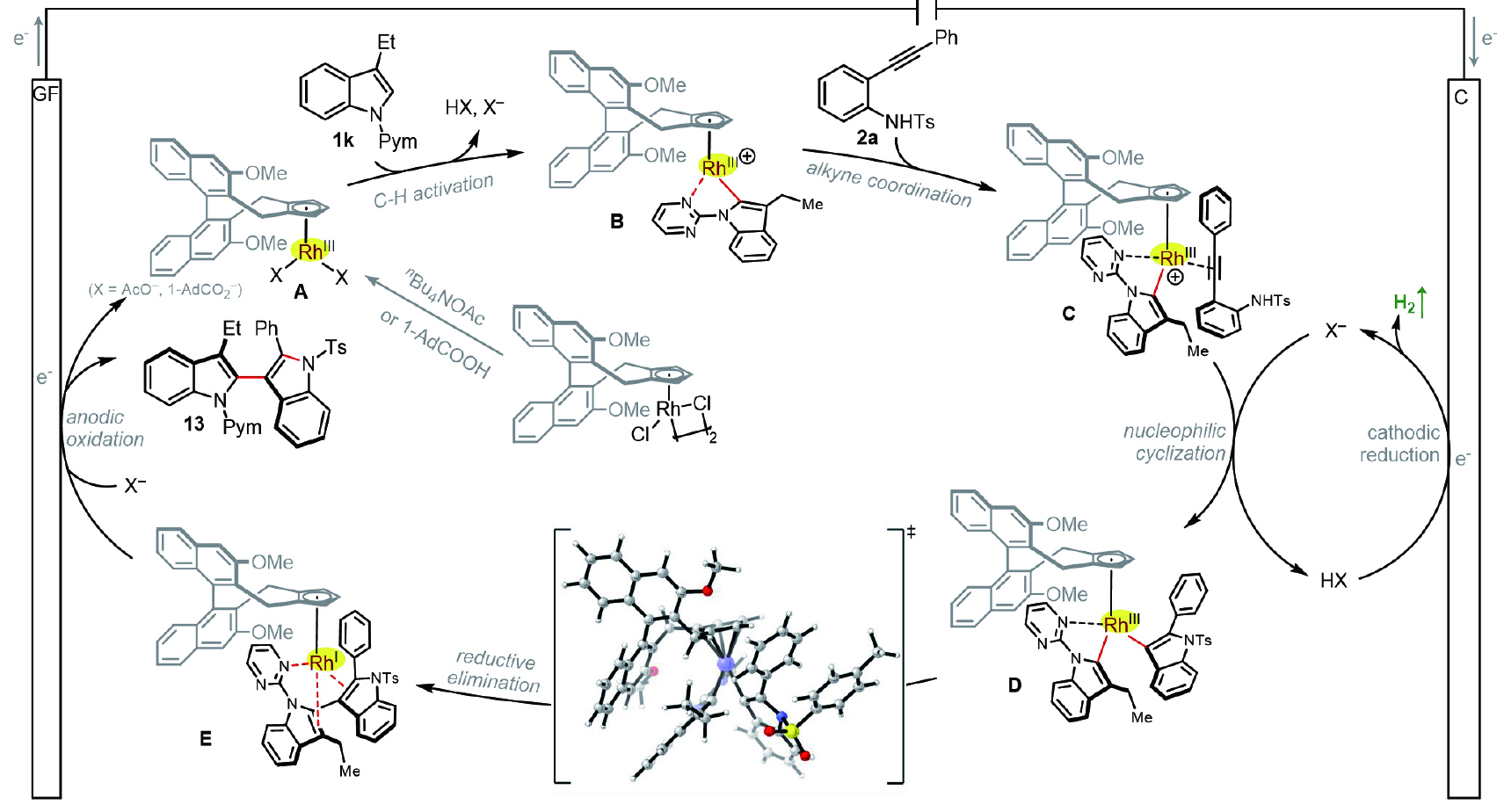
圖6. 可能的反應機制
導師簡介

曾中一,教授、廣東省重大人才青年項目(教育廳)。2018年獲得德國海德堡大學博士學位;隨后分別于瑞士蘇黎世大學和德國波鴻魯爾大學從事博士后研究;2021年底以南山學者特聘教授加入廣州醫科大學藥學院。主持國家自然科學基金、省市級科研項目多項。研究興趣為含氮雜環類藥骨架的設計、綠色合成及其藥學應用;以第一/通訊作者在Angew. Chem. Int. Ed.、Nat. Commun.、ACS Catal.、Coord. Chem. Rev.、Green Chem.等著名期刊上發表論文二十余篇。

易偉,呼吸疾病國家重點實驗室教授、廣州醫科大學藥學院副院長(分管科研);博士生導師、南山學者杰出人才、廣東省杰青、廣州市嶺南英杰;中科院青年創新促進會會員、中國藥學會會員、中國藥理學會會員、中國化學會會員。主要從事以結構為基礎、功能為導向的創新藥物設計與發現。迄今在Nature、Cell Res.、Chem、Angew. Chem. Int. Ed.、Adv. Sci.、ACS Catal.、Chem. Sci.、PNAS、APSB等國際著名期刊上已發表研究論文100余篇,總他引率4000余次,h指數大于40。申請國內外發明專利10余項(包括美國專利一項、PCT五項),其中部分已成功轉讓,總金額近800萬美元。

高輝,廣州醫科大學研究員、“南山學者”教授,博士生導師,廣州市高層次人才,廣東省藥理學會科學普及專業委員會委員、廣東省生物醫學工程學會藥品食品智能制造工程分會委員,主要從事藥物合成反應機制研究、計算加速藥物設計以及人工智能藥學的研究。發表SCI論文80余篇,其中以第一作者或通訊作者(含并列)在J. Am. Chem. Soc., Angew. Chem. Int. Ed., ACS Catal.等國際著名期刊上發表論文30篇(其中IF>10的論文8篇);主持國家自然科學基金、廣東省自然科學基金(3項)等。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn