




正文
將來源豐富的苯環(huán)骨架還原為稀缺的C(sp3)在藥物設(shè)計(jì)中具有重要的價(jià)值,因?yàn)樗幬锓肿拥?/span>C(sp3)含量有助于臨床上的成功。環(huán)己烯是一類重要的結(jié)構(gòu)骨架,且對重芳構(gòu)化穩(wěn)定。利用其可以快速地進(jìn)行一系列轉(zhuǎn)化,形成具有大量化合物的產(chǎn)物庫。然而,利用苯的部分還原來合成環(huán)己烯卻非常少見,而且底物范圍具有局限性。最近,德國波鴻魯爾大學(xué)Mario P. Wiesenfeldt課題組發(fā)展了利用有機(jī)催化將缺電子苯轉(zhuǎn)化為環(huán)己烯的普適性方法,并對路易斯堿性基團(tuán)以及可還原基團(tuán)具有良好的兼容性(Figure 1)。歡迎下載化學(xué)加APP到手機(jī)桌面,合成化學(xué)產(chǎn)業(yè)資源聚合服務(wù)平臺(tái)。
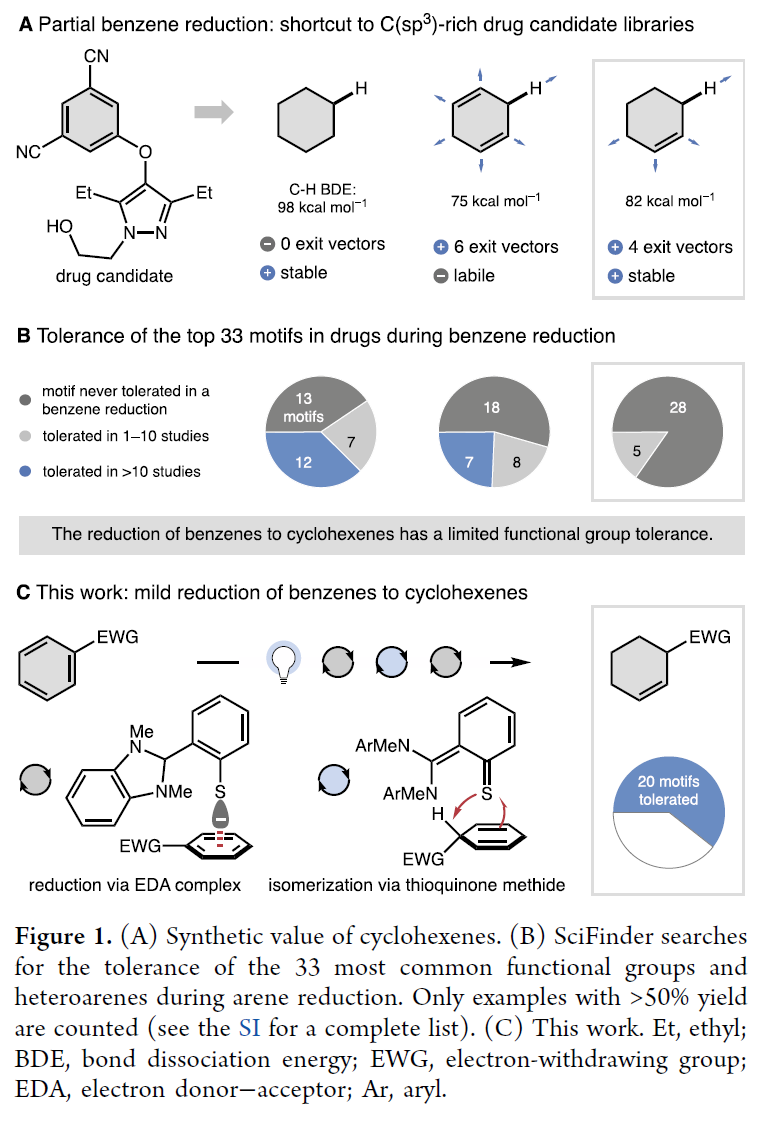
(圖片來源:J. Am. Chem. Soc.)
作者認(rèn)為此轉(zhuǎn)化起始于EDA絡(luò)合物5的激發(fā)形成自由基離子對6(Figure 2A)。隨后通過質(zhì)子轉(zhuǎn)移得到高度穩(wěn)定的自由基7和環(huán)己二烯基自由基8。7[半波還原電位E1/2red(7/9) < ?2.3 V vs飽和甘汞電極(SCE)在CH3CN中]的高還原能力是由α-氮的陽離子穩(wěn)定和強(qiáng)給電子的o-硫化物(σp(S-) = ?1.2)產(chǎn)生的,它可以使8還原為陰離子11,并與氧化的給體9一起經(jīng)歷質(zhì)子化生成環(huán)己二烯2。該化合物應(yīng)同時(shí)具有兩性離子和甲硫醌的性質(zhì),并可以被還原劑還原為10。9也可以激發(fā)形成12,使其能夠攫取2中的雙烯丙基C-H鍵(1,4-環(huán)己二烯的BDE = 75 kcal mol-1),催化異構(gòu)化形成更穩(wěn)定的1,3-二烯3(1,3-環(huán)己二烯的BDE = 79 kcal mol-1)。最后,缺電子的二烯3可以很容易被還原成環(huán)己烯4來完成催化循環(huán)。
通過一系列條件優(yōu)化,作者得出廉價(jià)的商品化學(xué)品雕白粉(Rongalite)是具有匹配兩個(gè)催化循環(huán)速率的獨(dú)特能力的(Figure 2B)。在所測試的前體中,只有使用在活性供體中同時(shí)含有硫代酚酸酯和DHBI的前體9時(shí)得到了大量的環(huán)己烯4。且在最佳條件下可以以96:4的區(qū)域異構(gòu)體比(rr)和97%的收率得到環(huán)己烯4。
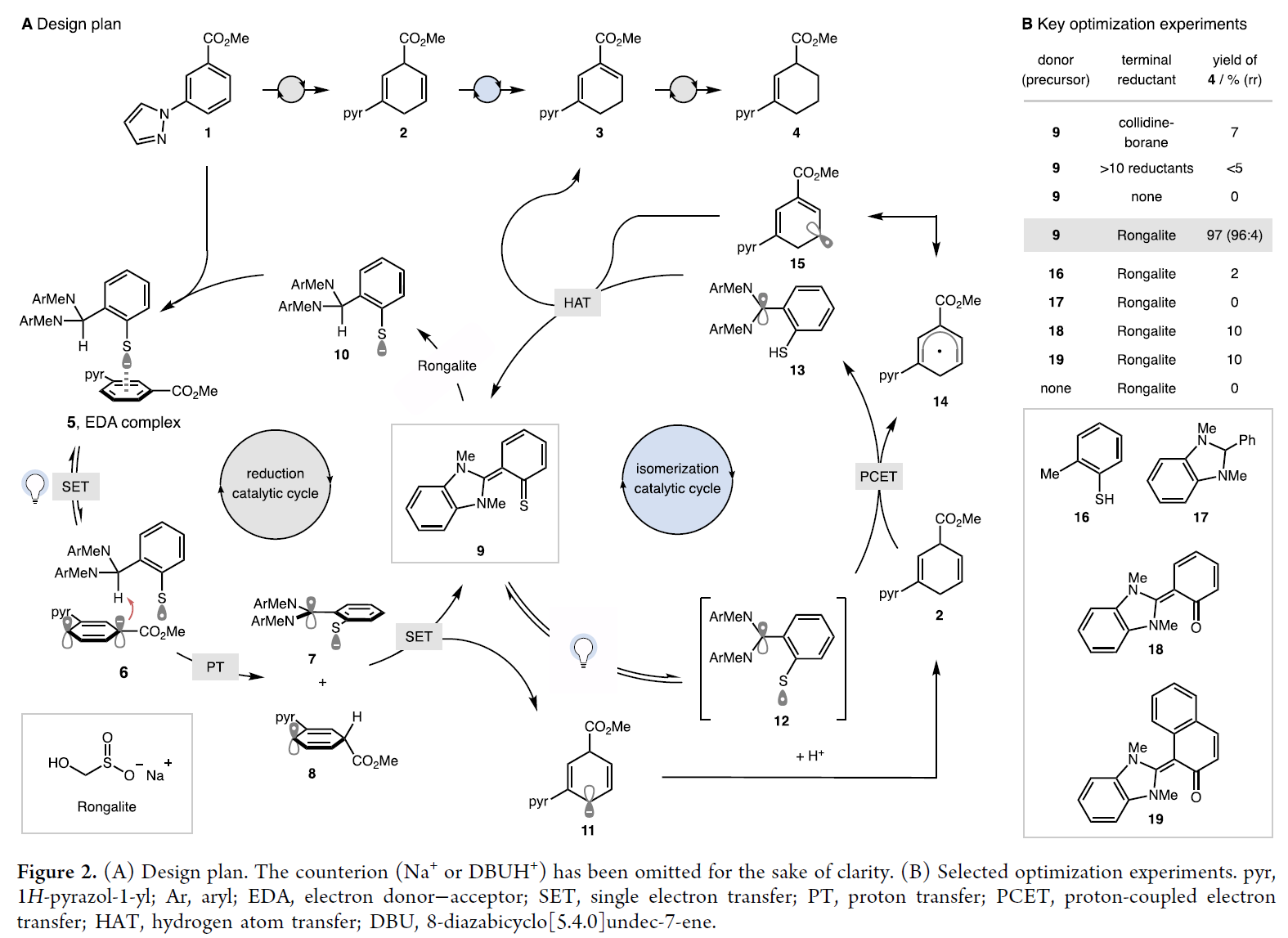
(圖片來源:J. Am. Chem. Soc.)
在得到了最優(yōu)反應(yīng)條件后,作者對此轉(zhuǎn)化的底物范圍進(jìn)行了考察(Figure 3)。其中酯基因具有良好的商業(yè)可得性而被選為EDA復(fù)合物形成的活化基團(tuán)(SciFinder可搜索出200萬個(gè)商業(yè)可得的苯甲酸酯),且其是藥物中最常見的基團(tuán)之一,也是可進(jìn)一步多樣性官能團(tuán)化的基團(tuán)。同樣豐富且易得的腈(21, 53)也是可選的活化基團(tuán)。萘[E1/2red = - 2.7 V vs SCE (- 3.1 V vs二茂鐵)]在沒有活化基團(tuán)的情況下也可被還原,得到的主要產(chǎn)物為1,4-二氫萘(48)。值得注意的是,利用此轉(zhuǎn)化可選擇性得獲得2-環(huán)己烯羧酸酯(4, 20, 22-47),而利用Diels-Alder反應(yīng)則幾乎總是得到3-環(huán)己烯羧酸酯。通常來講,2-取代環(huán)己烯羧酸因只能通過較少探索的逆電子需求的Diels-Alder反應(yīng)形成,并且在合成單取代產(chǎn)物時(shí)需要?dú)鈶B(tài)乙烯作為親雙烯體。此外,單取代芳烴和間位取代的芳烴均可作為合適的底物參與反應(yīng)。盡管鄰位取代和對位取代的芳烴的氧化還原電位相似,但表現(xiàn)出較低的反應(yīng)活性。作者認(rèn)為可能是具有空間位阻的EDA復(fù)合物的形成或較慢的質(zhì)子轉(zhuǎn)移所造成的。環(huán)狀芳烴,如吲哚(50)、吲唑(51)、萘(48、49、52-54)和菲(55),由于不容易產(chǎn)生位阻效應(yīng),可以以較高的產(chǎn)率得到產(chǎn)物,且通常表現(xiàn)出最缺電子環(huán)的完全還原(50-55)。這種區(qū)域選擇性與氫化反應(yīng)的區(qū)域選擇性是正交的。最值得注意的是,該反應(yīng)可耐受許多醫(yī)學(xué)上和合成上相關(guān)的基團(tuán)。具有活性氫的官能團(tuán)如醇(22)和吲唑(51)與路易斯堿基團(tuán)如咪唑(28)、三唑(29)、氨基吡啶(32)、吡唑(4, 42-45)和硫醚(47)同樣具有良好的耐受性。此外,可還原官能團(tuán)同樣具有廣泛耐受性,如腈(21, 53)、砜(38)和炔(44)等。因?yàn)榇祟惞羌茉诒江h(huán)的所有還原過程中均不耐受,無論產(chǎn)物是1,4-環(huán)己二烯、環(huán)己烯還是環(huán)己烷。然而,具有比苯甲酸酯更高氧化還原電位的基團(tuán)會(huì)優(yōu)先于芳烴被還原。最后,該方法還可應(yīng)用于活性藥物成分 Piperocaine(23)和Benfluorex(25)中單取代苯環(huán)的還原,產(chǎn)率和rr良好,證明了此轉(zhuǎn)化的實(shí)用性。
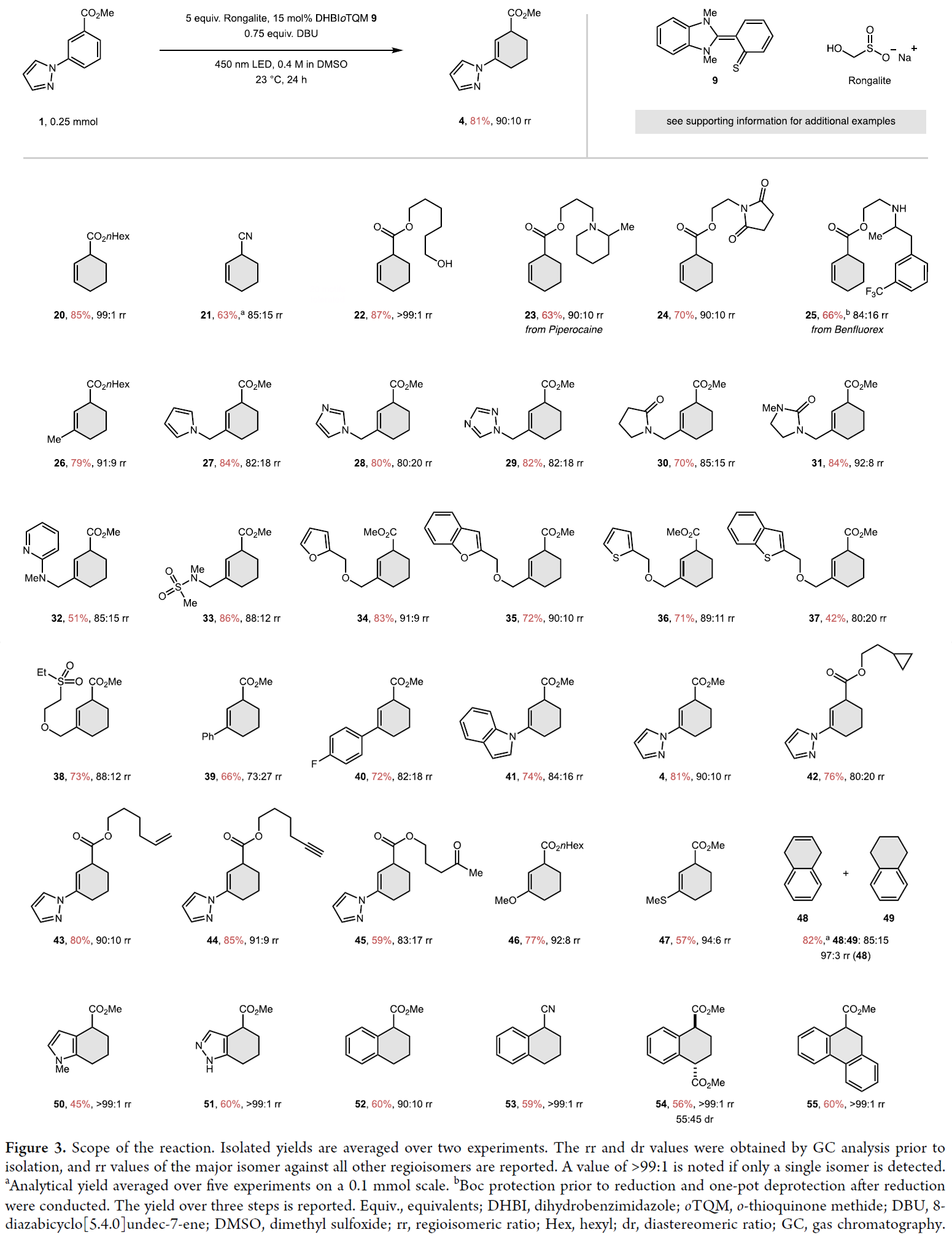
(圖片來源:J. Am. Chem. Soc.)
為了證明產(chǎn)物的多樣性,作者進(jìn)行了一系列合成轉(zhuǎn)化(Figure 4A)。首先,羧酸酯可以很容易通過皂化反應(yīng)得到游離羧酸(57, 59),其可以實(shí)現(xiàn)酰胺鍵構(gòu)建(56)和脫羧胺化(60)反應(yīng)。此外,利用Nicewicz小組所開發(fā)的改進(jìn)方案可以將四氫萘(57)以及非取代(58)和間取代環(huán)己烯(59)羧酸轉(zhuǎn)化為其脫羧產(chǎn)物(49, 61, 62)。這使得酯可以作為芳烴化學(xué)選擇性還原過程的無痕導(dǎo)向基團(tuán)。
初步的機(jī)理實(shí)驗(yàn)主要集中在驗(yàn)證EDA絡(luò)合物的形成和甲硫醌介導(dǎo)的異構(gòu)化過程。紫外/可見研究表明,在原位制備的10和萘-1-羧酸甲酯之間形成了EDA復(fù)合物(63)(Figure 4B)。隨后,作者對模板芳烴1和1,3-二烯S42以及苯硫酚酯和苯基二氫苯并咪唑作為替代供體分別進(jìn)行了類似的實(shí)驗(yàn)。這些實(shí)驗(yàn)表明EDA復(fù)合物的形成是此轉(zhuǎn)化的機(jī)理,并且供體是苯硫酚酯而不是DHBI。1,4-二氫萘48的異構(gòu)化研究表明,甲基硫醌9和光都是必需的,且反應(yīng)不需要堿,從而消除了堿介導(dǎo)異構(gòu)化的可能性(Figure 4C)。實(shí)驗(yàn)中再氧化萘的生成和1,4-環(huán)己二烯的類似實(shí)驗(yàn)中苯的定量生成可能是通過環(huán)己二烯基自由基的氧化和去質(zhì)子化得到的,這表明控制被還原的(10)和被氧化的給體(9)之間的比例是非常重要的。由于氫化轉(zhuǎn)移、氫原子轉(zhuǎn)移(HAT)、氧化/消除、和非協(xié)調(diào)質(zhì)子耦合電子轉(zhuǎn)移(PCET)都被用于醌介導(dǎo)的氧化。基于α-酯C-H鍵極性不匹配的氫化物和H原子攫取,作者認(rèn)為是通過PCET機(jī)理生成了環(huán)己二烯基自由基。
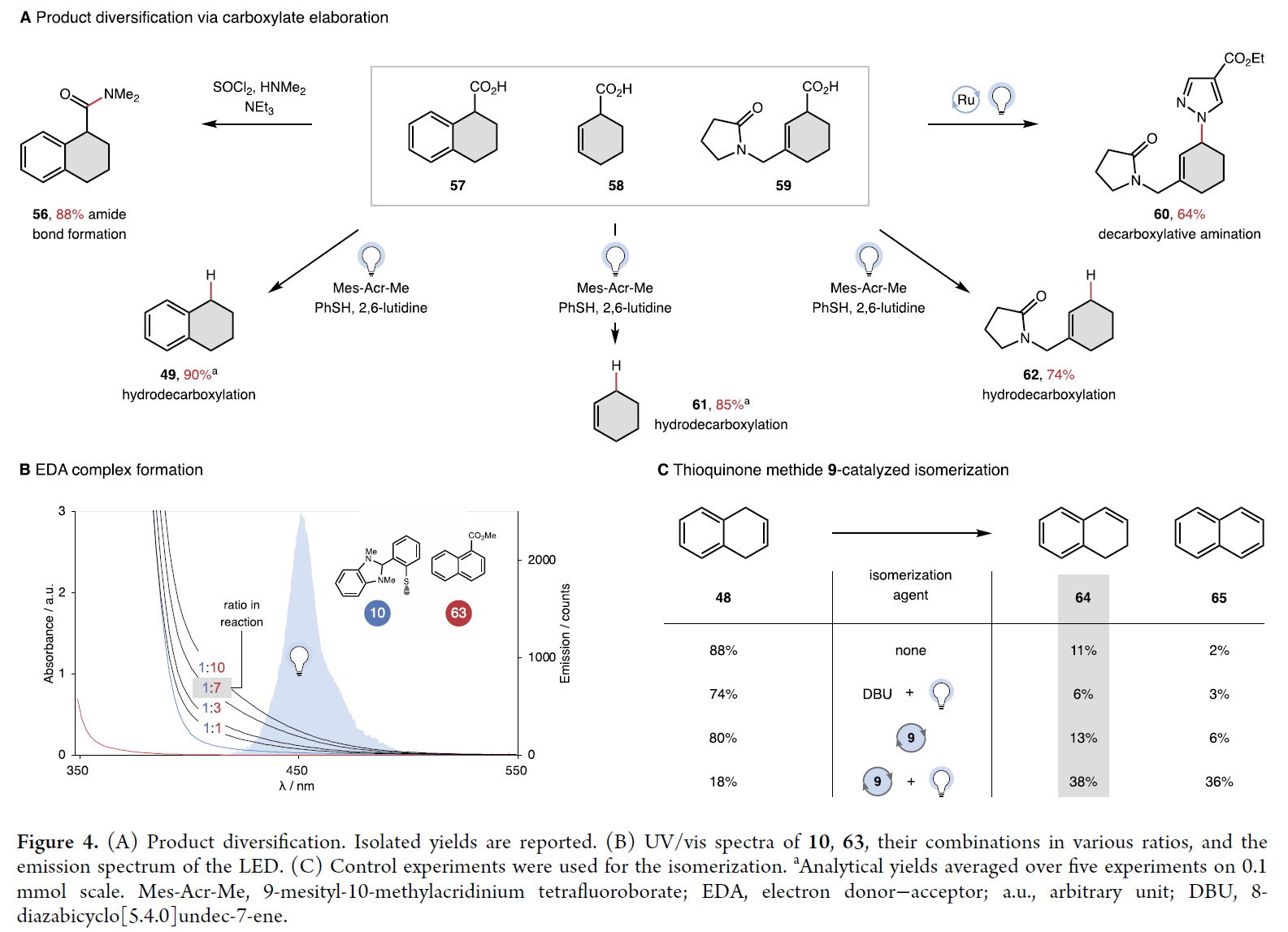
(圖片來源:J. Am. Chem. Soc.)
總結(jié)
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn