

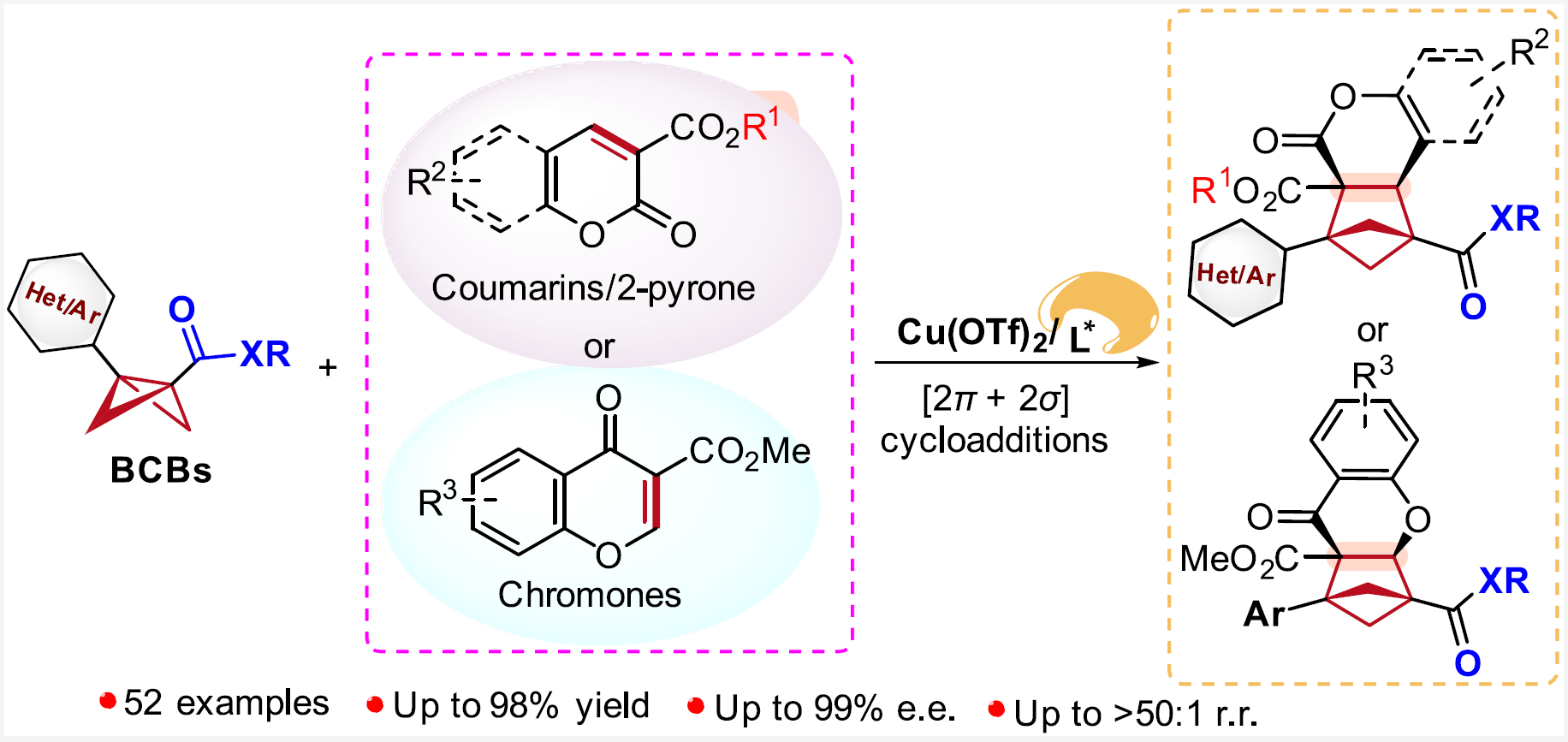
正文
在藥物化學研究中,根據“逃離平面”概念,提高sp3雜化碳的比例和手性碳的數目可以增加候選藥物分子的復雜性,從而提高其臨床成功率;因此三維(3D)、飽和的、橋環類化合物在藥物化學中受到廣泛關注,其中全碳的雙環[2.1.1]己烷(BCHs)能夠作為多種不同取代苯基的生物電子等排體;然而,目前手性全碳的BCHs的合成方法尚未得到充分研究,且手性全碳的BCHs替代生物活性分子(或小分子藥物)中的苯環及其相應的生物活性研究還未見文獻報道(圖1A)。
雙環[1.1.0]丁烷(BCBs)的[2π + 2σ]環加成反應是構建BCHs最簡便的方法之一。2022年,Glorius課題組(德國明斯特大學)報道了光催化BCBs與香豆素等的[2π + 2σ]環加成反應,成功合成了1,2,3-三取代、全碳的BCHs(圖1B)。Studer(德國明斯特大學)、馮見君(湖南大學)、鄧力&倪冬順團隊(西湖大學)、李鵬飛(西安交通大學)和王洪根(中山大學)等國內外的課題組在這一領域進行了廣泛而細致的研究。2023年,Thorsten. Bach課題組(德國慕尼黑工業大學)報道了首例光介導的BCBs的[2π + 2σ]不對稱環加成反應,但該反應需要2當量的手性光敏劑;隨后,江智勇課題組(河南師范大學)報道了光與手性磷酸催化BCBs的[2π + 2σ]不對稱環加成反應;最近,馮見君(湖南大學)、李孝訓(山東大學)、周其林(南開大學)等課題組也報道了BCBs與多類底物的不對稱環加成反應,構建各種手性的雜芳基生物電子等排體,這些工作基本和作者的研究工作是同期進行的。盡管有了這些重大進展,但通過路易斯酸催化BCBs的不對稱[2π + 2σ]環加成反應來構建手性、多取代的、全碳BCHs的方法仍未見文獻報道(截至作者投稿時)。鑒于BCBs的高應變能、固有的不穩定性和高反應性,如果要實現以上策略,需亟待解決以下諸多挑戰:1)極性翻轉的Alder-ene反應(Bai, D. & Chang, J. et al. Nat. Commun. 2024, 15, 2833.);2)開環反應(Feng, J.-J. et al. Chem. Sci. 2023, 14, 9696.);3)消除反應(Feng, J.-J. et al. Angew. Chem., Int. Ed. 2023, 62, e202310066.; Leitch, D. C. et al. Angew. Chem., Int. Ed. 2022, 61, e202204719.);4)強大的外消旋背景反應(Ni, D. & Deng, L. et al. Angew. Chem., Int. Ed. 2023, 62, e202308606.);5)區域選擇性問題(Zhang, J.-L. & Feng, J.-J. et al. J. Am. Chem. Soc. 2024, 146, 19621.)等(圖1C);此外,同時構建相鄰三級-四級手性碳中心也是一個巨大的挑戰。
針對以上問題,清華大學深圳國際研究生院/深圳灣實驗室蔣宇揚團隊、南方科技大學劉心元團隊和清華大學深圳國際研究生院林進順團隊合作發展了路易斯酸催化BCBs分別與香豆素、2-吡喃或色酮等的不對稱分子間[2π + 2σ]環加成反應,以優秀的對映/非對映/區域選擇性合成了結構多樣的、具有鄰位的三級-四級碳手性中心的、1,2,3,4-四取代的、全碳的BCHs。在該反應中,手性雙噁唑啉配體的引入可有效抑制副反應、能顯著地減少外消旋的背景反應,并精確調控反應活性以及區域、對映和非對映選擇性,所得的手性BCHs可以替代抗腫瘤藥物Sonidegib和非肽類小分子PD-1/PD-L1抑制劑BMS-202中的苯環,并合成了這兩個生物活性分子的手性類似物BCHex-Sonidegib和BCHex-BMS-202,并評估了二者的理化性質和藥理學特性(圖1D)。
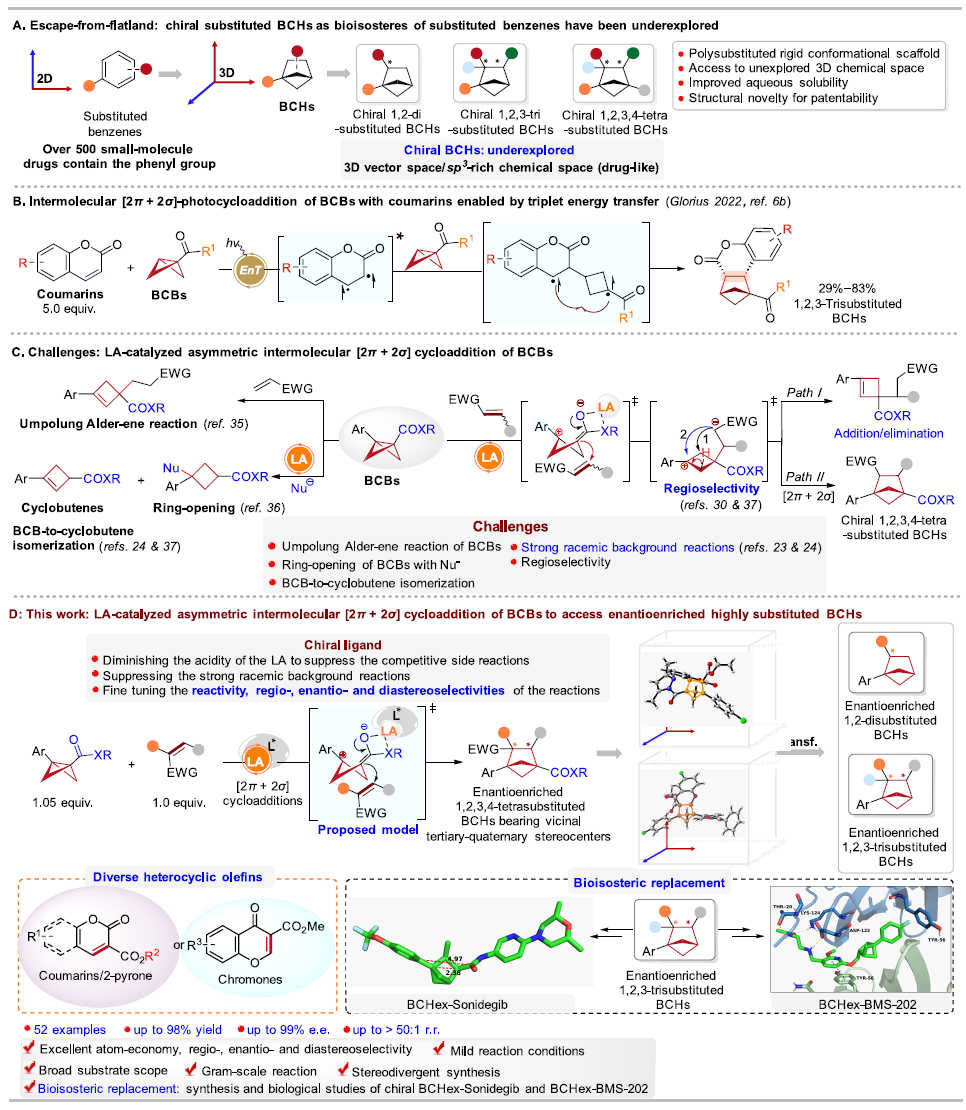
圖1. 路易斯酸催化BCBs的不對稱[2π + 2σ]環加成反應構建手性BCH化合物
作者對手性配體、路易斯酸和溶劑等反應條件進行系統性篩選,獲得了以下最優條件:Cu(OTf)2/L*12為手性催化體系,DCM作溶劑,在-20 ℃下反應。在該條件下,香豆素乙酯可與具有酰基吡唑基團的BCBs底物進行不對稱[2π + 2σ]環加成反應,以優異的產率和對映選擇性(95%,97% e.e.)得到手性BCHs產物(圖2)。
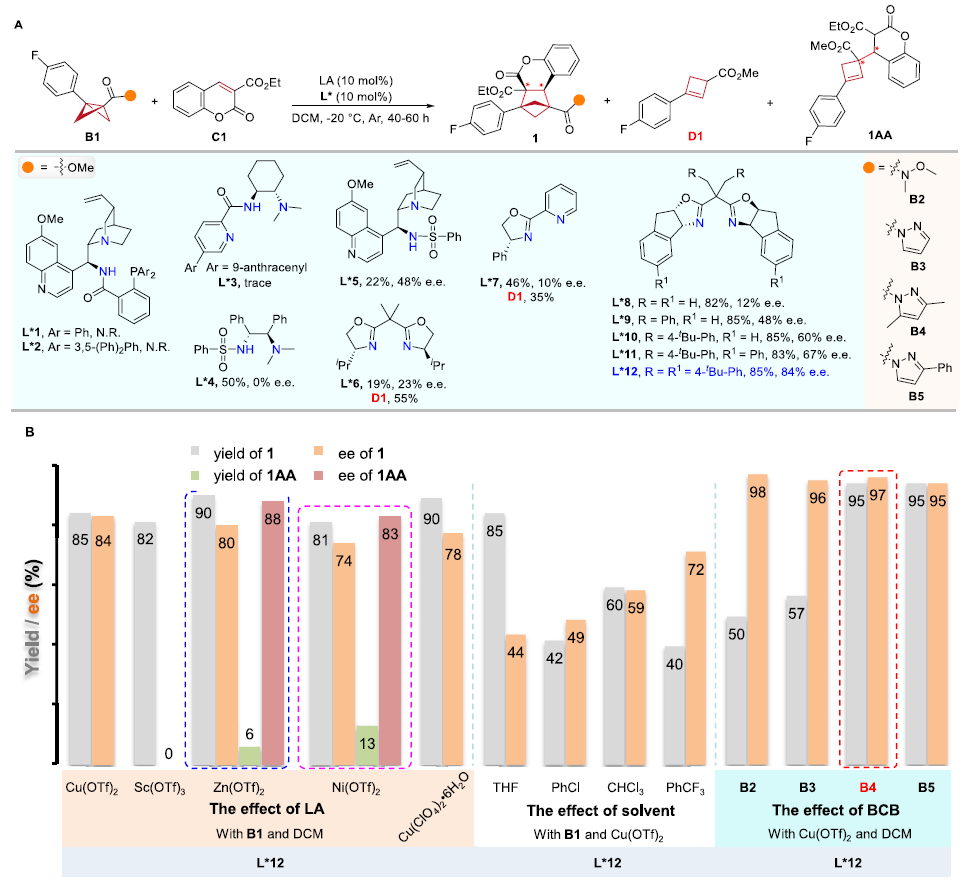
圖2. 反應條件的優化
在確定了最佳反應條件后,作者對反應的底物普適性進行考察。首先,BCBs芳環上取代基的位置和電性對反應效率和立體選擇性的影響較小。特別值得一提的是,作者通過3-噻吩和苯乙炔取代的BCBs得到了相應的BCHs(17和18),苯乙炔取代的BCBs中的炔基可能會在BCB的相關自由基反應過程中發生反應,但在該催化體系中能很好的保持;此外,產物18的還原可能生成含有苯乙烯的BCH,可以作為苯乙烯的生物電子等排體。接下來,作者對香豆素底物范圍進行考察,含有不同酯或酰胺基團的香豆素底物均具有良好的產率和對映選擇性,值得注意的是,帶有烯基或炔基的香豆素在相關的自由基反應中傾向于發生分子內[2+2]環加成;含有給電子基團或吸電子基團和不同位置取代以及萘環的香豆素底物都能夠以中等至優異的收率得到高對映選擇性的BCHs產物(圖3)。

圖3. BCB和香豆素底物的普適性考察
此外,作者還意外發現在路易斯酸和手性配體的催化下,BCBs與2-吡喃底物并沒有發生預期的不對稱Diels-Alder類([4π + 2σ])環加成反應,生成手性雙環[4.1.1]辛烷,而是仍然發生[2π + 2σ]環加成生成了相應的BCHs,該結果極大地擴展了已知的2-吡喃反應模式。此外,BCBs與色酮底物的不對稱[2π+2σ]環加成反應也順利得到了相應的手性BCHs產物(圖4)。
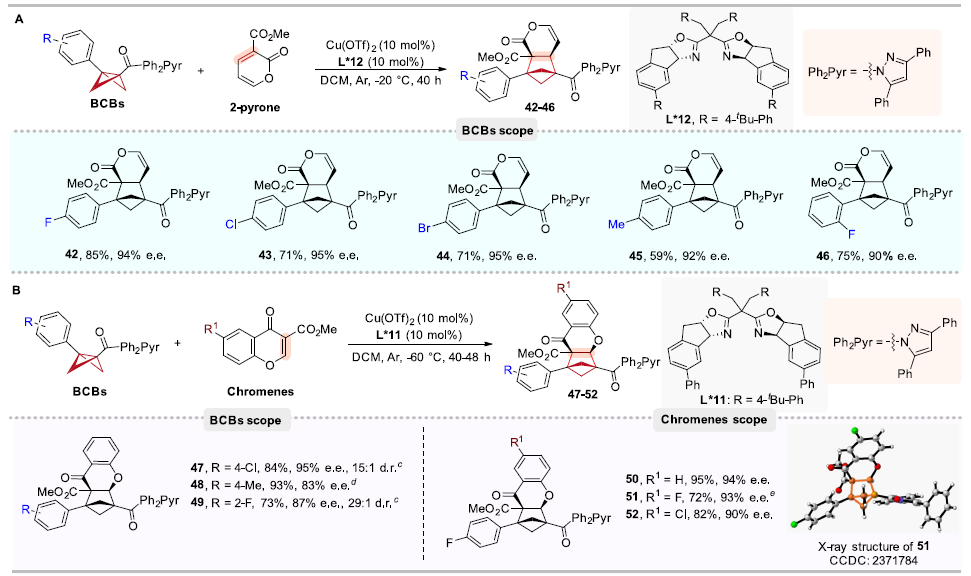
圖4. BCB和2-吡喃及色酮底物的普適性考察
為了進一步展示該反應體系的實用性,作者進行了放大實驗(克級)(圖5A),反應仍具有高效和高立體選擇性。BCHs產物中的酰基吡唑基團可以方便的進行后續官能團化轉化,合成一系列手性BCHs衍生物,得到1,2-二取代和1,2,3-三取代的BCHs(圖5 B-C),這些轉化產物提供了實用的手性BCHs模塊,在上述轉化中BCHs的e.e.都能保留,進一步證明了該方法在合成中的實用性。此外,作者使用手性配體L*12的對映異構體ent-L*12實現手性BCH產物12的立體發散性合成,得到了對映異構體ent-12(圖5D)。
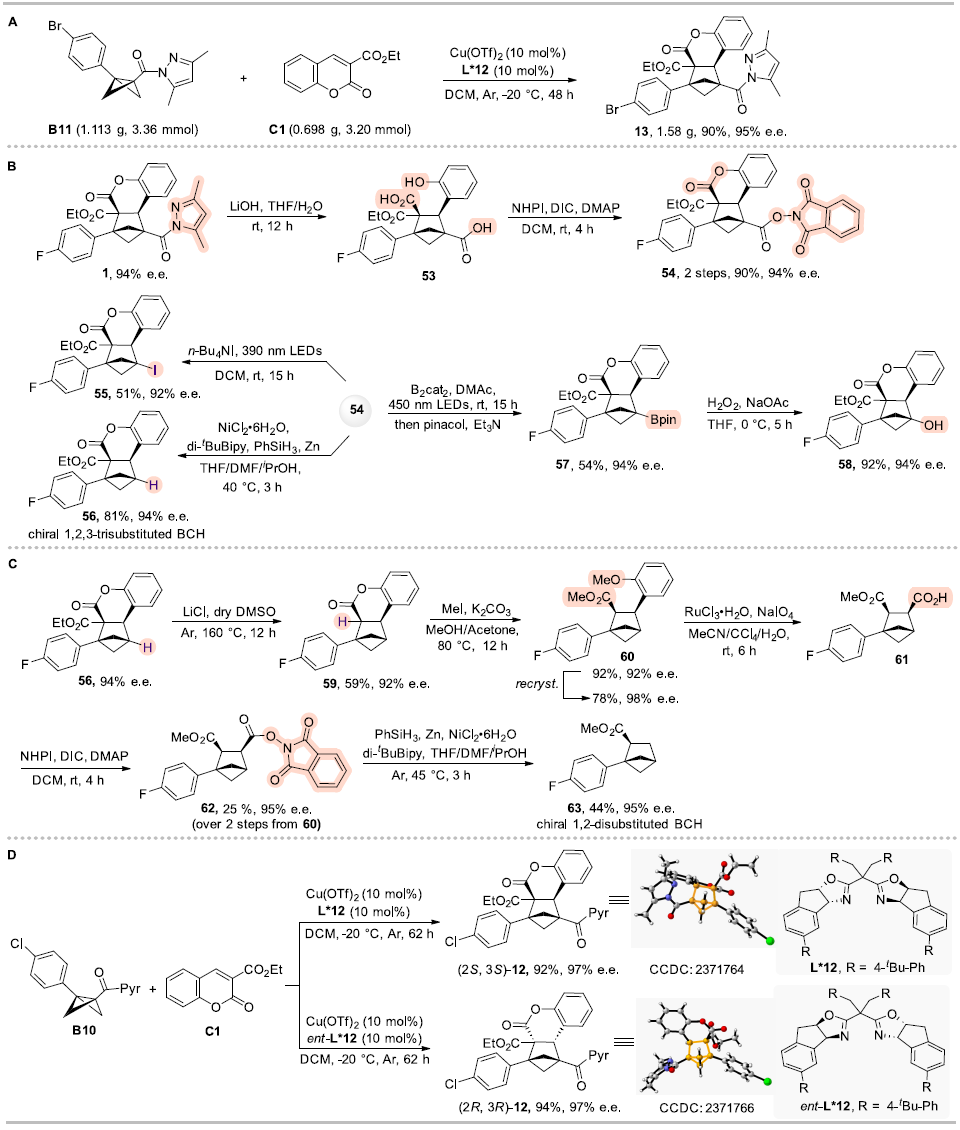
圖5. 合成應用
為了展示1,2,3-三取代BCHs作為1,2,3-三取代苯的替代物的應用價值,作者設計并合成了抗癌藥Sonidegib的類似物BCHex-Sonidegib和非肽類PD-1/PD-L1小分子抑制劑BCHex-BMS-202。作者使用軟件模擬了Sonidegib和BCHex-Sonidegib的三維構象,發現二者能夠良好重疊,表明替代前后分子的空間幾何特征基本相同;并使用分子對接模擬預測了手性BCHex-BMS-202與PD-L1的結合模式,結果表明其結合構象與BMS-202基本一致,并保留了關鍵的π-π相互作用(圖6)。這些結果應證了BCHs作為苯的生物電子等排體的可行性。
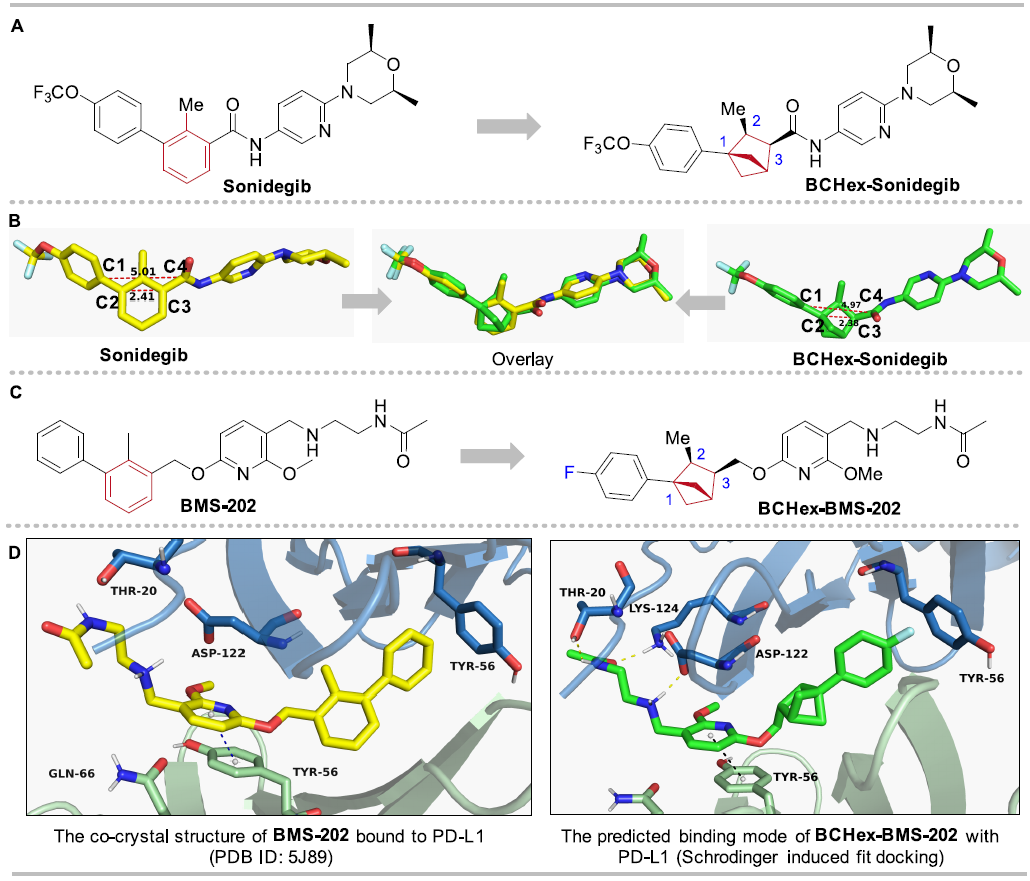
圖6. 生物等排替代和計算模擬預測
作者分別合成了BCHex-Sonidegib和BCHex-BMS-202,并評估了分子的理化性質和藥理學特性,結果顯示,與陽性對照Sonidegib和BMS-202相比,BCHex-Sonidegib和BCHex-BMS-202表現出更好的溶解性和代謝穩定性(圖7);同時,它們表現出與陽性對照Sonidegib和BMS-202相當的抗腫瘤活性、在正常的肝臟細胞中表現出更低的毒性(表1),且能誘導腫瘤細胞凋亡和抑制腫瘤細胞的克隆形成(圖8)。
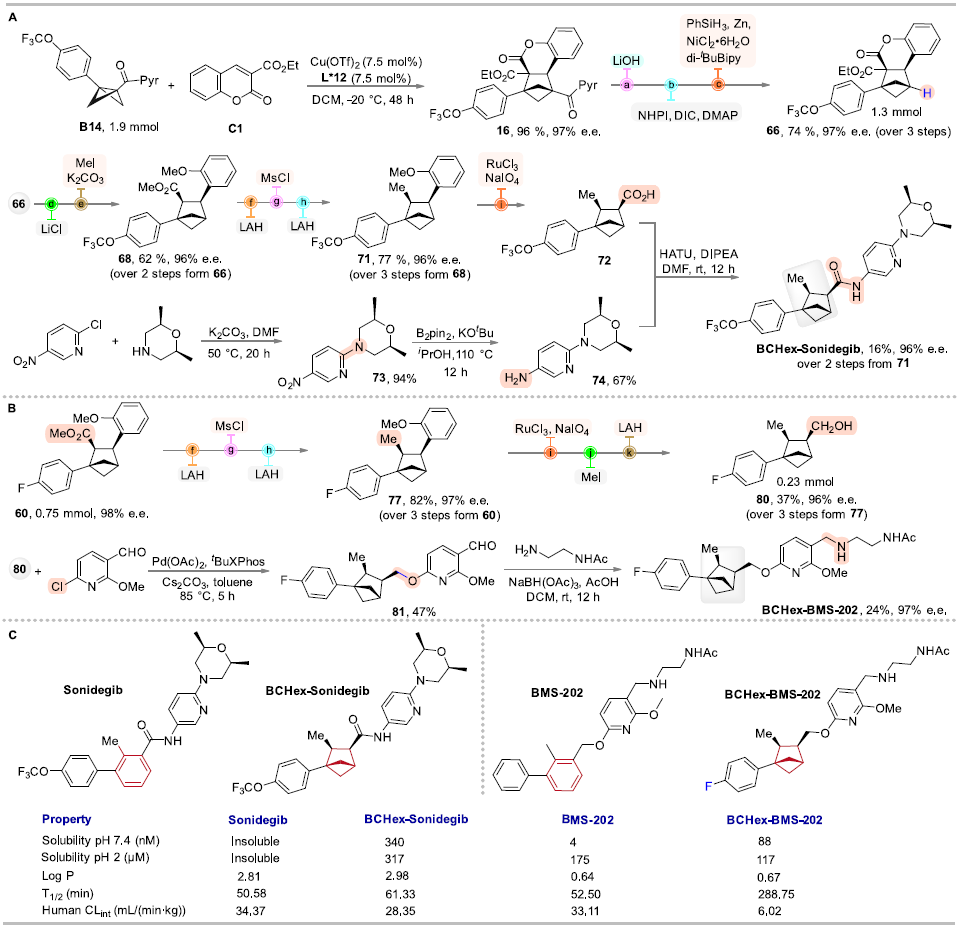
圖7. BCHs生物等排體的合成路線與理化性質分析
表1. 化合物對人類腫瘤細胞系和正常肝細胞的抗腫瘤活性
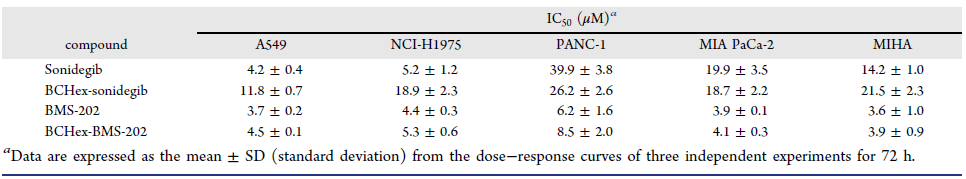
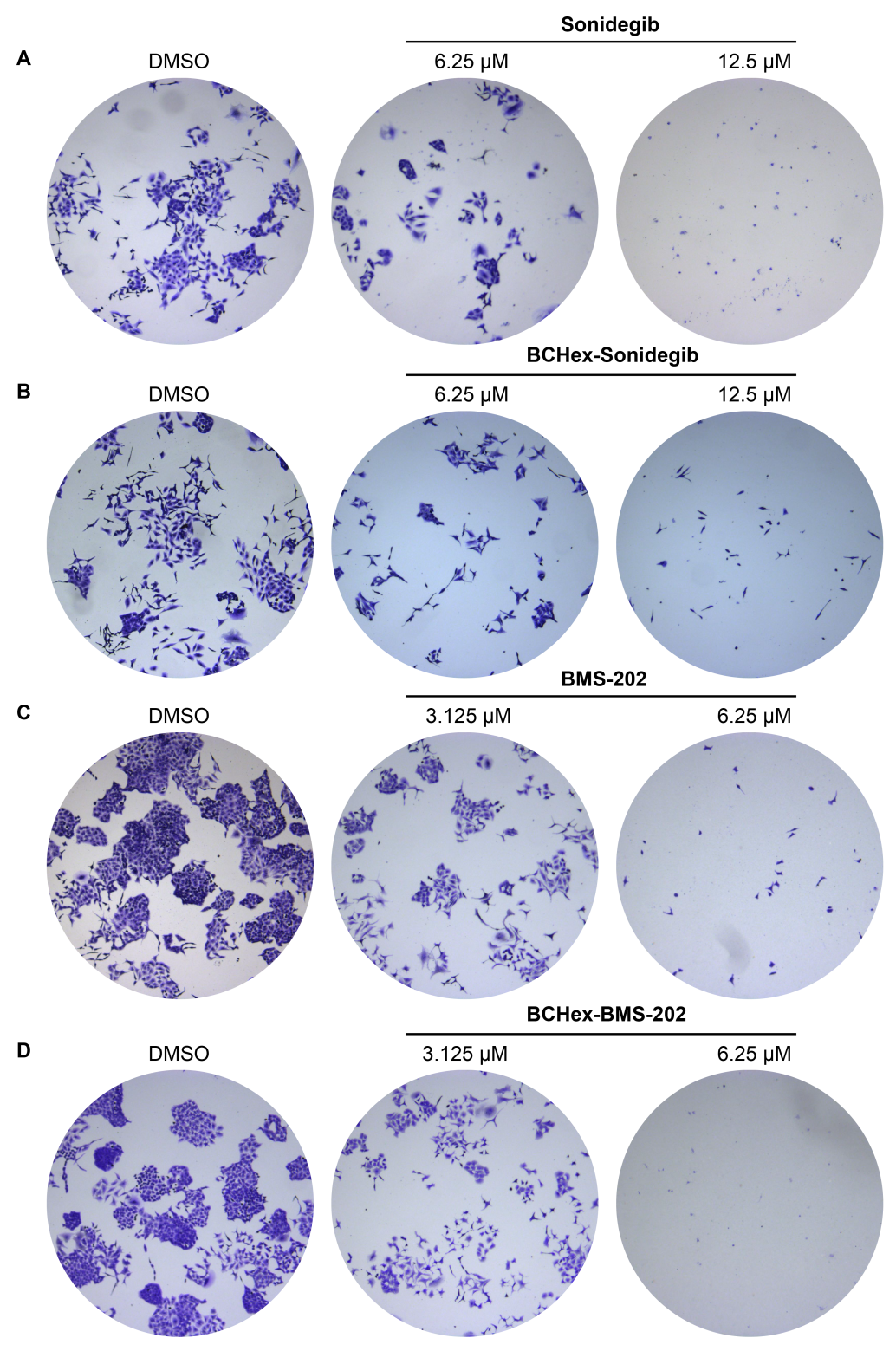
圖8. 化合物抑制腫瘤細胞A549的克隆形成
為了深入了解反應機理,作者進行了自由基捕獲實驗、控制實驗等一系列機理實驗,證明了:反應不涉及自由基歷程;手性雙噁唑啉配體能夠有效降低路易斯酸的酸性,抑制BCB的分解;香豆素底物的環外酯基作為配位基團與路易斯酸結合,從而促進反應和立體誘導。最后,作者發現環丁烯中間體1AA在標準反應條件下未得到手性BCH產物,這表明BCBs的環加成并未通過環丁烯中間體進行。基于上述實驗結果和文獻報道,作者提出了路易斯酸催化的BCBs不對稱分子間[2π + 2σ]環加成反應的可能反應機制(圖9)。
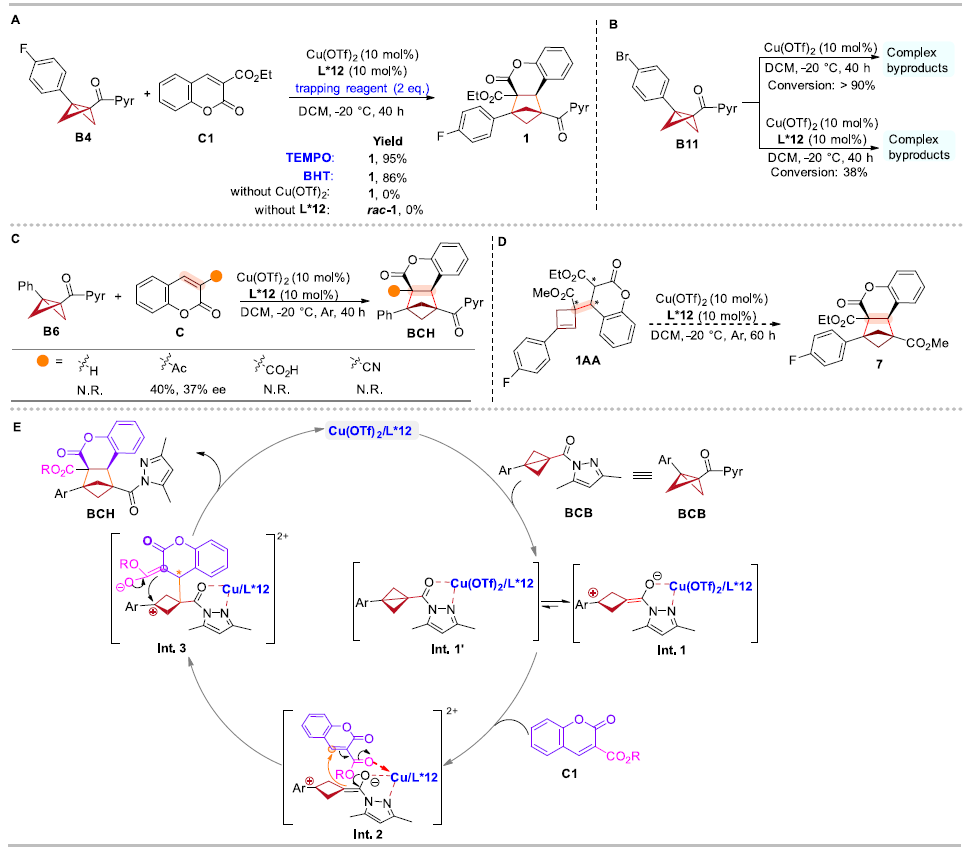
圖9. 機理實驗和推測的機理
總結
綜上所述,清華大學深圳國際研究生院/深圳灣實驗室蔣宇揚團隊、南方科技大學劉心元團隊和清華大學深圳國際研究生院林進順團隊合作發展了路易斯酸/手性配體催化的BCBs分別與香豆素、2-吡喃或色酮的不對稱分子間[2π+2σ]環加成反應,以優秀的對映/非對映/區域選擇性合成了結構多樣的、具有鄰位的三級-四級碳手性中心的、1,2,3,4-四取代的、全碳的BCHs。接著,作者合成了抗癌藥物Sonidegib和非肽類小分子PD-1/PD-L1抑制劑BMS-202的手性BCHs類似物:BCHex-Sonidegib和BCHex-BMS-202。與Sonidegib和BMS-202相比,BCHex-Sonidegib和BCHex-BMS-202在體外的理化性質都得到顯著改善,同時具有與Sonidegib和BMS-202相當的抗腫瘤活性,并表現出抗增殖效果、誘導腫瘤細胞凋亡和抑制腫瘤細胞克隆形成。這項研究工作是國際上首次利用手性1,2,3-三取代的BCHs替代1,2,3-三取代的苯環,突顯了手性多取代BCHs作為苯環生物電子等排體在藥物化學中的潛在應用。
這一成果近期發表在Journal of the American Chemical Society上,清華大學深圳國際研究生院/深圳灣實驗室蔣宇揚教授、南方科技大學劉心元教授和清華大學深圳國際研究生院林進順博士為本論文的共同通訊作者;清華大學深圳國際研究生院為第一完成單位,清華大學碩士生李英杰和吳志龍、南方科技大學顧強帥副教授和深圳灣實驗室樊婷婷副研究員為論文的共同第一作者。該工作得到了深圳市科技創新委員會、廣東省本土創新團隊項目和深圳灣實驗室科研啟動基金等的支持。最后,作者衷心感謝哈爾濱工業大學(深圳)的夏吾炯教授、郭林副教授和師成城博士在光催化反應方面提供的幫助,以及南方科技大學化學系的常曉勇博士在X射線晶體學分析方面的協助。

聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn