



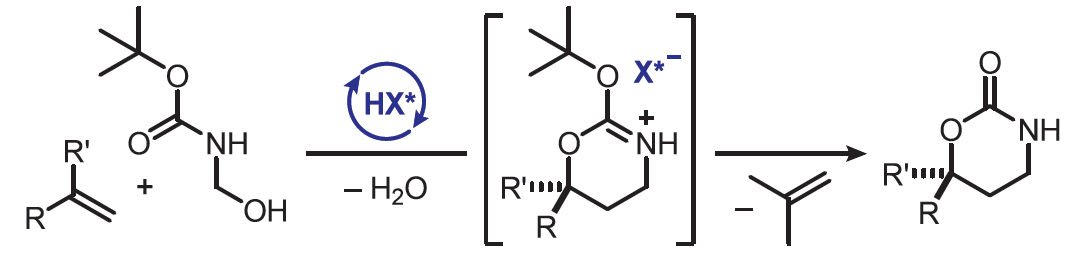
正文
烯烴的直接官能團(tuán)化是一類極具價(jià)值的策略,如烯烴參與二羥基化和氨基羥基化反應(yīng),可直接獲得具有價(jià)值的1,2-二醇和1,2-氨基醇。同時(shí),烯烴參與的Prins型oxy-oxymethylation是合成1,3-二醇的有效方法(Figure 1a)。然而,對(duì)于烯烴參與oxy-aminomethylation合成1,3-氨基醇的方法,目前尚未有相關(guān)的研究報(bào)道。值得注意的是,手性1,3-氨基醇是一類極具價(jià)值的砌塊,廣泛存在于各類上市的抗抑郁藥中,如(S)-度洛西汀、(R) -氟西汀和(R)-托莫西汀(Figure 1b)。目前,對(duì)于合成手性1,3-氨基醇的方法主要集中于過(guò)渡金屬催化劑的不對(duì)稱氫化、烯丙醇的氫胺化、預(yù)官能團(tuán)化底物的分子間C-H胺化和aza-aldol反應(yīng)。然而,通過(guò)烯烴官能團(tuán)化合成1,3-氨基醇的反應(yīng),卻較少有相關(guān)的研究報(bào)道。作者設(shè)想,烯烴可與N-Boc-formaldimine進(jìn)行催化不對(duì)稱[4+2]-環(huán)加成反應(yīng),形成相應(yīng)的噁嗪酮(oxazinanones),這是一種有價(jià)值的1,3-氨基醇前體。近日,Benjamin List團(tuán)隊(duì)報(bào)道了一種Br?nsted酸催化烯烴與原位生成的N-Boc-formaldimine的高度對(duì)映選擇性、反電子需求的hetero-Diels-Alder反應(yīng)(Figure 1c)。該方法提供了一種廉價(jià)、可擴(kuò)展和直接的方法,可從烯烴合成具有價(jià)值的藥物分子,如(R) -氟西汀。歡迎下載化學(xué)加APP到手機(jī)桌面,合成化學(xué)產(chǎn)業(yè)資源聚合服務(wù)平臺(tái)。
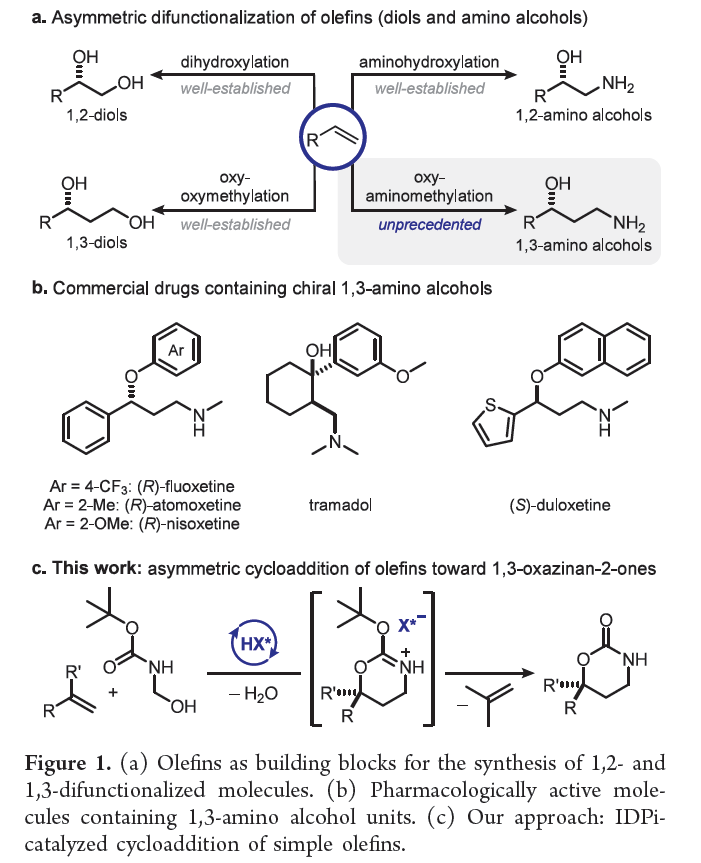
(圖片來(lái)源:J. Am. Chem. Soc.)
首先,作者以叔丁基(羥甲基)氨基甲酸酯1a(N-Boc-formaldimine前體)與苯乙烯2a作為模型底物,進(jìn)行了相關(guān)反應(yīng)條件的篩選(Table 1)。當(dāng)以IDPi 6b(1 mol %)作為手性催化劑,在CHCl3溶劑中-25 oC反應(yīng),可以73%的收率得到產(chǎn)物3a,er為97:3。
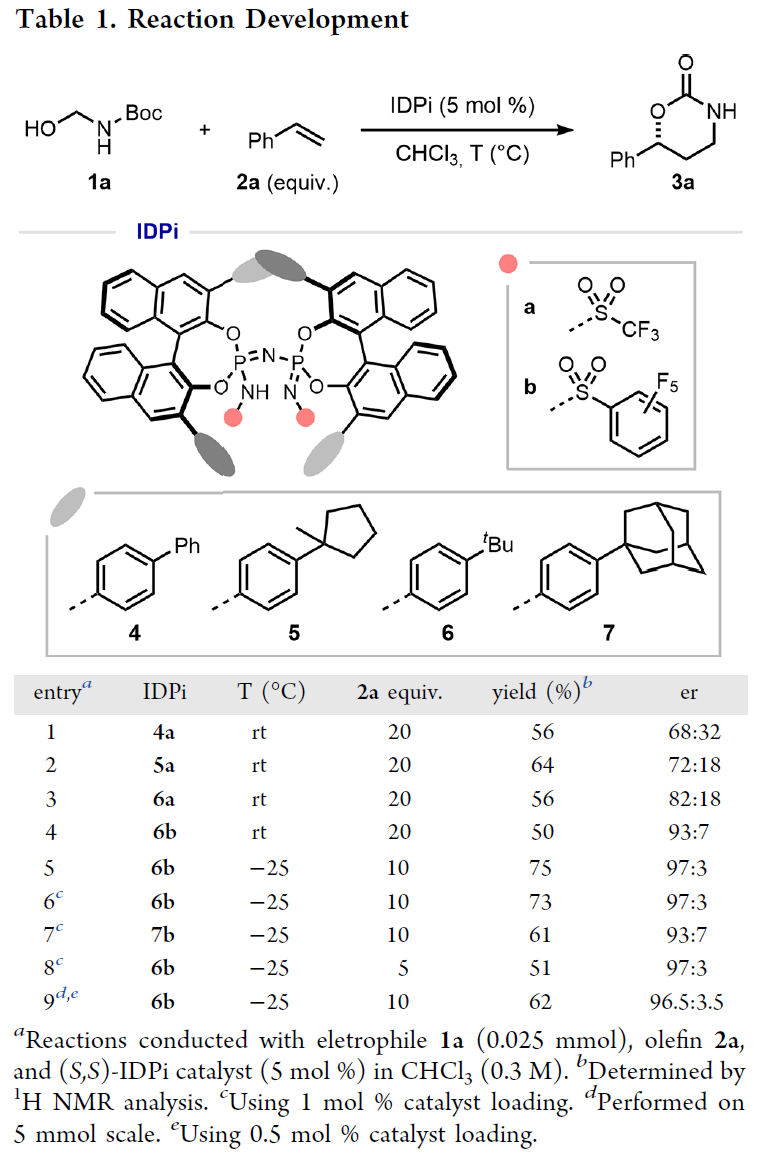
(圖片來(lái)源:J. Am. Chem. Soc.)
在獲得上述最佳反應(yīng)條件后,作者對(duì)底物范圍進(jìn)行了擴(kuò)展(Figure 2)。首先,苯乙烯的芳基上含有一系列不同電性取代基時(shí),均可順利進(jìn)行反應(yīng),獲得相應(yīng)的產(chǎn)物3a-3n,收率為42-81%,e.r.為94:6-99:1。其中,1,4-二乙烯基苯底物,只進(jìn)行單官能團(tuán)化反應(yīng),如3c。其次,含有雜芳基取代的烯烴,如噻吩基、苯并呋喃基和苯并噻吩基,也是合適的底物,獲得相應(yīng)的產(chǎn)物3o-3q,收率為76-87%,e.r.為93:7-95.5:4.5。此外,α-烷基取代的苯乙烯以及α,α-二烷基取代的烯烴,也與體系兼容,獲得相應(yīng)的產(chǎn)物3r-3w,收率為23-71%,e.r.為93:7-99:1。
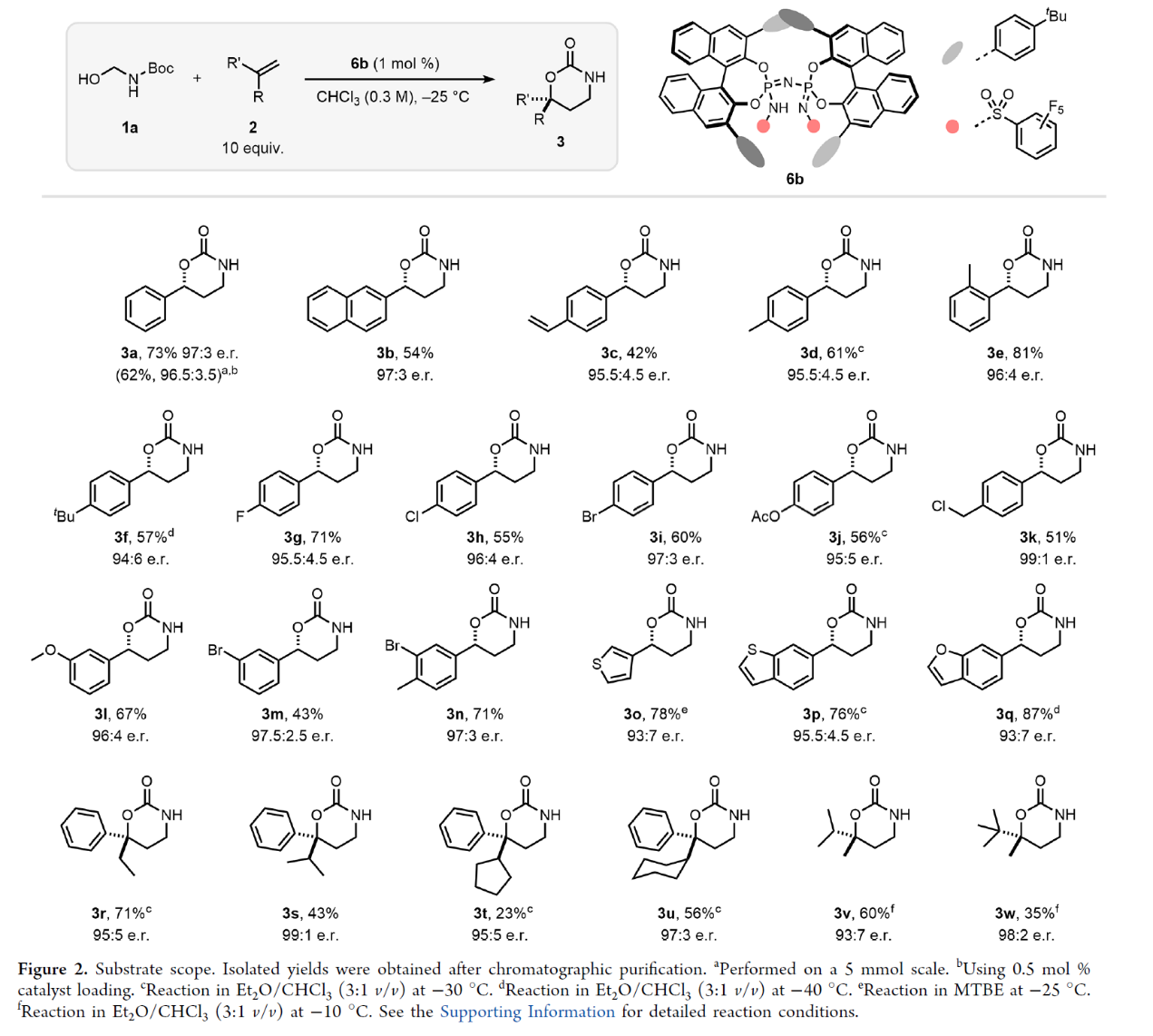
(圖片來(lái)源:J. Am. Chem. Soc.)
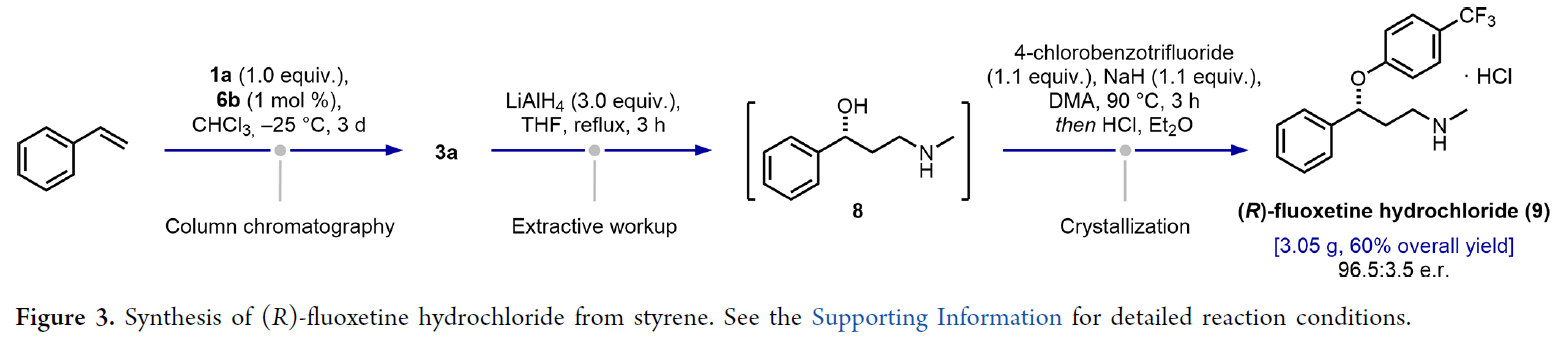
緊接著,作者對(duì)反應(yīng)的實(shí)用性進(jìn)行了擴(kuò)展(Figure 3)。以苯乙烯與1a為初始底物,在上述標(biāo)準(zhǔn)條件下反應(yīng),可制備中間體3a。3a在LiAlH4/THF條件下進(jìn)行開(kāi)環(huán)反應(yīng),可制備氨基醇中間體8,其是合成抗抑郁藥(R) -氟西汀、(R)-托莫西汀等的前體。中間體8與對(duì)氯三氟甲苯在NaH以及HCl/Et2O條件反應(yīng),可制備(R) -氟西汀鹽酸鹽(9),總收率為60%,e.r.為96.5:3.5。
(圖片來(lái)源:J. Am. Chem. Soc.)
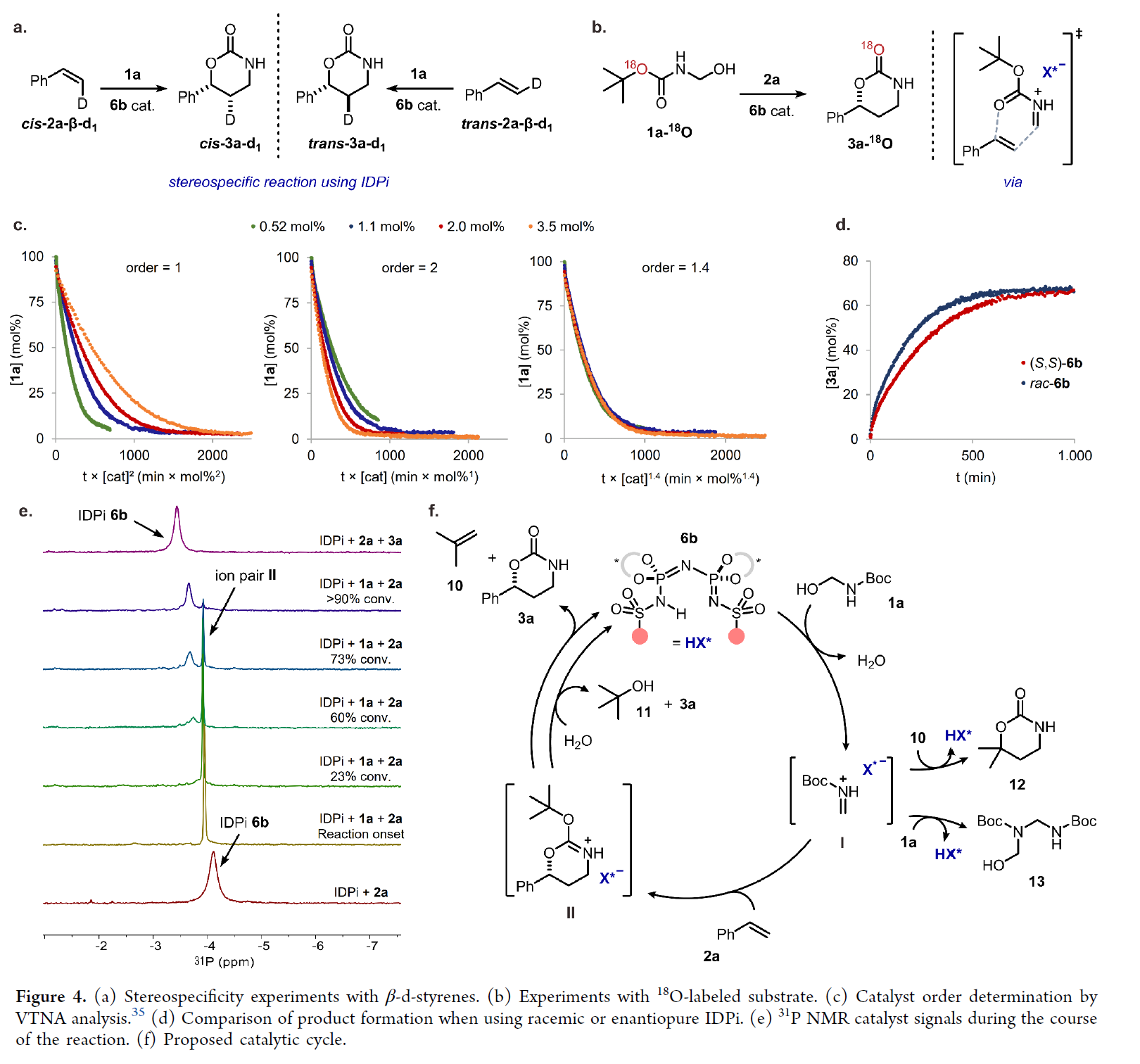
最后,作者對(duì)反應(yīng)的機(jī)理進(jìn)行了研究(Figure 4)。首先,β-d-苯乙烯的立體專一性實(shí)驗(yàn)表明,IDPi 6b催化的反應(yīng)可能遵循協(xié)同的、可能異步(asynchronous)的[4+2]型環(huán)加成途徑(Figure 4a)。18O-標(biāo)記底物的實(shí)驗(yàn)結(jié)果表明,烯烴對(duì)亞胺離子I的親核進(jìn)攻僅發(fā)生在羰基氧原子上(Figure 4b)。同時(shí),通過(guò)1H NMR監(jiān)測(cè)反應(yīng)揭示了異丁烯(10)的預(yù)期形成以及幾種副產(chǎn)物,包括叔丁醇(11)、異丁烯環(huán)加合物12和親電二聚物13。化合物12和13的觀察表明,發(fā)生了競(jìng)爭(zhēng)性的off-pathway副反應(yīng),這可以解釋在所需的轉(zhuǎn)化中需要過(guò)量的烯烴2來(lái)實(shí)現(xiàn)高產(chǎn)率。短壽命且高度親電的亞氨基離子I的快速轉(zhuǎn)化,可能會(huì)導(dǎo)致上述副產(chǎn)物的形成。值得注意的是,先進(jìn)的核磁共振研究揭示了長(zhǎng)壽命反應(yīng)中間體II的形成,其尖銳的31P核磁共振信號(hào)與游離催化劑的寬信號(hào)不同(Figure 4e)。這一觀察表明,異丁烯從離子中間體II釋放到產(chǎn)物3a,這可能發(fā)生在立體化學(xué)建立后,是反應(yīng)中的周轉(zhuǎn)限制(turnover-limiting)步驟。
其次,為了了解催化劑的作用,使用不同催化劑濃度的可變時(shí)間歸一化分析(VTNA)研究了IDPi 6b的反應(yīng)級(jí)數(shù)。研究結(jié)果表明,只有一個(gè)催化劑分子參與了反應(yīng)的對(duì)映決定(enantiodetermining)步驟。然而,也不排除在后續(xù)步驟中可能涉及多個(gè)催化劑分子的可能性。作者認(rèn)為,由于中間體II的高穩(wěn)定性,第二個(gè)催化劑分子可能有助于異丁烯從II中釋放出來(lái),從而提供產(chǎn)物3a。為了進(jìn)一步研究這一假設(shè),作者將外消旋催化劑rac-6b的反應(yīng)速率與標(biāo)準(zhǔn)對(duì)映選擇性反應(yīng)的反應(yīng)速率進(jìn)行了比較,并觀察到速率提高了1.4倍(Figure 4d)。這一觀察表明,異手性催化劑混合物的存在會(huì)導(dǎo)致中間體II的更快衰變,從而加速整體反應(yīng),這支持了多個(gè)催化劑分子參與II消耗的假設(shè)。
基于上述的研究以及相關(guān)文獻(xiàn)的查閱,作者提出了一種合理的反應(yīng)機(jī)理(Figure 4f)。首先,催化循環(huán)由底物1a的質(zhì)子化和隨后的水消除引發(fā),生成亞胺離子I。由于I的高親電性,可能會(huì)發(fā)生競(jìng)爭(zhēng)性副反應(yīng),生成副產(chǎn)物12和13。其次,烯烴2a和亞胺離子I之間的對(duì)映決定步驟將以協(xié)同方式進(jìn)行,從而產(chǎn)生第二反應(yīng)中間體II。隨后,作者提出了兩種可能的途徑來(lái)結(jié)束循環(huán),即從II中連續(xù)消除異丁烯,這可以通過(guò)第二個(gè)催化劑分子來(lái)幫助生成產(chǎn)物3a,或者用水促進(jìn)從II中消除叔丁醇來(lái)提供所需的產(chǎn)物3a。
(圖片來(lái)源:J. Am. Chem. Soc.)
總結(jié)
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來(lái)源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請(qǐng)作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn