

正文
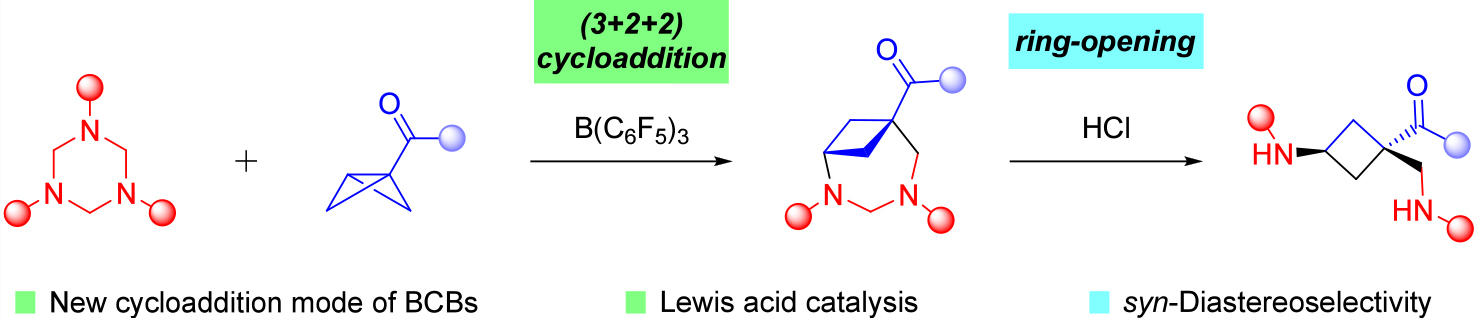
環丁烷是備受青睞的四元環合成目標物,是天然產物和藥物中用途廣泛的骨架,具備多樣的生物學特性,并且還可作為合成結構復雜分子的關鍵中間體。其中,環丁胺是藥物開發中的關鍵核心,可在多種生物活性分子中找到,如Scheme1所示。因此,開發合成具有立體控制和分子復雜性的環丁胺的新策略,具有重要意義。
雙環 [1.1.0] 丁烷(BCBs)已成為通過應變釋放驅動反應來合成不同類型(橋連)環丁烷的優勢構建模塊。然而,開發用于環丁胺合成的模塊化反應仍然具有挑戰性。于是作者提出了一種路易斯酸催化策略:通過路易斯酸催化雙環 [1.1.0] 丁烷與三嗪烷的 (3+2+2) 環加成/開環策略,實現環丁胺的立體控制合成。
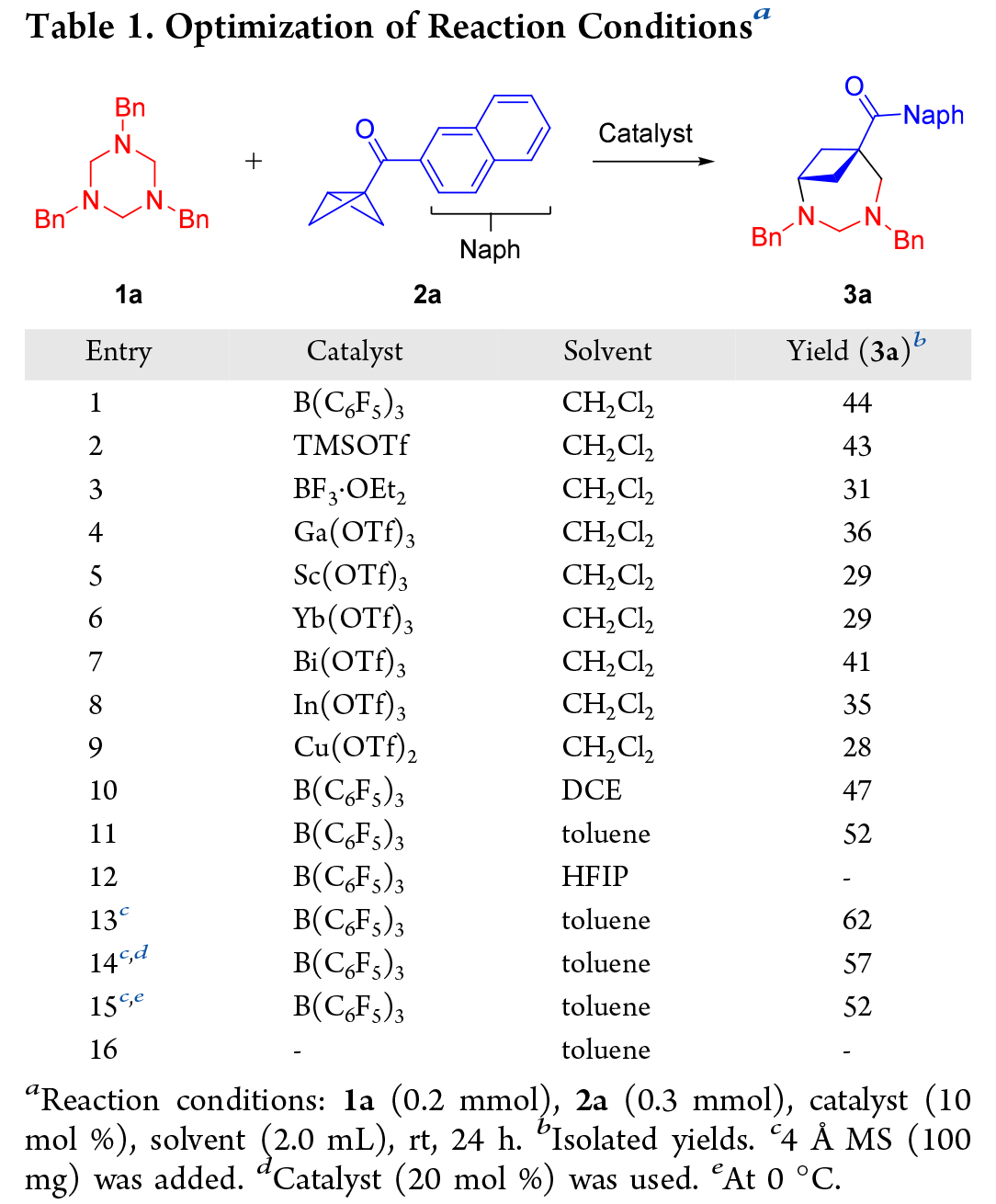
接下來作者選擇N-Bn三嗪烷 1a 和 2-萘基BCB酮2a作為模板底物,發現室溫下,在二氯甲烷 (CH2Cl2) 中以 B(C6F5)3 作為催化劑反應 24 小時,可以得到 (4+3) 的環加合物 3a(Table 1,entry 1)。隨后篩選了多種路易斯酸催化劑(Table 1,entry 2-9),仍然是B(C6F5)3作為催化劑更好。隨后,對幾種溶劑進行了評估,發現甲苯效果更佳(Table 1,entry 10-12)。進一步優化了各種其他反應參數,例如添加劑、催化劑當量和溫度(Table 1,entry 13-15)。最后,最佳條件確定為在室溫下在甲苯中加入 10 mol % 的B(C6F5)3作為催化劑和 4? MS 作為添加劑,產物 3a 的產率為 62%(Table 1,entry 13)。該條件中的關鍵改進是添加了4?分子篩 (4? MS) 以防止三嗪烷 1a 水解。
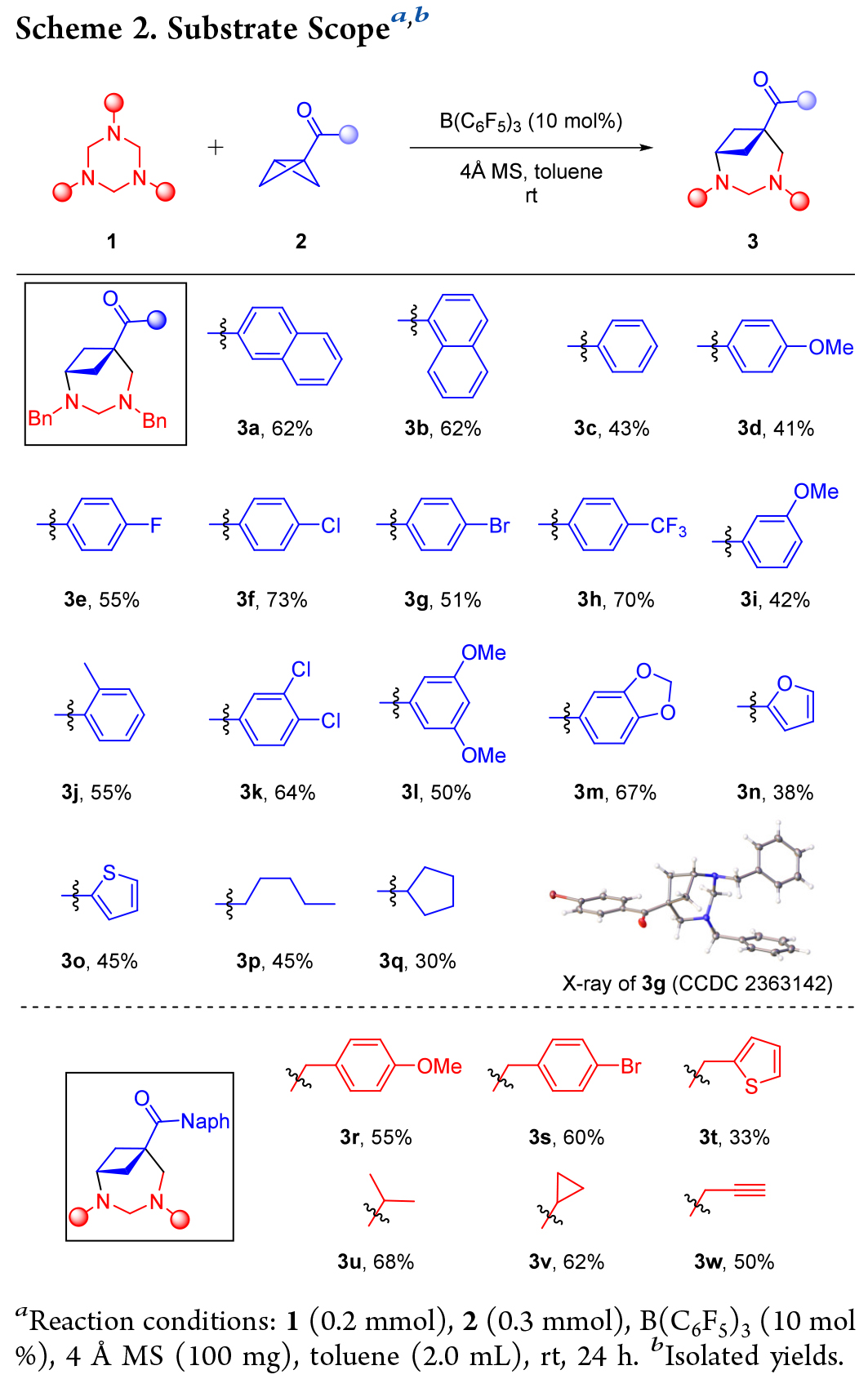
作者在確定了最佳反應條件后,首先對雙環 [1.1.0] 丁烷(BCBs)的底物適用范圍進行了研究(Scheme 2,上部)。1-萘基、苯基以及苯環任意位置帶有單個供電子(甲基、甲氧基)或吸電子(鹵素、三氟甲基)取代基的BCB酮都能以中等至良好的產率生成目標產物(3c - j)。此外,多取代芳基和雜芳基(呋喃、噻吩)、烷基取代的BCB酮也適用于該反應(3k - q)。進一步探索了三嗪烷的應用范圍(Scheme 2,下部)。其他幾種帶有給電子(甲氧基)、吸電子(溴)或雜芳族(噻吩)基團的N-芐基三嗪烷以及三嗪烷N原子上引入烷基、炔基都得到了很好的應用(3r - w)。
接下來,作者將注意力轉向闡明環加成反應機理。當使用 N-PMP(對甲氧基苯基)三嗪烷 1b 與 2a 反應時(Scheme 3A), 分離出三種主要產物,目標產物3x、環丁胺 4b和氮雜雙環 [2.1.1] 己烷5b,而未檢測到環丁烯胺 6b。這一結果證實了三嗪烷與路易斯酸活化的 BCB 酮發生類SN2 親核加成反應的可能性更大;其次,5b 的形成表明環加成可能通過逐步 (3+2+2) 而不是 (4+3) 過程進行。隨后進行了幾個控制和氘標記實驗。1a 和 1c 與 2a 的競爭反應產生了四種可分離產物,包括 3a、3r 和兩個交叉環加成物 3y/3y′(Scheme 3B)。
此外,[D6]-1a 與 2a 的反應生成完全氘化產物 [D4]-3a(Scheme 3C,頂部)。用 2a 與 1a 和 [D6]-1a 反應后,生成不可分離的混合物,其中含有 [D2]-3a,經 HRMS 分析檢測(Scheme 3C,底部)。這些結果表明,aza-BCO的形成是通過 (3+2+2) 路徑,而非 (4+3) 環加成途徑。
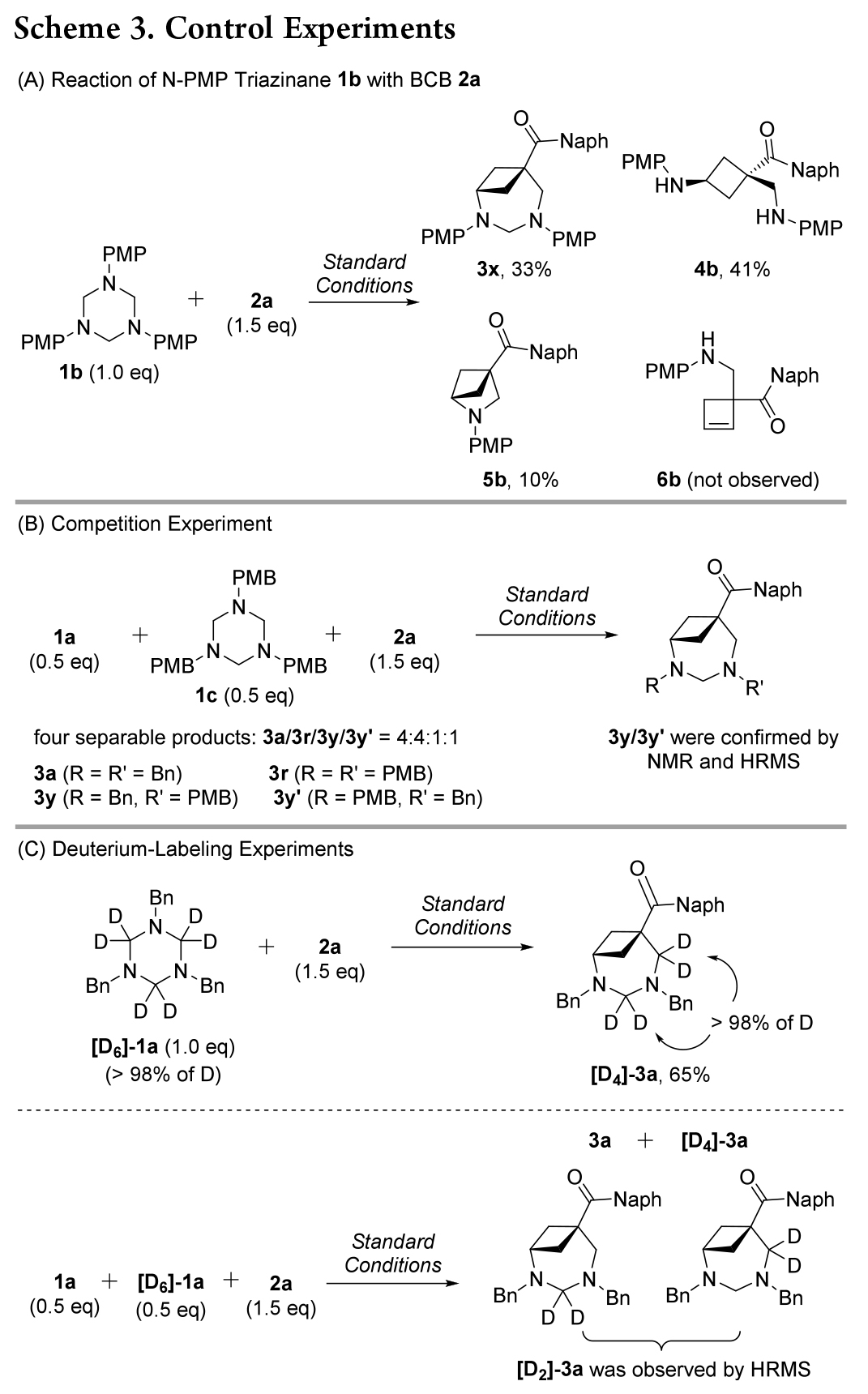
根據以上結果,作者提出了一種可能的機理(Scheme 4)。首先,B(C6F5)3 活化2a 形成復合物 I。然后,甲醛亞胺(由三嗪烷 1a 原位生成)與 I 進行類 SN2親核加成,生成中間體 II。隨后與另一分子甲醛亞胺反應生成中間體 III。最后,分子內環化釋放 B(C6F5)3 催化劑,生成產物 3a。對于中間體 II,與烯醇鹽對亞胺基團的分子內進攻相比,更傾向于另一種甲醛亞胺的分子間加成(III vs 5a),這可能是由于甲醛亞胺的 Bn-N 原子的親核性高于烯醇鹽。因此,當使用親核性較低的N-PMP甲醛亞胺時,中間體 II′的分子內環化(路徑 b)與另一個 N-PMP 甲醛亞胺與 II′的分子間加成(路徑 a)發生競爭,同時生成產物 5b 和 3x。
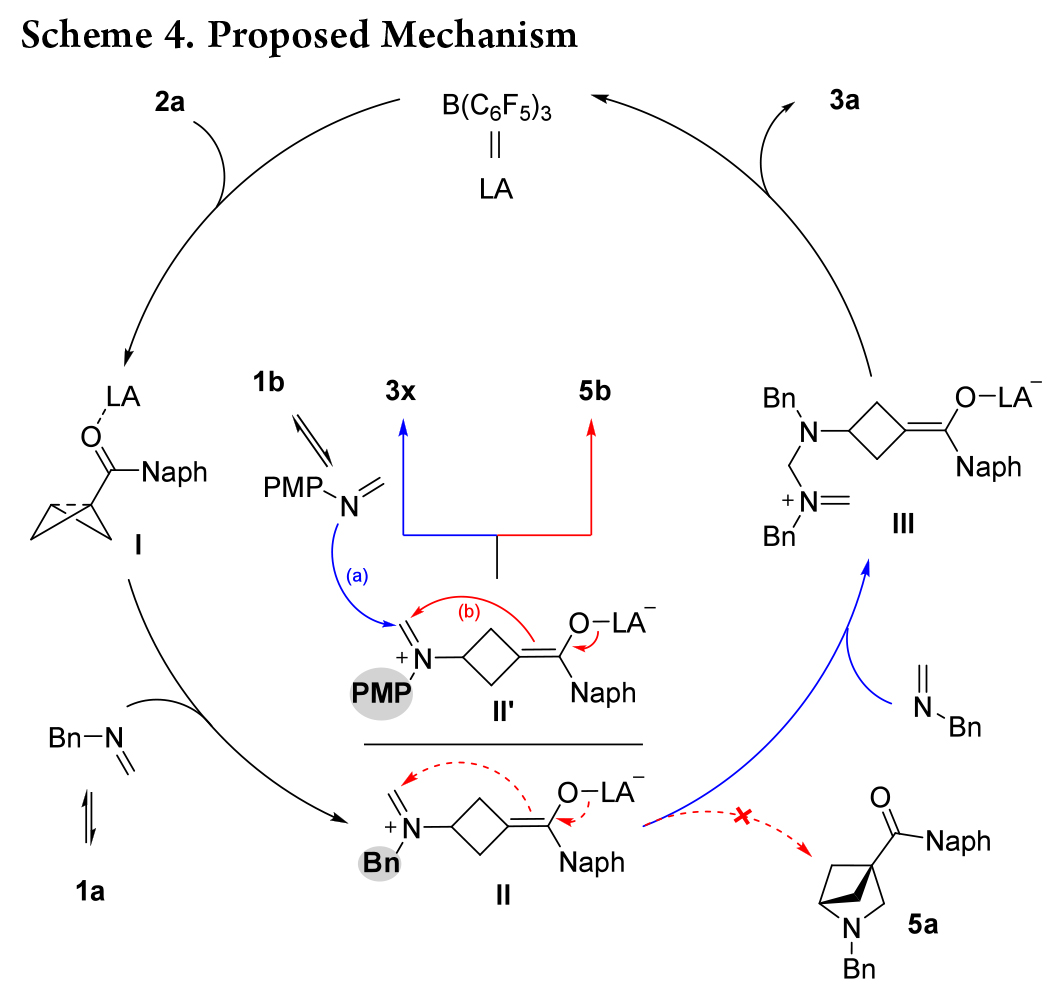
隨后作者將重點放在了氮雜-雙環 [4.1.1] 辛烷(aza-BCOs)的開環上(Scheme 5)。在酸性條件下,縮醛胺基團的斷裂被證明是可行的,3a高效地轉化為相應的環丁胺 4a,產率為 97%。作者選擇了Scheme 2 中一系列的aza-BCOs,均成功以優良產率轉化為環丁胺4c - j(Scheme 5A)。此外,這種“環加成/開環”過程可以一鍋法進行。
N-Bn三嗪烷1a與BCB酮 2a 在標準條件下的反應完成后,直接用酸處理,盡管反應時間更長,且酸性更強的條件下進行(Scheme 5B),仍成功得到環丁胺 4a,產率為 49%。此外,作者發現 3x 不穩定,在硅膠或CDCl3中會分解為環丁胺4b,因此一鍋法更適合N-PMP三嗪烷1b與2a的反應,產物4b的產率為80%. 進一步改變胺上連接的芳基對反應沒有影響,產率在75-86%之間(4k - r)。
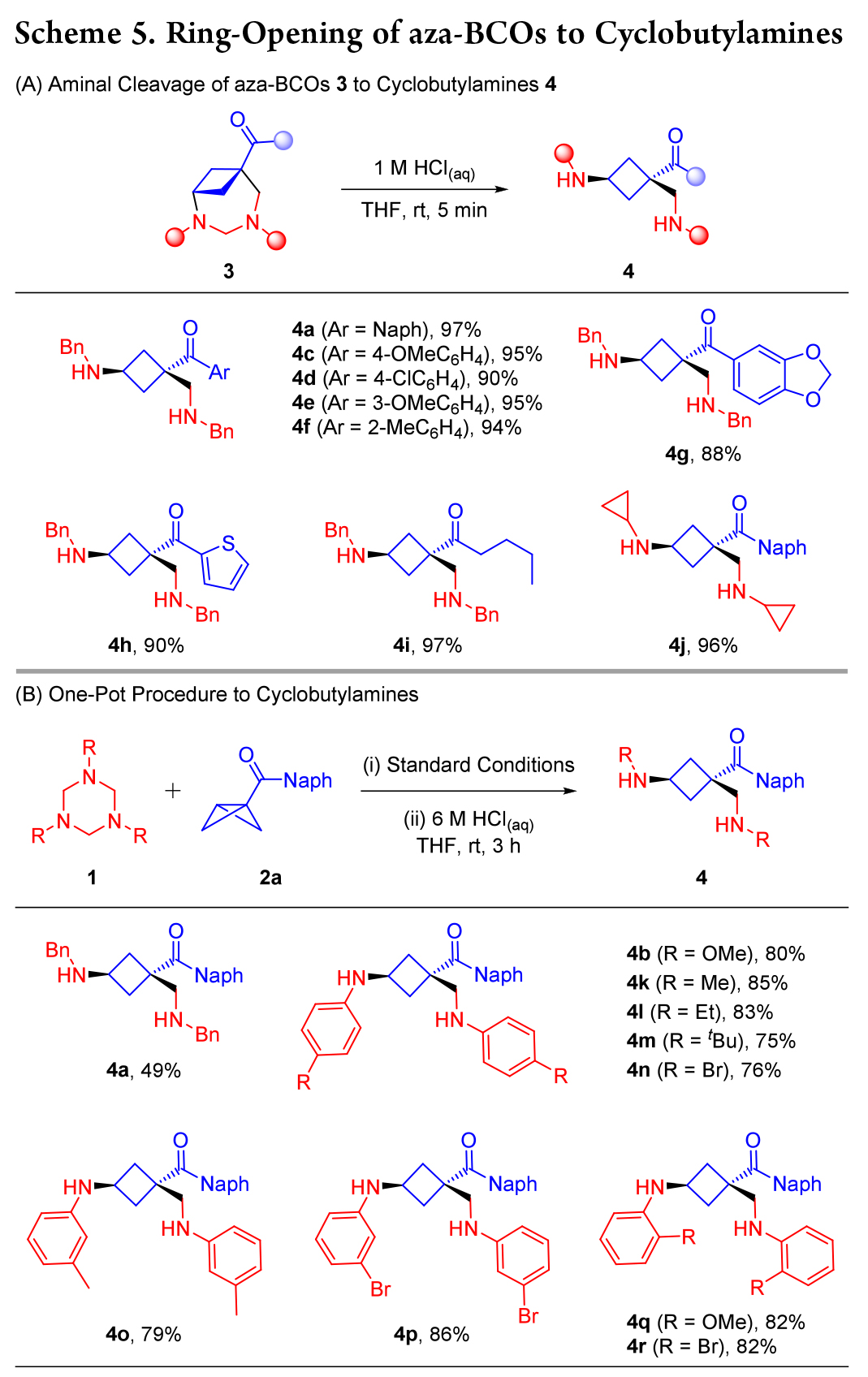
如Scheme 6 所示,在標準條件下,N-Bn 三嗪烷 1a 與 BCB 酮 2a 發生大量反應,隨后經酸處理,生成環丁胺 4a,產率為 50%,進一步證明了該策略的穩定性。所得產物 4a 可用作各種轉化的載體,通過縮合 (7)、Wittig 烯化 (8)、還原 (9) 和烯丙基化 (10) 獲得各種功能化的環丁烷骨架。這些轉化證明了該策略的潛在合成效用。
總結
作者簡介
五邑大學藥學與食品工程學院彭士勇課題組成立于2017年,研究方向為金屬有機化學,不對稱合成。現已在ACS Catal., Org. Lett., J. Org. Chem.等期刊發表相關學術論文30余篇,主持國家自然科學基金,廣東省自然科學基金、廣東省教育廳、五邑大學高層次人才項目5項,詳見課題組主頁:https://www.x-mol.com/groups/peng_shiyong
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn