

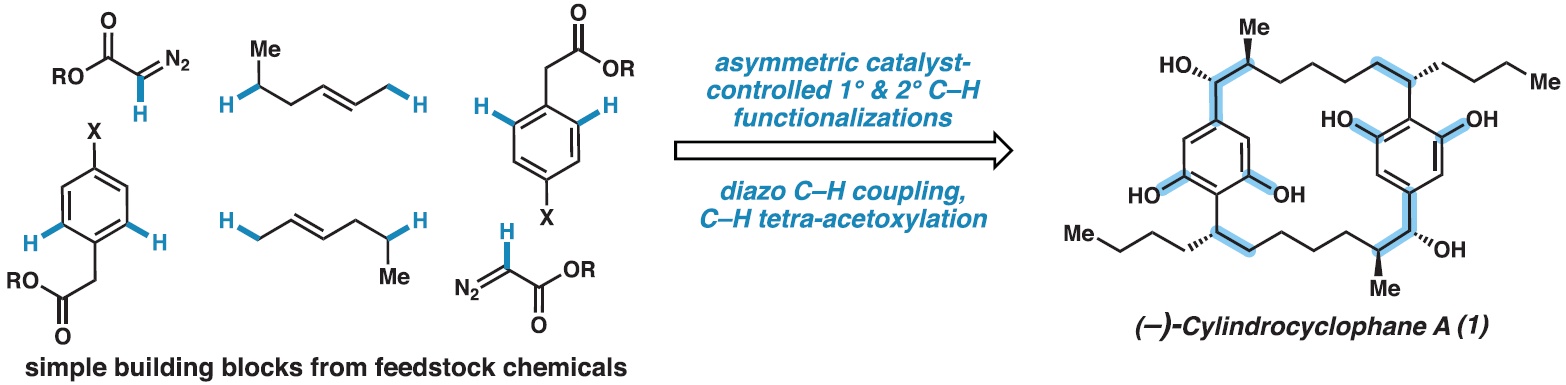
正文
C-H鍵廣泛存在于藥物合成的前體分子中,但它們通常是比較惰性的。在過去的二十年里,催化技術的快速發展使得C-H鍵的直接官能團化成為可能。(?)-Cylindrocyclophane A是一種22元C2-對稱的[7.7]對二苯撐環烷烴,其具有雙間苯二酚官能團和六個立體中心。而利用C-H官能團化策略實現(?)-cylindrocyclophane A的全合成則具有很大的挑戰性。近日,美國埃默里大學Huw M. L. Davies課題組與美國加州理工學院Brian M. Stoltz課題組借助10個C-H官能團化反應,以良好的對映選擇性和效率以17步實現了(?)-cylindrocyclophane A的全合成(Fig. 1)。歡迎下載化學加APP到手機桌面,合成化學產業資源聚合服務平臺。
(圖片來源:Science)
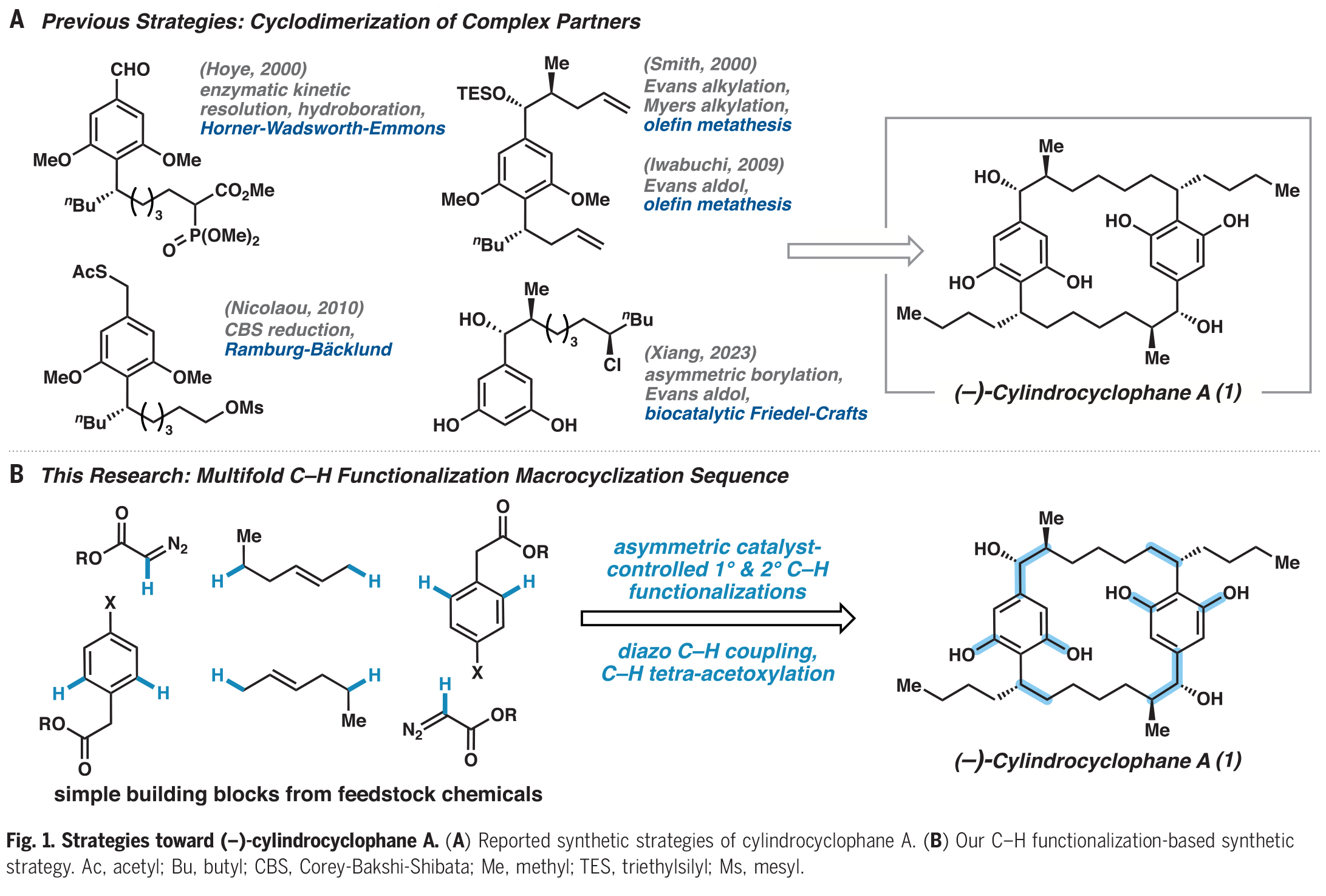
將C-H官能團化邏輯結合到(?)-cylindrocyclophane A的逆合成分析中,作者認為可以通過幾種不同尋常的轉化來快速簡化分子(Fig. 2)。作者假設1可以通過雙酰胺2中的每個Weinreb酰胺部分加入適當的親核試劑得到。在后期通過二苯撐環烷烴3中四重Weinreb酰胺導向的C-H乙酰氧基化引入2,6-間苯二酚,從而降低分子的復雜性并調節了芳基的反應性。大環3中C1上的乙酸酯基和C7上的芐基酰胺可以逆推到一個正交保護的大環四酯化合物4。作者發現利用銠(II)催化的二級C(sp3)-H官能團化可以在天然產物中構建鄰近的立體中心,并作為C-C鍵構建和大環化的關鍵策略。這些轉化可以得到重氮酯5,其可以由鈀催化重氮乙酸酯與芳基鹵化物6的C-H官能團化反應來制備。最后,作者認為芳基鹵化物6可以由銠(II)催化伯胺的C?H官能團化反應得到。
(圖片來源:Science)
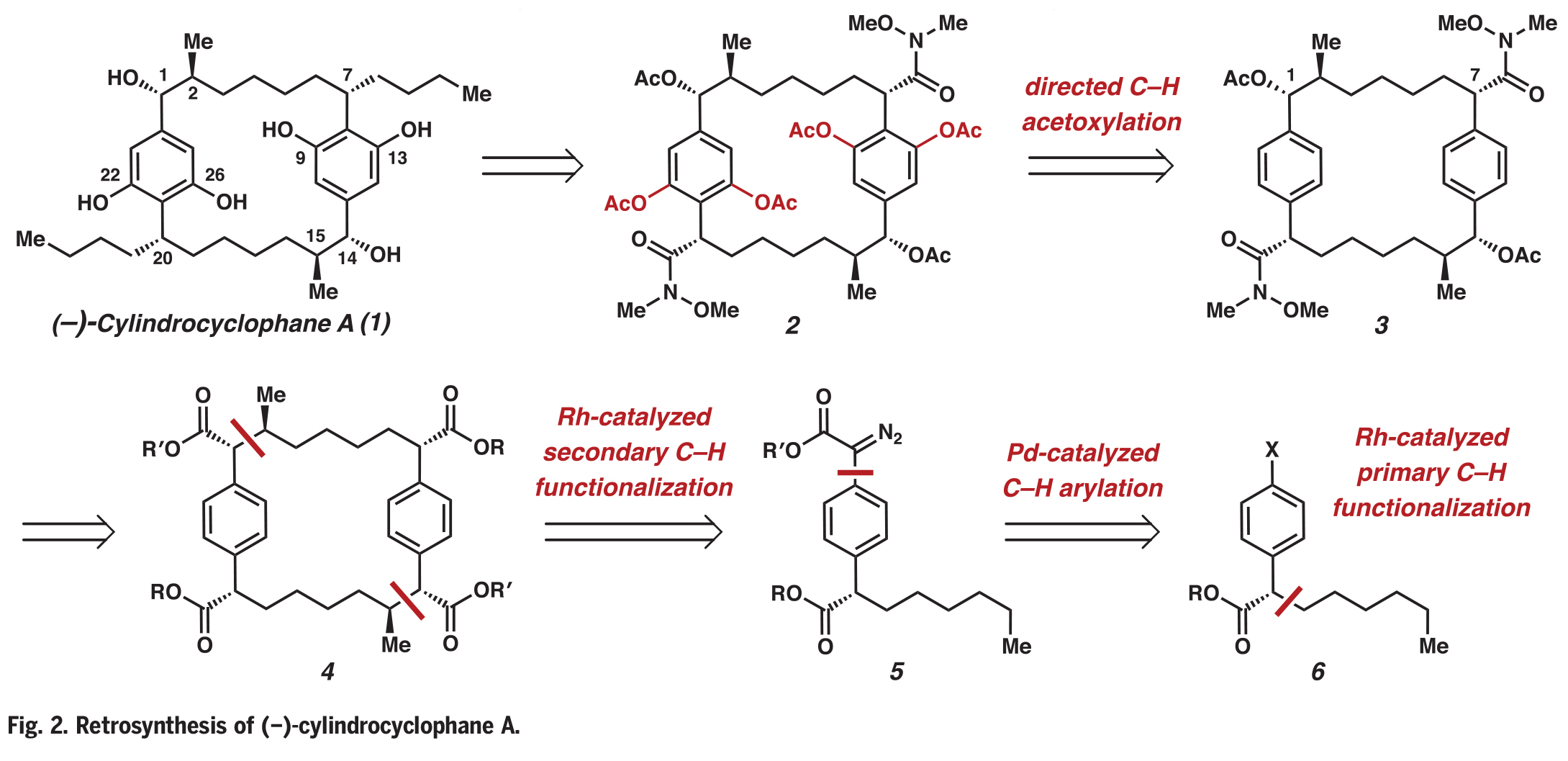
合成過程如下:首先,作者利用已報道的芳基重氮乙酸酯7和反式2-己烯8進行選擇性一級碳氫官能團化(Fig. 3A)。當使用具有立體位阻的Rh2(R-p-PhTPCP)4催化劑時,該反應具有較高的區域選擇性和對映選擇性。該催化劑可以在較小立體位阻的C-H鍵上進行反應,以73%的產率、96% ee在C20上實現官能團化。使用Crabtree催化劑進行反式烯烴9的加氫反應可以以定量產率得到碘化物10。作者還試圖通過正己烷的官能化直接獲得10,但是此過程得到了分別經歷伯和仲C-H官能化反應的不可分離的混合物。將碘化物10與重氮酯11進行鈀催化的C(sp2)-C(sp2)交叉偶聯,可以以88%的產率得到芳基重氮乙酸酯12。接下來,作者將注意力集中到C?H官能團化過程,從而構建[7.7]對二苯撐環烷烴骨架。
接下來,作者利用芳基重氮乙酸酯12,Rh2(R-2-Cl-5-BrTPCP)4和三當量的10生成的芳基碘化物13(產率68%,dr = 19:1)。雙芳烴中間體13通過C-H官能團化又進行了一次鈀催化的交叉偶聯,以77%的產率得到了大環化前體14。用Rh2(R-2-Cl-5-BrTPCP)4與重氮酯14發生大環化過程,可以以70%的產率生成大環15的兩個立體對映體(C14-C15)。此轉化具有很高的不對稱誘導效果(> 30:1 dr),但具有較低的非對映控制(8:1 dr)。與芳基碘化物13的形成相比,大環化的總體非對映選擇性較低的原因是由于Horeau效應,其中不完全的不對稱誘導產生的是非對映體混合物而不是對映體混合物。此外,此過程單次可單次制備> 1.2 mmol的大環15,并可以通過重結晶分離為單一的非對映體。
(圖片來源:Science)
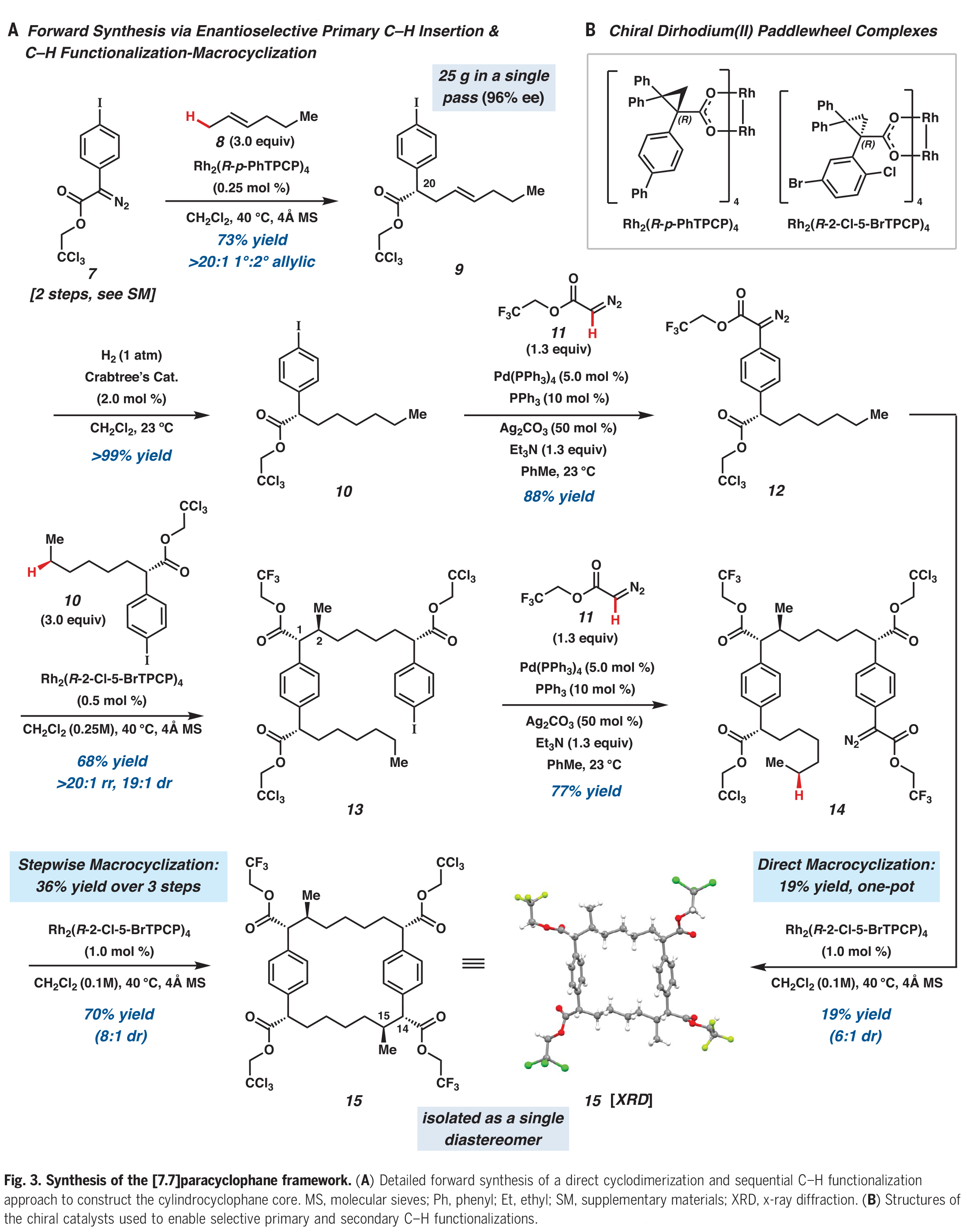
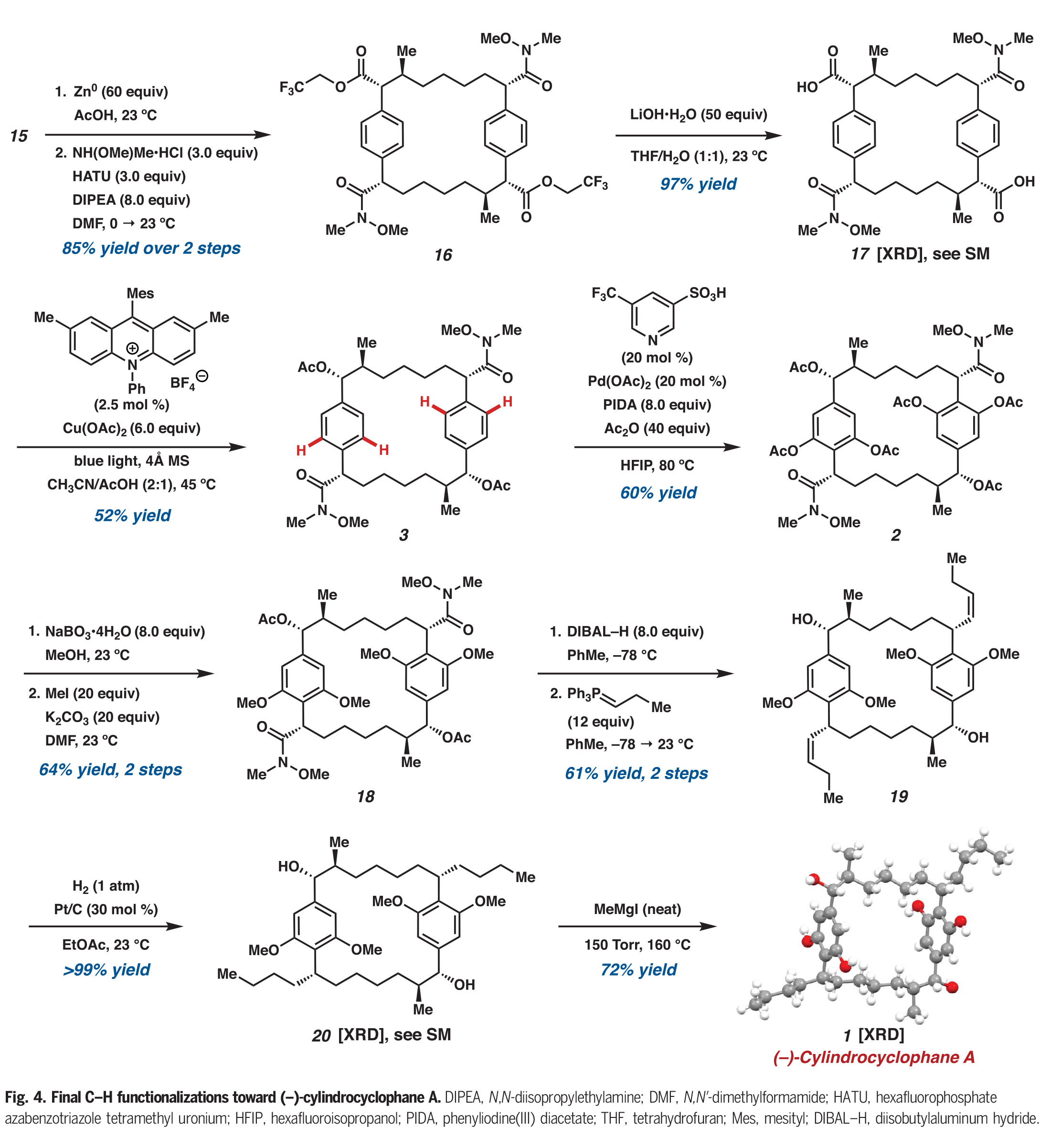
在構建了大環骨架后,大環15中的三氯乙酯被化學選擇性地轉化為雙weinreb酰胺16(Fig. 4)。隨后將剩余的三氟乙酯水解得到雙羧酸17,再進行光催化的脫羧乙酰氧基化得到醋酸雙芐酯3。在此階段,作者進行了合成中最后的C-H官能團化反應,即大環3與的四個C(sp2)-H乙酰氧基化,這種轉化只有在余金權小組所發展的反應條件下才能實現。在單次轉化中,酰胺導向3的四個C(sp2)-H乙酰氧基化可以以60%的產率得到大環2,此轉化標志著所有所需的C-H官能團化步驟的完成。
完成此合成的最后一個挑戰是安裝兩個丙基側鏈。作者發現通過酚類乙酸酯的化學選擇性脫酰化,隨后通過甲基化產生四甲基醚18。用DIBAL處理大環18可以使剩余的乙酸酯發生還原斷裂,且兩個Weinreb酰胺會被還原為相應的醛。這些醛可以直接進行Wittig烯烴化,以單一的烯烴異構體得到雙烯烴19。最后,雙烯烴19通過加氫得到20,并在Hoye課題組報道的條件下通過去甲基化得到(?)-cylindrocyclophane A。
(圖片來源:Science)
總結
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn