



正文
手性三級(jí)醇廣泛存在于藥物及天然產(chǎn)物中,也是合成化學(xué)和藥物化學(xué)中的重要骨架,因此該類(lèi)化合物的合成吸引了化學(xué)家的廣泛關(guān)注。有機(jī)金屬試劑對(duì)酮的不對(duì)稱(chēng)親核加成被認(rèn)為是構(gòu)建手性三級(jí)醇最直接有效的方法之一。傳統(tǒng)的有機(jī)金屬試劑,如有機(jī)鋅、有機(jī)鎂和有機(jī)鋁試劑等,存在對(duì)空氣和水分敏感、官能團(tuán)耐受性差等缺點(diǎn)。有機(jī)硼化合物因其廉價(jià)易得、結(jié)構(gòu)穩(wěn)定和官能團(tuán)耐受性廣被認(rèn)為是理想的親核試劑。目前報(bào)道的有機(jī)硼化合物和酮的反應(yīng)歷程可以歸納為以下兩種路徑:1)有機(jī)硼化合物和過(guò)渡金屬通過(guò)轉(zhuǎn)金屬化生成含碳金屬鍵的活性物種,隨后該物種對(duì)酮進(jìn)行加成得到目標(biāo)產(chǎn)物,但該反應(yīng)通常需要貴金屬催化或底物為活化酮類(lèi)化合物;2)零價(jià)鎳和酮發(fā)生氧化環(huán)化,隨后和有機(jī)硼化合物發(fā)生轉(zhuǎn)金屬化和還原消除得到目標(biāo)產(chǎn)物,該類(lèi)型反應(yīng)需要使用空氣敏感的零價(jià)鎳。鑒于手性三級(jí)醇的重要性,亟需開(kāi)發(fā)一種通用且簡(jiǎn)單高效的合成方法來(lái)實(shí)現(xiàn)手性三級(jí)醇的制備。
上海交通大學(xué)張萬(wàn)斌教授課題組長(zhǎng)期致力于過(guò)渡金屬催化有機(jī)硼化合物參與的加成反應(yīng)研究,并實(shí)現(xiàn)了過(guò)渡金屬催化有機(jī)硼化合物對(duì)多種具有挑戰(zhàn)性不飽和化合物的加成反應(yīng)(例如:CCS Chem., 2019, 1, 623-631; Nat. Commun., 2018, 9, 2258; Chem. Commun., 2017, 53, 609-612; Org. Lett., 2016, 18, 288-291; Org. Lett., 2015, 17, 2250-2253; Angew. Chem. Int. Ed., 2013, 52, 7540-7544)。基于手性三級(jí)醇的重要性和課題組的研究興趣,作者希望發(fā)展一種高效的方法來(lái)實(shí)現(xiàn)有機(jī)硼化合物對(duì)酮的不對(duì)稱(chēng)加成以構(gòu)建手性三級(jí)醇。
Petasis反應(yīng)中有機(jī)硼化合物可以通過(guò)形成硼鹽絡(luò)合物的形式將取代基遷移至亞胺陽(yáng)離子進(jìn)而生成官能團(tuán)化的胺類(lèi)化合物。該反應(yīng)存在原料易得,操作方便和反應(yīng)條件溫和等優(yōu)點(diǎn),但反應(yīng)僅局限于對(duì)亞胺的加成。受Petasis反應(yīng)的啟發(fā)并了解到過(guò)渡金屬可以和烯烴配位,從而促進(jìn)硼鹽絡(luò)合物上取代基對(duì)C=C鍵發(fā)生遷移,作者設(shè)想過(guò)渡金屬可以與手性配體配位形成手性催化劑,該催化劑可以作為L(zhǎng)ewis酸與芳基酮配位以活化羰基并提供手性環(huán)境,并且可以作為橋連接芳基酮和有機(jī)硼酸衍生物以促進(jìn)1,5-遷移,進(jìn)而實(shí)現(xiàn)對(duì)酮的不對(duì)稱(chēng)加成反應(yīng)。
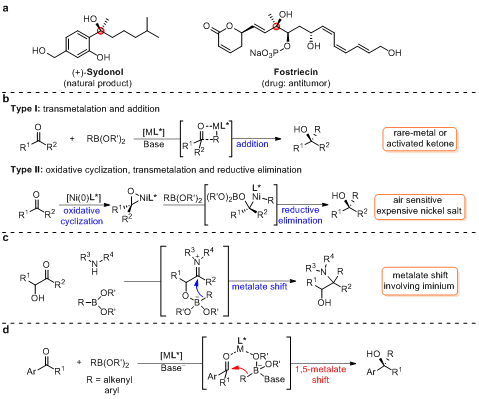
圖1:含手性三級(jí)醇結(jié)構(gòu)的藥物和天然產(chǎn)物,過(guò)渡金屬催化有機(jī)硼對(duì)酮的加成反應(yīng),Petasis反應(yīng)和課題設(shè)計(jì)
在確定了反應(yīng)的最優(yōu)條件后,作者以苯乙烯基硼酸為親核試劑對(duì)芳基酮底物的普適性進(jìn)行了考察,當(dāng)芳基酮芳環(huán)上連有給電子取代基或吸電子取代基時(shí)(3a–3r),反應(yīng)均可順利進(jìn)行,并給出優(yōu)秀的反應(yīng)結(jié)果(71%–99% yield,81%–99% ee);對(duì)于雜芳基甲基酮(3s–3u),特別是更具挑戰(zhàn)性的吡啶甲基酮(3v, 3w)和喹啉甲基酮(3x, 3y),以及其它的芳基烷基酮(3z–3ae),均以中等到優(yōu)秀的結(jié)果得到相應(yīng)的手性三級(jí)烯丙醇(53%–91% yield, 76%–97% ee)。并且該方法還適用于芳基酮的不對(duì)稱(chēng)芳基化,并以?xún)?yōu)異的結(jié)果制備了一系列手性二芳基醇化合物(5a–6e, 69–98% yield, 80%–97% ee)。

圖2:底物的普適性考察
鑒于該反應(yīng)良好的底物適用性,作者嘗試將該反應(yīng)應(yīng)用于藥物或天然產(chǎn)物的后期修飾中(圖3a)。一系列含有芳基烷基酮結(jié)構(gòu)的藥物或天然產(chǎn)物,如薩利麝香,氮哌酮,鹽酸達(dá)克羅寧,依巴斯汀,氟哌啶醇均可以?xún)?yōu)異的收率和對(duì)映選擇性給出相應(yīng)的烯基化產(chǎn)物(7a–7f, 70–83% yield, 89–94% ee)。最后,為了進(jìn)一步驗(yàn)證所開(kāi)發(fā)方法的實(shí)用性,作者將所開(kāi)發(fā)方法應(yīng)用于天然產(chǎn)物和藥物的合成中,極大的縮短了相關(guān)天然產(chǎn)物和藥物的合成路線(xiàn)(圖3c)。

圖3:藥物的后期修飾及應(yīng)用
為了驗(yàn)證反應(yīng)機(jī)理,作者設(shè)計(jì)了一系列控制實(shí)驗(yàn)。首先,為了探究該反應(yīng)是否通過(guò)有機(jī)硼化合物與鎳鹽發(fā)生轉(zhuǎn)金屬形成含C-Ni鍵的絡(luò)合物,進(jìn)而對(duì)酮加成生成目標(biāo)產(chǎn)物(圖1b, Type I),作者以苯乙烯基溴(11)代替苯乙烯基硼酸為底物,在Ni(COD)2催化下原位生成苯乙烯基鎳物種,并和苯乙酮反應(yīng)(圖4a)。結(jié)果表明沒(méi)有加成產(chǎn)物的生成,只有苯乙烯基和溶劑三氟乙醇偶聯(lián)的副產(chǎn)物12,該副產(chǎn)物的生成說(shuō)明在反應(yīng)過(guò)程中生成了苯乙烯基鎳物種,但是該物種不能和酮進(jìn)行加成反應(yīng)。隨后作者制備了芳基鎳物種14,并在鹵素攫取劑的存在下和苯乙酮反應(yīng)(圖4b),仍未得到目標(biāo)產(chǎn)物。以上結(jié)果表明在該反應(yīng)中沒(méi)有生成烯基鎳或芳基鎳物種,排除了Type I所示的反應(yīng)歷程。隨后作者驗(yàn)證了所開(kāi)發(fā)的催化體系是否經(jīng)歷Ni(0)催化的歷程(圖1b, Type II)。當(dāng)使用Ni(COD)2替代Ni(II)在標(biāo)準(zhǔn)條件下進(jìn)行反應(yīng)(圖4c),獲得了與Ni(II)催化相似的反應(yīng)結(jié)果(86%, 94% ee vs 92%, 94% ee),接下來(lái)作者將Ni(0)催化體系中的溶劑由三氟乙醇換為環(huán)己烷(圖4d,上),然而并沒(méi)有觀(guān)察到目標(biāo)產(chǎn)物的生成。另外,在已報(bào)道Ni(0)催化有機(jī)硼化合物和酮反應(yīng)的條件下,僅改變配體為L8,也沒(méi)有目標(biāo)產(chǎn)物的生成。為了進(jìn)一步排除反應(yīng)經(jīng)歷Ni(0)催化的歷程,作者以對(duì)碘苯乙酮(1g)為底物,分別在Ni(0)和Ni(II)催化的條件下對(duì)反應(yīng)進(jìn)行考察(圖4e)。在Ni(0)催化的反應(yīng)條件下,除了生成目標(biāo)產(chǎn)物3g,還觀(guān)察到了芳基碘與Ni(0)氧化加成生成芳基鎳后質(zhì)子化的副產(chǎn)物3a,以及芳基鎳和溶劑三氟乙醇偶聯(lián)的副產(chǎn)物15,這兩種副產(chǎn)物的生成表明芳基碘和Ni(0)可以發(fā)生氧化加成生成芳基鎳物種,然而在Ni(II)催化的反應(yīng)條件下,并沒(méi)有觀(guān)察到副產(chǎn)物3a和15。這些結(jié)果表明在作者所開(kāi)發(fā)的反應(yīng)體系中不涉及零價(jià)鎳活性物種,而Ni(0)可以催化該反應(yīng)可能是因?yàn)镹i(0)與溶劑三氟乙醇發(fā)生氧化加成生成了鎳(II),反應(yīng)仍通過(guò)Ni(II)催化的歷程完成。最后,在反應(yīng)體系中加入自由基捕獲劑TEMPO(圖4f),反應(yīng)基本不受影響,表明該反應(yīng)不涉及自由基中間體。基于以上控制實(shí)驗(yàn)結(jié)果,作者提出該反應(yīng)可能經(jīng)過(guò)六元環(huán)過(guò)渡態(tài)(圖4g)。

圖4:控制實(shí)驗(yàn)
為了進(jìn)一步驗(yàn)證開(kāi)發(fā)的反應(yīng)是否經(jīng)歷所設(shè)想的路徑,作者進(jìn)行了DFT計(jì)算。計(jì)算結(jié)果支持作者設(shè)想的鎳催化有機(jī)硼對(duì)芳基酮的1,5-遷移歷程,并且當(dāng)配體亞甲基上的取代基由芐基替換為2-萘基和2-蒽基時(shí),反應(yīng)過(guò)渡態(tài)的活化能均有所降低(圖5a),該計(jì)算結(jié)果與實(shí)驗(yàn)結(jié)果相符。為了解釋配體亞甲基上的取代基為2-蒽基時(shí)反應(yīng)的收率和對(duì)映選擇性最優(yōu),作者進(jìn)行了IGMH分析。結(jié)果表明在該過(guò)渡態(tài)中存在C-H???π,O-H???π和F???π相互作用,這些相互作用降低了反應(yīng)活化能從而促進(jìn)反應(yīng)快速進(jìn)行。為了解釋鎳可以作為L(zhǎng)ewis酸催化該反應(yīng)而其它Lewis酸如Cu(II),Co(II),Zn(II)和Fe(III)不能催化該反應(yīng),作者以Zn(II)為例進(jìn)行了DFT計(jì)算。與BOX配體配位后鎳的空間構(gòu)型為平面四邊形,該空間構(gòu)型有利于Ni(II)與底物配位形成六元環(huán)過(guò)渡態(tài),從而促進(jìn)遷移過(guò)程的進(jìn)行。但是Zn(II)的空間構(gòu)型為四面體,配體和底物的空間位阻迫使Zn的空間結(jié)構(gòu)扭曲成平面四邊形,如TS-Zn(圖5d),這些扭曲致使該六元環(huán)過(guò)渡態(tài)不穩(wěn)定,進(jìn)而導(dǎo)致Zn(II)不能催化該反應(yīng)。
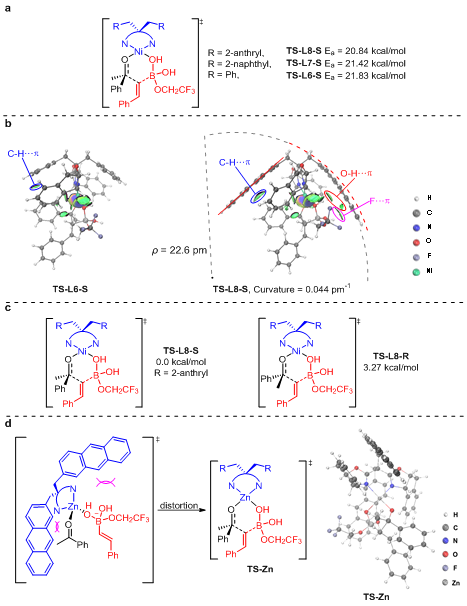
圖5:DFT計(jì)算
總結(jié)
第一作者:魏海鵬
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀(guān)點(diǎn)或證實(shí)其描述。若有來(lái)源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請(qǐng)作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話(huà):18676881059,郵箱:gongjian@huaxuejia.cn