



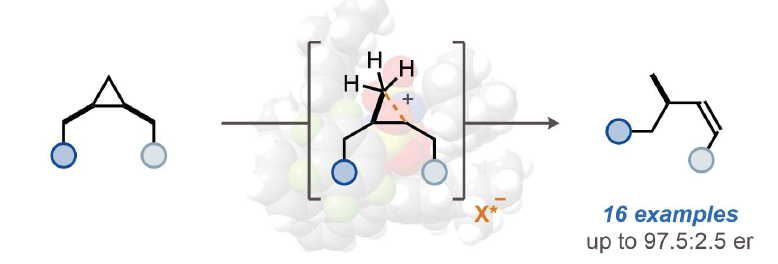
正文
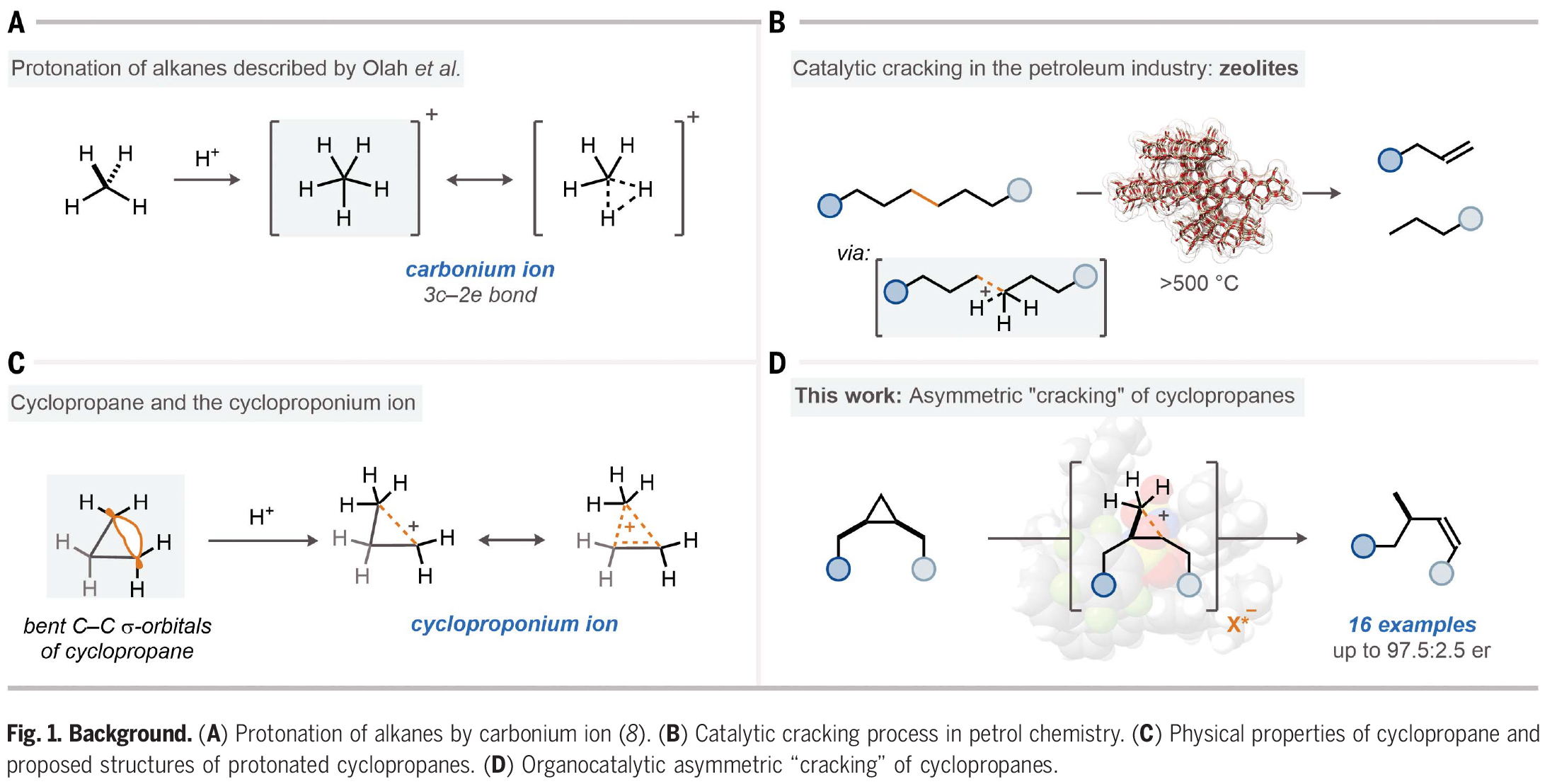
烷烴的立體選擇性活化是化學領域中一個長期存在的重大挑戰(zhàn)。雖然利用含金屬的酶來氧化烷烴具有顯著選擇性,但化學方法卻僅限于過渡金屬催化的C-H官能團化反應。烷烴可以經(jīng)歷質子化形成五配位的碳正離子,并在強Br?nsted酸的存在下可以解構成更小的碳氫化合物。然而,到目前為止,此類反應的催化立體控制版本還沒有實現(xiàn)。近日,日本北海道大學Nobuya Tsuji課題組與德國馬克斯·普朗克煤炭研究所Benjamin List課題組報道了一類手性酸,亞氨基二磷酸亞胺酯(imidodiphosphorimidates),其可以包裹住對稱的環(huán)丙烷并催化其開環(huán)重排,從而以高對映選擇性實現(xiàn)手性烯烴化合物的合成(Fig. 1)。歡迎下載化學加APP到手機桌面,合成化學產(chǎn)業(yè)資源聚合服務平臺。
(圖片來源:Science)
首先,作者以3-取代的雙環(huán)[3,1,0]己烷1a作為模板底物對反應進行了探索,并進行了條件優(yōu)化(Fig. 2)。通過一系列條件篩選作者得出當使用(S,S)-IDPi 7d (5 mol%),在MeCy(1.0 M)中,15 oC反應7天可以以84%的產(chǎn)率和96:4 er得到環(huán)烯烴產(chǎn)物2a。

(圖片來源:Science)
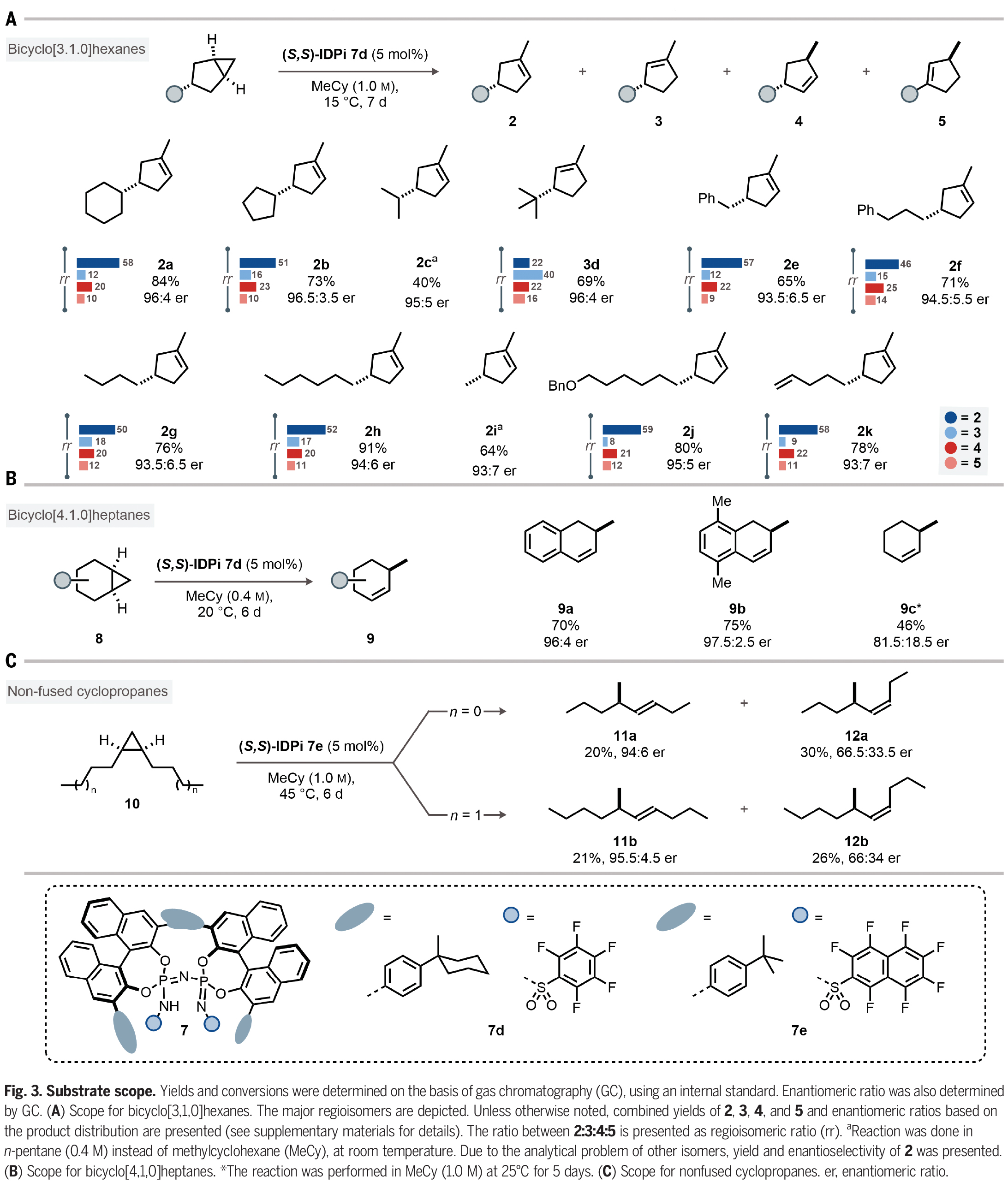
在得到了最優(yōu)反應條件后,作者對此轉化的底物兼容性進行了考察(Fig. 3)。實驗結果表明,在3-取代的雙環(huán)[3,1,0]己烷中,一系列環(huán)狀和鏈狀取代基均可兼容,以40-91%的產(chǎn)率,93:7-96.5:3.5的er得到環(huán)烯烴產(chǎn)物2a-2k。其中包括芐基、正丁基、甲基、芐氧基以及端烯等基團均可兼容(Fig. 3A)。此外,此方法同樣可以兼容取代的雙環(huán)[4,1,0]庚烷,以46-75%的產(chǎn)率和良好的對映選擇性得到相應的環(huán)烯烴產(chǎn)物9a-9c(Fig. 3B)。接下來,作者探索了非并環(huán)環(huán)丙烷10的反應性。由于其具有較大的靈活性,因此將更具挑戰(zhàn)性。事實上,IDPi催化劑7e能夠在高溫下活化1,2-二正丙基環(huán)丙烷(10a),產(chǎn)生手性二取代烯烴(11a, 12a)的混合物。其中(Z)-烯烴12a的產(chǎn)率為30%,對映選擇性66.5:33.5 er。(E)-烯烴11a的產(chǎn)率為20%,對映選擇性94:6 er。此外,1,2-二正丁基環(huán)丙烷(10b)也同樣具有良好的兼容性,以21%的產(chǎn)率得到11b(95.5:4.5 er)和26%的產(chǎn)率得到12b(66:34 er)。作者通過將11b和12b與對映體富集的樣品進行比較,確定了絕對構型(Fig. 3C)。
(圖片來源:Science)
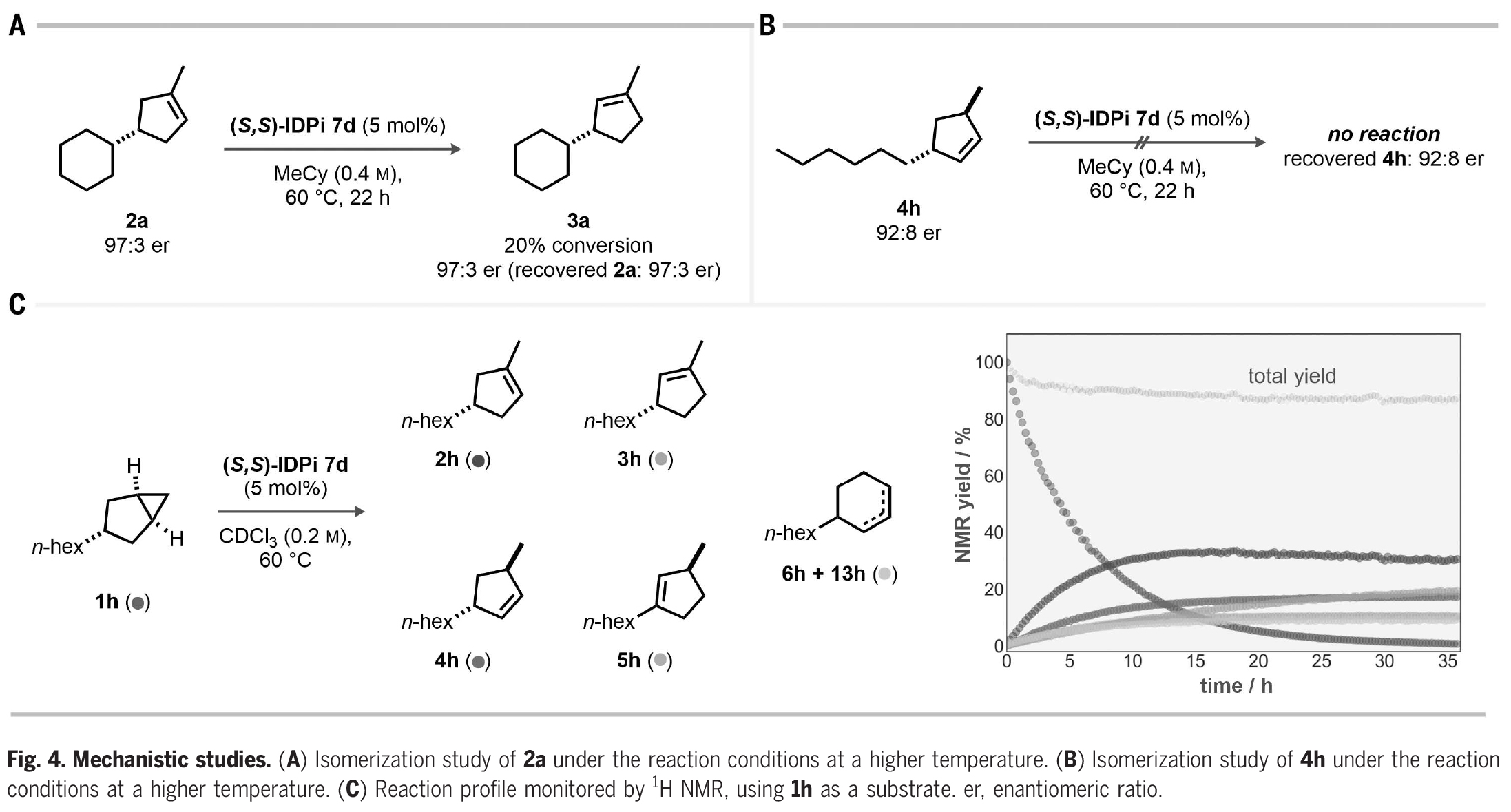
接下來,作者探索了此轉化的反應機理(Fig. 4)。一個主要的問題是,對映體選擇性是由所設計的不對稱質子化過程所控制的,還是在無意的動力學拆分下驅動產(chǎn)物的烯烴異構化。當使用三取代烯烴2a在催化劑7d存在下60 oC反應時,作者觀察到20%異構化得到3a,但2a和3a的對映體比例保持不變(Fig. 4A)。由于反應得到的3a的對映體比例低于2a,因此反應中3a是不太可能通過2a的異構化得到的。此外,雙取代烯烴4h在催化劑7d存在下,即使在高溫下也完全不反應。由此表明在反應條件下,4h的異構化既不能得到2h,也不能得到5h(Fig. 4B)。上述實驗結果進一步得到了核磁共振動力學研究的支持。在CDCl3中,60 oC反應1天后,產(chǎn)物4h、5h、6h和13h達到平穩(wěn)期,只有烯烴3h隨著2h的消耗而持續(xù)增加(Fig. 4C)。
(圖片來源:Science)
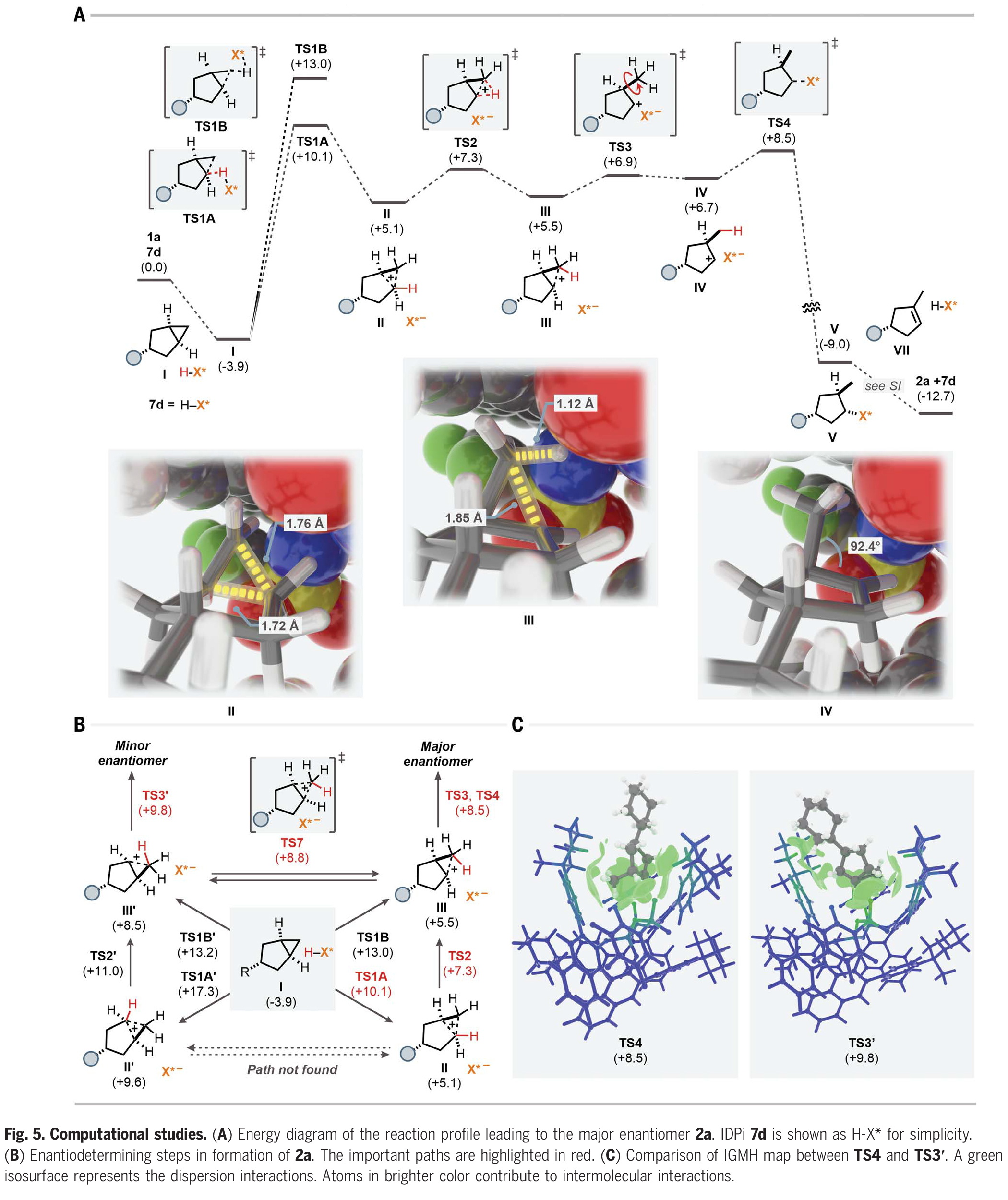
為了探索此轉化詳細的反應機理和對映選擇性的來源,作者利用催化劑7d和底物1a對反應途徑進行了DFT計算(Fig. 5A)。首先,底物將自身嵌入IDPi催化劑的“口袋”內(nèi),形成絡合物I。在形成絡合物后,底物被IDPi催化劑通過四種可能的途徑質子化:通過TS1A的質子化生成碳正離子中間體II;通過TS1B的質子化生成另一個非經(jīng)典碳正離子III;另一側通過TS1A'和TS1B'的質子化生成II'和III',最終得到產(chǎn)物2a的次要對映體(Fig. 5B)。從Fig. 5A的鍵長和鍵角可以看出II和III的碳正離子特性。總的來說,TS4和TS3'與相應的原始對映體決定步驟的能量差為1.3 kcal/mol,這與實驗結果(298.15 K時為1.7 kcal/mol)相吻合,這些中間體也可能通過重排和去質子化得到其他異構體。因此,根據(jù)異構體的不同,對映體選擇性會進一步增強或降低。最后,作者對TS4和TS3'的IGMH圖進行比較(Fig. 5C)。相互作用區(qū)域一般由綠色等值面組成,表明底物與BINOL取代基之間存在強烈的范德華相互作用,催化活性位點的雜原子誘導了靜電相互作用。此外,陰離子中的綠色部分突出了對分子間相互作用有主要貢獻的原子,表明催化活性位點中的雜原子以及脂肪族取代基通過非共價相互作用穩(wěn)定底物。此外,作者對質子化步驟TS1A、TS1B、TS1A'和TS1B'也進行了研究,發(fā)現(xiàn)畸變和相互作用對這一步驟的選擇性也起著重要的控制作用。
(圖片來源:Science)
總結
聲明:化學加刊發(fā)或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網(wǎng)聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn