




近日,云南大學(xué)醫(yī)學(xué)院尹敏課題組聯(lián)合中國科學(xué)院昆明植物研究所黃勝雄研究員課題組,在催化領(lǐng)域知名期刊ACS Catalysis上發(fā)表了題為“Uncovering the Parallel Biosynthetic Pathways of the Cyclohexanone and Phenol Rings in Cycloheximide and Actiphenol by Tailoring Redox Enzymes”的研究論文。該研究揭示了苯酚和環(huán)己酮在相同生物合成機制下形成的一種罕見且不同的級聯(lián)氧化還原機制,涉及由羧酸還原酶和CYP450協(xié)同催化PKS產(chǎn)物引發(fā)的分子內(nèi)羥醛縮合反應(yīng)。這一發(fā)現(xiàn)擴展了對天然藥物分子生物合成中氧化還原酶介導(dǎo)的酚和環(huán)己酮基團形成的理解,并為未來的組合生物合成新藥研發(fā)奠定了基礎(chǔ)。近年來,尹敏研究團隊以云南本地多種中草藥為研究對象,構(gòu)建了藥用植物內(nèi)生放線菌庫,通過多組學(xué)聯(lián)合運用高效發(fā)現(xiàn)了系列高潛力菌株,獲得了多個活性新天然產(chǎn)物,進而開展了生物合成機制的研究。
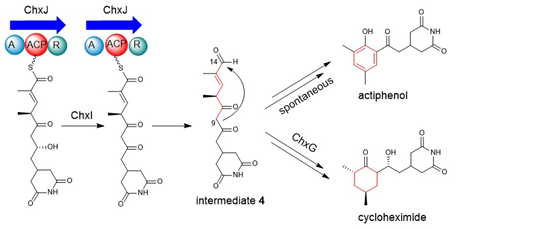
真核細(xì)胞翻譯抑制劑放線菌酮(cycloheximide, CHX)及其類似物放線菌酚(actiphenol, APN)都具有特殊的戊二酰亞胺結(jié)構(gòu)和六元碳環(huán)側(cè)鏈基團。APN與CHX的區(qū)別在于其含有芳香酚環(huán)而非環(huán)己酮基團。在前期的天然產(chǎn)物發(fā)現(xiàn)工作中,作者注意到多株產(chǎn)生CHX的菌株能夠同時發(fā)現(xiàn)有APN的產(chǎn)生(Highet et al. Helv Chim Acta, 1959;Rao et al. J Org Chem, 1960;Huang et al. J Antibiot, 2011;Liu et al. Front Microbiol,2022)。基于這一現(xiàn)象,作者團隊推測CHX和APN可能通過同一生物合成途徑進行合成(Yin et al. Org Lett, 2014),并提出了后修飾苯環(huán)脫芳可能是形成這兩種化合物的關(guān)鍵機制。然而,這一假設(shè)主要得到了chxG或chxH基因敲除實驗的支持,而缺乏相應(yīng)的體外實驗證據(jù)(圖1B)。此外,由于常溫常壓下苯環(huán)難以實現(xiàn)脫芳化,六元碳環(huán)的形成機制仍存在不確定性。為了更深入地理解CHX和APN中兩個不同基團的生物合成機制,作者選擇了菌種庫中能同時大量產(chǎn)生這兩種化合物的藥用植物內(nèi)生放線菌Streptomyces sp. YINM00100作為研究對象,對其生物合成基因簇進行了詳細(xì)分析(圖1A)。研究發(fā)現(xiàn),四種后修飾酶:烯酰還原酶(ChxG)、酮還原酶(ChxH)、細(xì)胞色素P450 (ChxI)和三結(jié)構(gòu)域羧酸還原酶(ChxJ)可能參與新生聚酮中間體3的后修飾(圖1B)。
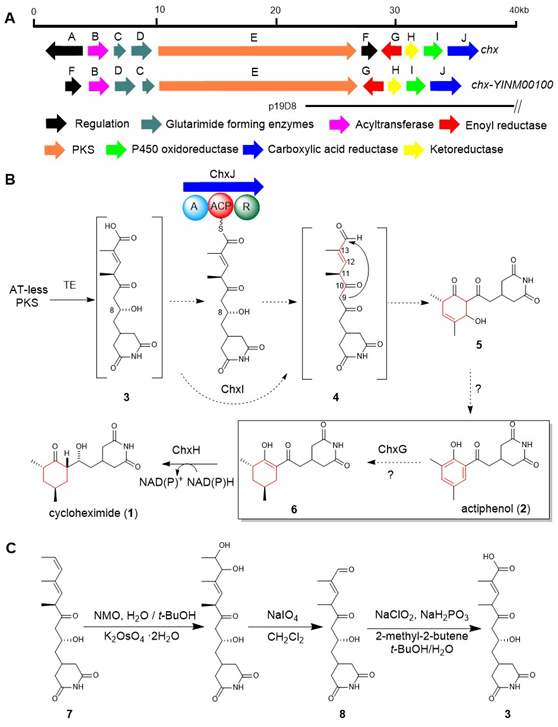
圖1:(A) chx和chx- YINM00100 BGC的基因簇比較。(B)前期研究提出的CHX和APN的生物合成途徑。(C)由化合物7化學(xué)合成化合物3和8
在先前的研究中,作者通過體內(nèi)敲除chxE、chxJ、chxI、chxG和chxH基因來探究它們在生物合成途徑中的作用。除了ChxH外,其他三種酶的體外功能尚未確定。在本研究中,作者構(gòu)建了chxJ、chxI和chxG基因敲除突變株,證明了chxJ和chxI在CHX和APN的生物合成中都起著重要作用,此外,菌株YINM00100的基因組中可能存在一個類似的基因可以補償chxG的功能(圖2A)。通過大規(guī)模發(fā)酵菌株Streptomyces himastatinicus ATCC 53653獲得了足量的9-methylstreptimidone(化合物7),并通過化學(xué)合成得到了化合物3(圖1C)。接下來通過酶學(xué)實驗證明ChxJ能夠以3為底物,以ATP和NADPH為輔助因子生成化合物8。用氧化劑DMP處理了中間體8,大部分底物轉(zhuǎn)化為APN,但沒有轉(zhuǎn)化為中間體5,這表明8中的C-8羥基氧化導(dǎo)致自發(fā)環(huán)化,然后芳構(gòu)化生成APN(圖2B)。綜上得出,ChxJ的A結(jié)構(gòu)域激活并加載3到ACP上,接著ChxI將3-S-ACP中的C-8羥基氧化,最后由ChxJ的R結(jié)構(gòu)域還原硫酯鍵獲得化合物4,最后通過自發(fā)地分子內(nèi)羥醛縮合和脫水芳構(gòu)化形成APN(圖2C和1B)。
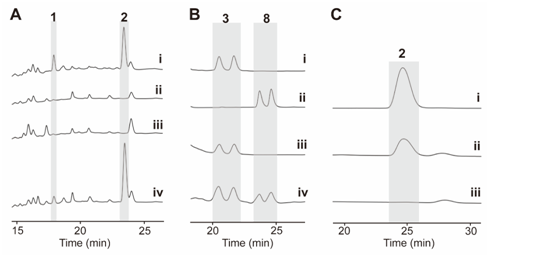
圖2:(A)野生型和突變株的HPLC圖譜。 (B) (iv) ChxJ與3孵育。 (C) ChxJ和ChxI與3孵育。
ChxJ和ChxI的組合足以產(chǎn)生APN,而ChxH和ChxG對于CHX的生物合成至關(guān)重要,這與作者早期的體內(nèi)敲除實驗結(jié)果一致。ChxH負(fù)責(zé)CHX生物合成途徑的最后一步已經(jīng)在先前報道的文章中證實,接下來重點研究ChxG。實驗結(jié)果顯示,化合物8能被ChxG還原為化合物9(圖3A),這表明ChxG在CHX生物合成中的作用是介導(dǎo)不穩(wěn)定的醛化合物4的C12-C13雙鍵還原,生成新的中間體10,該中間體隨后可自發(fā)進行醛醇縮合脫水生成11(圖3B、圖4)。隨后將ChxJ、ChxI和ChxG組合在一起,以3為底物進行了一鍋反應(yīng),證明了化合物4是ChxG的真實底物(圖3C)。而化合物11可以在非酶催化條件下轉(zhuǎn)化為化合物6(圖3D)。此外,找到了一個ChxG的同源蛋白,并通過體外實驗驗證了其具有ChxG相同的活性。驗證了ChxG在底物還原過程中的立體選擇性與天然放線菌酮生物合成過程中C12和C13雙鍵還原時的立體選擇性是一致的(圖5A)。最后,通過分子模擬對接分析以及后續(xù)點突變蛋白的構(gòu)建,證明了氨基酸H162、H165和Y167對ChxG的還原活性起著至關(guān)重要的作用(圖5B)。
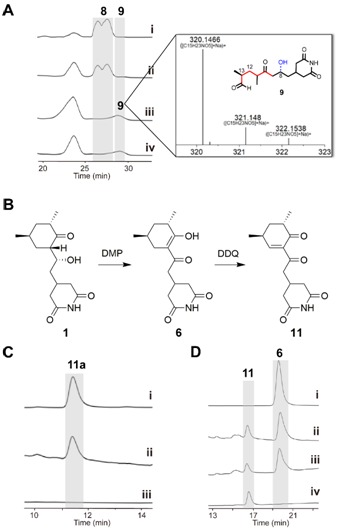
圖3:ChxG的體外酶促反應(yīng)。(A)
ChxG化合物8生成9。 (B)由化合物1(CHX)化學(xué)合成化合物11和6。(C) ChxI、ChxJ和ChxG與3孵育,11易于發(fā)生酮烯醇互變異構(gòu)生成11a。(D) NADPH在添加或不添加ChxG的情況下分別與11共孵育。
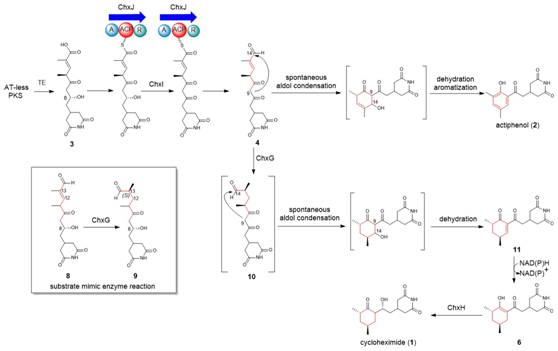
圖4:新推導(dǎo)的CHX和APN的生物合成途徑。
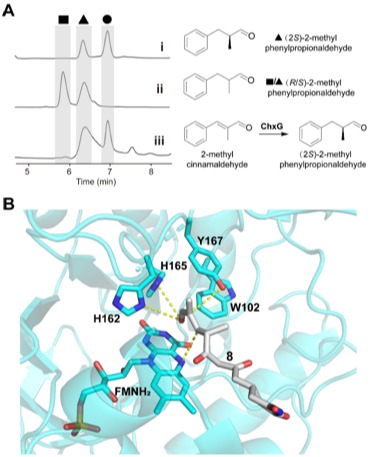
圖5:(A) 手性HPLC圖譜。 (B)化合物8與ChxG活性口袋對接。
至此,CHX和APN的生物合成途徑的細(xì)節(jié),包括六元碳環(huán)系統(tǒng)的生物合成的新機制得到了完整解析。本研究表明,CHX和APN并非如先前推測的那樣由APN催化氫化產(chǎn)生CHX,而是自trans-AT PKS合成了碳骨架后,通過兩個平行的途徑分別產(chǎn)生的。兩種氧化還原酶(ChxJ和ChxI)可以單獨產(chǎn)生一種活性中間體,該中間體經(jīng)歷一系列非酶轉(zhuǎn)化以產(chǎn)生APN,而還原酶(ChxG)則作為看門人,將同一中間體引導(dǎo)到產(chǎn)生CHX的合成途徑。該研究對作者團隊于2014年提出的假設(shè)(Yin et al. Org Lett, 2014)進行了進一步修正,擴展了對天然產(chǎn)物生物合成中氧化還原酶介導(dǎo)的酚和環(huán)己酮基團形成的理解,并為未來的組合生物合成研究奠定了基礎(chǔ)。
云南大學(xué)醫(yī)學(xué)院尹敏副研究員和中國科學(xué)院昆明植物研究所黃勝雄研究員、顏一軍研究員為文章共同通訊作者。上述工作得到了國家自然科學(xué)基金(82225043、 32271523 、82160674),中國科學(xué)院戰(zhàn)略生物資源計劃(KFJBRP-009-005)和云南省自然科學(xué)基金(202201AS070007)等項目的支持。
原文鏈接:https://pubs.acs.org/doi/10.1021/acscatal.4c03332
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點或證實其描述。若有來源標(biāo)注錯誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn