

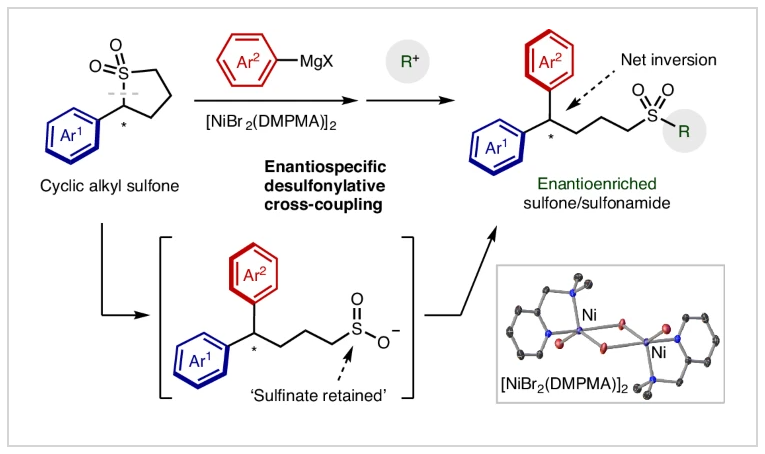
正文
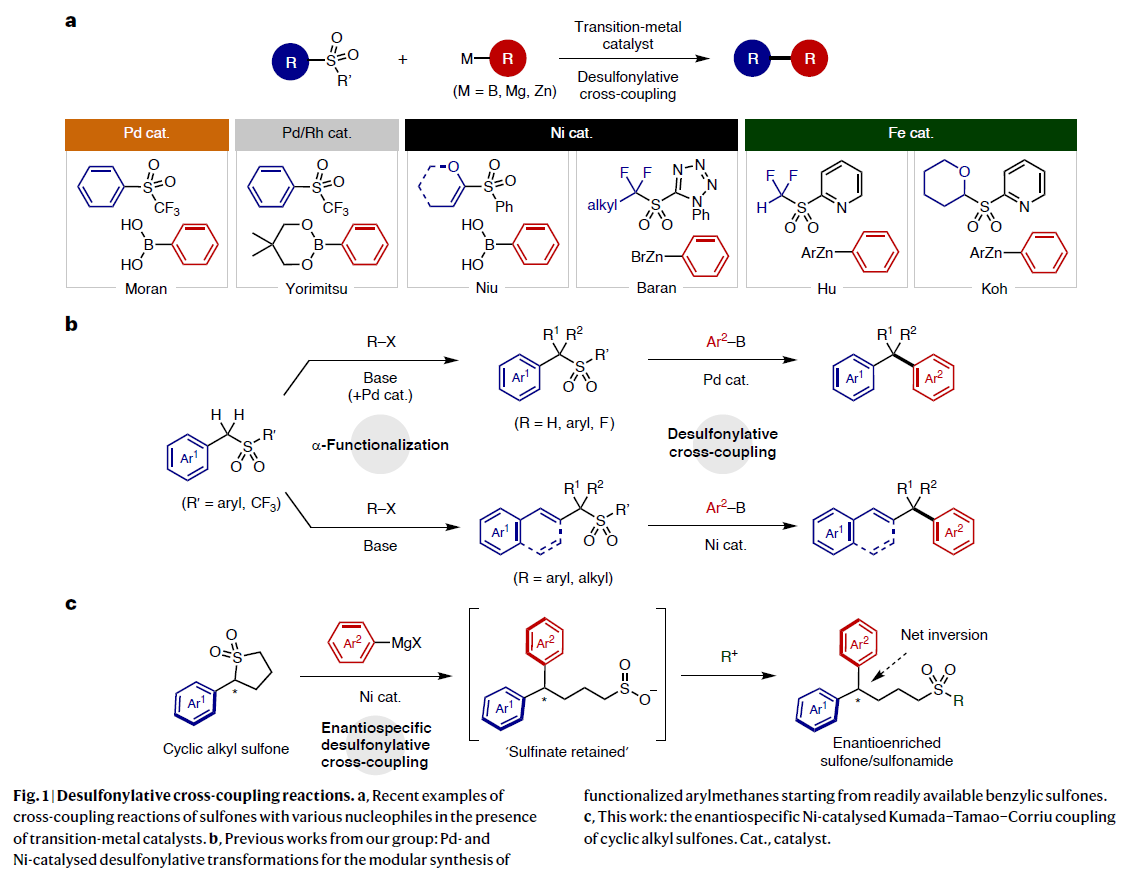
(圖片來源:Nat. Chem.)
首先,作者以連有萘基取代的砜rac-1a作為模板底物對反應進行探索(Table 1)。通過一系列條件篩選,作者發現當使用rac-1a (0.1?mmol), PhMgBr (2) (2.5 equiv.), [NiBr2(DMPMA)]2 (5?mol%), 在THF (0.3?M)中75?°C反應16?h, 隨后加入 MeI (10 equiv.),在DMSO (0.2?M)中85 °C反應4?h,可以以83%的分離產率得到產物3aa(entry 9)。控制實驗表明,在沒有鎳催化劑和配體存在下反應是不發生的(entry 10, 11)。

(圖片來源:Nat. Chem.)
在得到了最優反應條件后,作者對此轉化的底物兼容性進行了考察(Table 2)。實驗結果表明一系列不同取代的芳基格氏試劑(Table 2左邊)和砜(Table 2右邊)均具有良好的兼容性,以16-83%的產率得到相應的產物3aa-3ha。此外,作者還對不同環尺寸的砜進行了考察,發現四元環(1i)和六元環砜(1j)同樣是有效的偶聯配偶體,但產率相對較低(3ia, 34%; 3ja, 32%)。有趣的是,四倍過量的格氏試劑的使用對六元環砜的開環是最有效的,這需要抑制β-氫消除。此現象表明亞磺酸鹽在開環后仍與金屬結合,并影響交叉偶聯的傾向,而不是β-氫消除。
接下來作者探討了亞磺酸鹽捕獲試劑的兼容性(Table 2底部)。首先,作者以1 g規模成功制備了萘類似物5aa,產率86%。這些反應在一鍋中進行,不需要分離或純化中間體。亞磺酸鹽的分離是極其重要的,因為它可以與各種親電試劑反應,來制備取代的砜和磺酰胺。隨后,作者考察了交叉偶聯產物與其它親電試劑的反應,包括與烷基溴和烯丙基溴的直接反應,分別以73%和67%的產率得到二烷基砜產物6aa和7aa。在缺電子溴吡啶上的SNAr反應也受到影響,以中等產率(32%)得到雜芳基砜8aa。與SO2Cl2反應可原位生成磺酰氯衍生物,且與嗎啡啉反應時,可以47%的產率得到磺酰胺9aa。
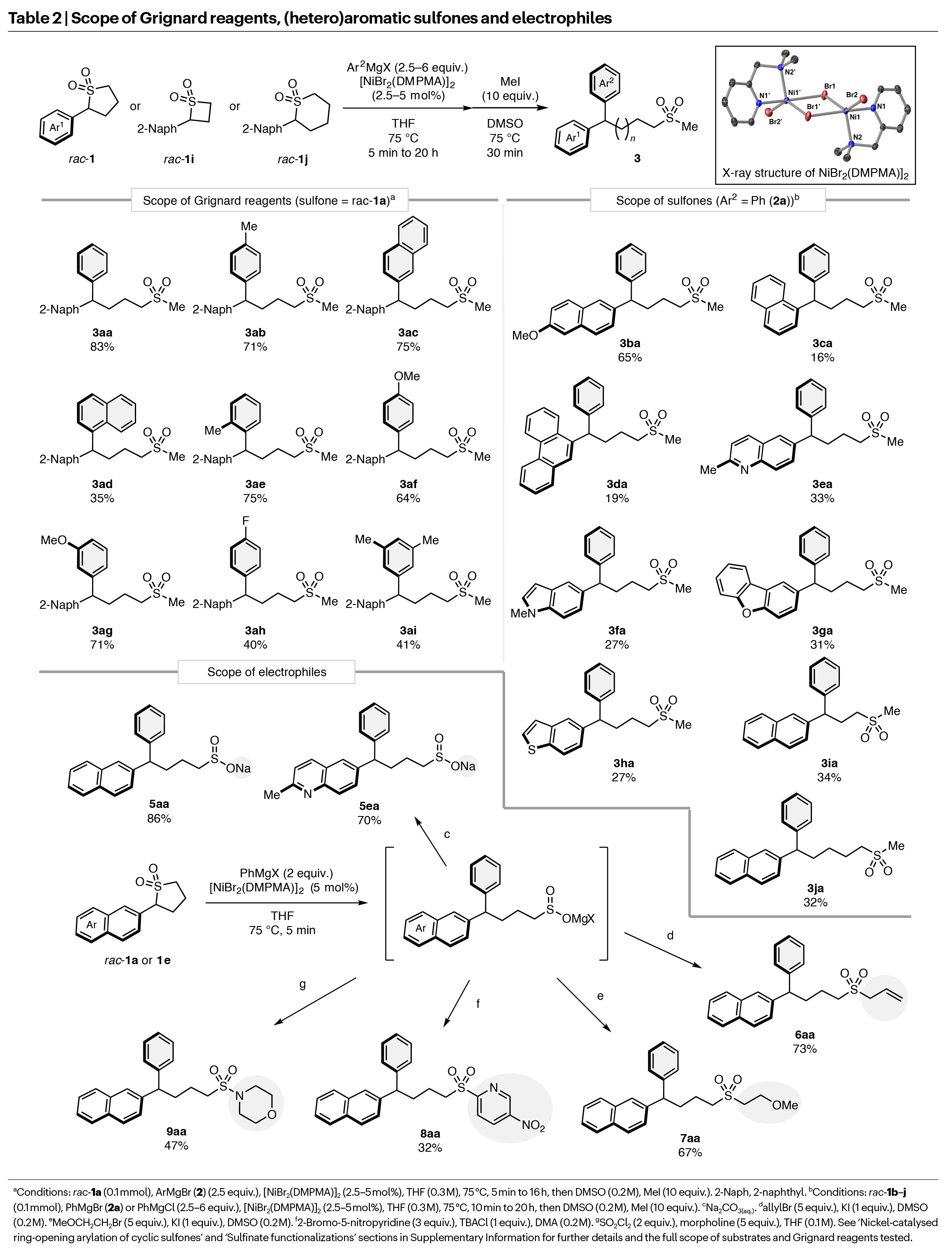
(圖片來源:Nat. Chem.)
在證明了開環交叉偶聯反應的有效性后,作者接下來將目光轉向其對映體富集類似物。作者采用Corey-Bakshi-Shibata還原法得到二醇11,并進行了甲磺酰化和Na2S處理,隨后通過氧化得到對映體富集的砜(S)-1a,且產物結構得到了單晶X-射線衍射分析的確證(Fig. 2a)。實驗結果表明,對映體富集的底物(S)-1a與2a的開環芳基化可以以≥99%的對映體特異性進行。
為了確定產物的絕對構型,作者制備了(R)-3aa(Fig. 2b)。通過與鎳催化的交叉偶聯反應所制備的(R)-3aa比較,作者得出鎳催化體系將(S)-1a轉化為(S)-3aa是構型反轉的。這一觀察結果與其它交叉偶聯反應的文獻報道相一致。不同的有機鎂試劑(2b和2f-2h)也同樣具有良好的對映體特異性,并且在使用1a的(R)或(S)對映體的實驗中獲得了類似的結果(Fig. 2c)。對映體富集的二取代環砜14也可成功實現轉化,得到相應的產物ent-15,且具有良好的對映特異性和非對映特異性。
接下來,作者通過1H NMR和手性超臨界流體色譜(SFC)分析,探索了反應速率以及原料和產物的對映純度隨時間的變化(Fig. 2d,e)。由于在75 oC時反應速度太快而無法監測,因此作者將反應溫度降至30 oC。在此條件下,在反應的前5分鐘內,(S)-3aa的轉化率達到(S)-1a消耗的90%以上,立體化學保留率 > 99%(Fig. 2d)。底物(R)-3ag需要> 45分鐘才能達到類似的階段,其對映體特異性較低(79%; Fig. 2e)。
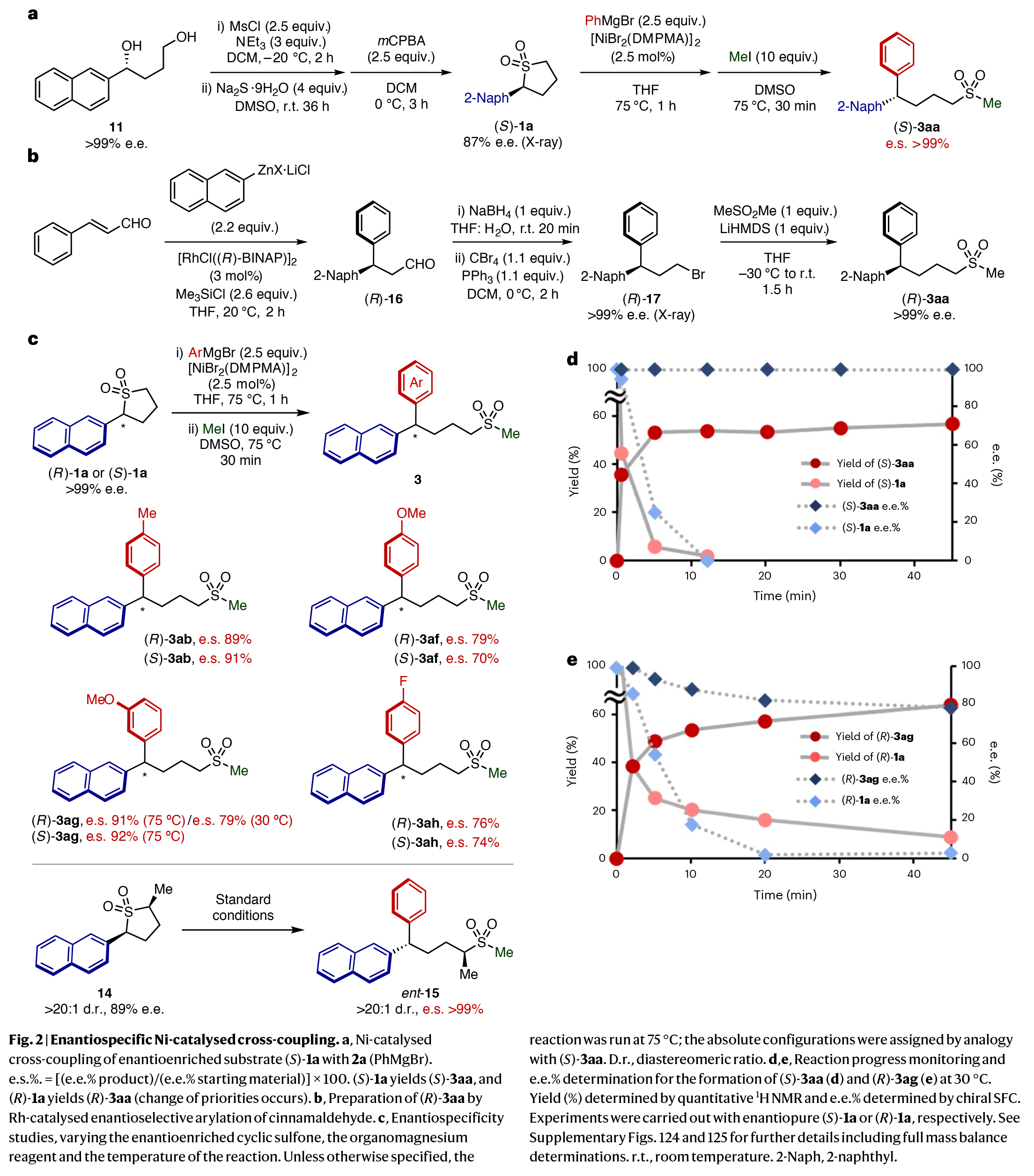
(圖片來源:Nat. Chem.)
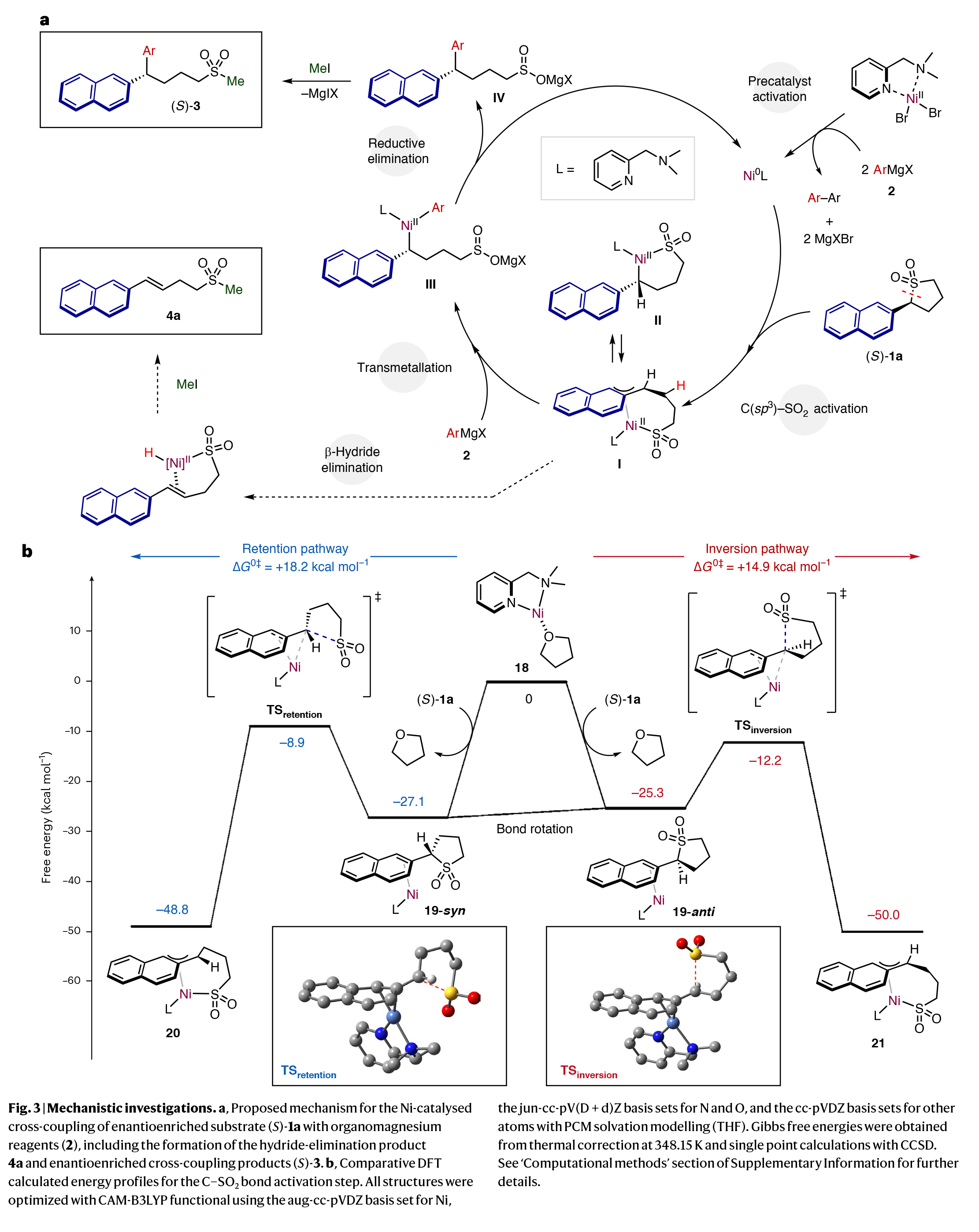
基于上述觀察結果,作者提出了此轉化可能的反應機理(Fig. 3a):催化循環由鎳預催化劑[NiBr2(DMPMA)]2與兩當量的格氏試劑引發,在消除相應的自偶聯(聯芳基)產物后,得到具有催化活性的Ni0(DMPMA)物種。接下來,α-萘基取代的環砜(S)-1a在擴展的π-芳香體系的促進下,在最活潑的C(sp3)-SO2鍵上進行氧化加成。反應的立體特異性可能是由氧化加成的性質控制的,因為轉金屬化和還原消除通常伴隨著構型的保持。
一種潛在的氧化加成反應機理涉及親核鎳絡合物與砜通過直接的SN2反應而不涉及π-體系。基于此轉化嚴格依賴于底物中π擴展芳烴的存在,并考慮到所采用的底物的位阻,這種機理被認為是不可能的。
相反,催化劑很可能與底物絡合,然后發生順式或反式的氧化加成,生成π-萘基鎳物種。這兩種可能性在文獻中均有報道。在期望的反應途徑中,氧化加成(I/II)的產物隨后與格氏試劑發生反應,預計這將在立體化學保留的情況下發生,并再生活性Ni0物種。最后,IV與MeI反應生成芳基化產物(S)-3aa。或者,中間體I/II可以在甲基化后進行β-氫消除得到4a。
(圖片來源:Nat. Chem.)
總結
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn