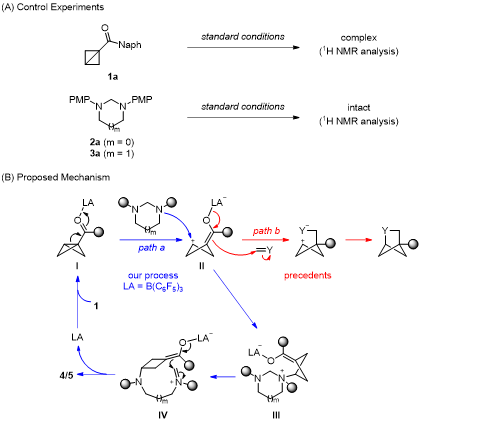
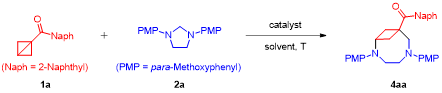橋環體系作為母核結構廣泛存在于天然產物、藥物分子以及一些生物活性分子中,因此,如何一步構建橋環骨架對于藥物研發有著極為重要的意義。雙環[1.1.0]丁烷(BCB)由于自身獨特的化學性質,可以通過能量轉移、單電子轉移和雙電子參與的各種策略實現(n+3)環加成反應(圖1A)。
由于中環體系的碳(雜)環化合物具有較大的環張力,所以合成該類化合物也面臨著巨大的挑戰。根據彭士勇課題組之前的研究,已經實現了咪唑烷與供體-受體環丙烷(DAC)的(5+3)環加成反應,成功的構建了飽和1,4-二氮雜壬烷化合物,并且在基于路易斯酸催化下雙環[1.1.0]丁烷與供體-受體環丙烷的反應活性的相似性,進一步提出咪唑烷能夠與雙環[1.1.0]丁烷發生偶極環化進而構建出中等橋環骨架體系的可能性。(圖1B)。
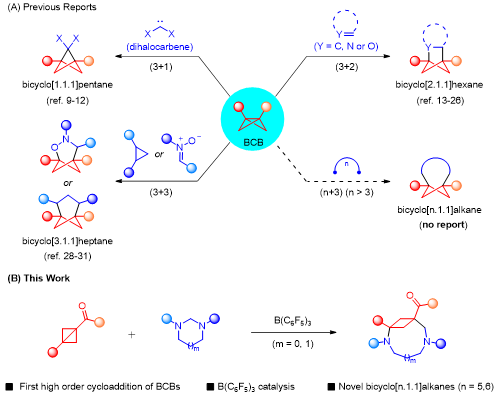
圖1 研究背景(來源:Organic Letters)
作者首先以雙環[1.1.0]丁烷1a和咪唑烷2a作為模板底物對反應條件進行了優化,在最優的反應條件下,以81%的分離收率,生成產物4aa(表1)。
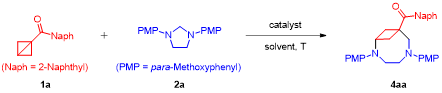
表1 條件篩選
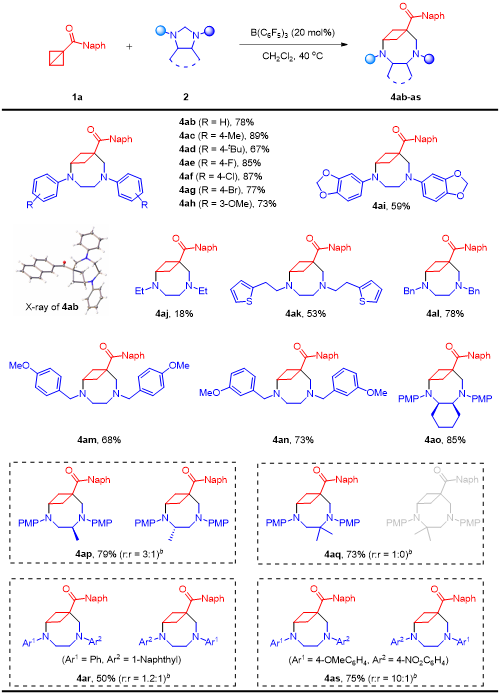
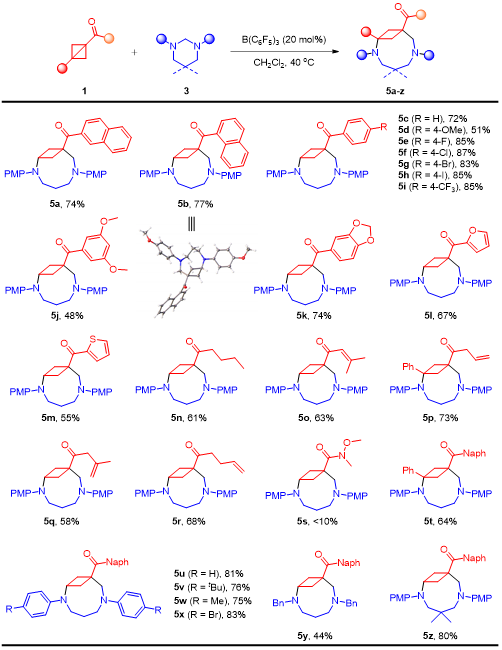
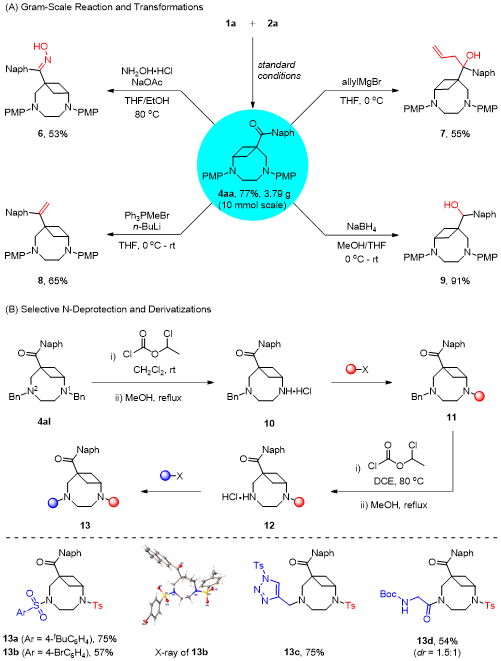
在上述的最佳反應條件下,作者對一系列BCB底物的應用范圍進行了深入研究。當芳酮芳環上具有給電子或吸電子取代基、雜環取代基時,均能以中等至良好的收率得到目標產物。此外,脂肪酮包括鏈狀脂肪烴、環烷烴、烯烴和炔烴都展現出良好的底物適用性,將BCB替換為1,3-二取代BCB時,依然能夠以良好的收率獲得目標產物(圖2)。圖2 (5+3)底物拓展(來源:Organic Letters)隨后作者考察了咪唑烷氮原子上不同取代基對于該反應的影響,無論是烷基咪唑烷還是芳基咪唑烷,底物均能夠順利轉化,得到相應的橋環化合物。緊接著作者也合成了一些非對稱的咪唑烷進而考察了電子效應和位阻效應對區域選擇性的影響(圖3)。圖3 (5+3)底物拓展(來源:Organic Letters)根據彭士勇課題組之前的研究結果,咪唑烷的同系物六氫嘧啶可以作為1,6-偶極前體。作者在標準條件下對反應進行了嘗試,幸運的是,上述催化條件同樣適用于該(6+3)環化過程(圖4)。圖4 (6+3)底物拓展(來源:Organic Letters)隨后,作者進行了毫摩爾級放大反應以及產物的多樣性轉化,在10 mmol的反應規模下,標準條件下依然能以77%的收率獲得目標產物,產物4aa的羰基可以高效的發生縮合反應、格氏反應、Wittig反應以及氫化反應,且橋環骨架并未受到影響。最后通過使用氯甲酸氯乙酯經過兩步一鍋法以定量的收率得到選擇性芐基脫除的產物,進而能夠選擇性的在橋環氮原子上引入藥效分子,展示了其在合成中的潛在應用性(圖5)。圖5轉化應用(來源:Organic Letters)最后,作者通過設計對照試驗,證明該反應是通過路易斯酸B(C6F5)3對BCB進行活化進而受到咪唑烷的親核進攻而發生環化的反應路徑獲得目標分子,而非此前由Leitch、Studer以及Glorius所報道的BCB開環生成偶極子再去進攻另一底物的方式。根據實驗結果,作者提出了可能的反應機制(圖6)。圖6 對照試驗及可能的機制(來源:Organic Letters)彭士勇課題組報道了在溫和的條件下以非金屬路易斯酸B(C6F5)3為催化劑,實現了咪唑烷與雙環[1.1.0]丁烷的(5+3)偶極環加成反應,反應具有優良的底物普適性。進一步地在該條件下實現了六氫嘧啶與雙環[1.1.0]丁烷的(6+3)偶極環加成反應,得到了一系列2,6-二氮雙環[6.1.1]癸烷化合物。據我們所知,這是雙環[1.1.0]丁烷參與的首次高階偶極環加反應,為以后基于雙環[1.1.0]丁烷參與高階偶極環加成反應打下了基礎。Yang, L.;# Wang, H.;# Lang, M.; Wang, J.; Peng, S.* "B(C6F5)3-Catalyzed Formal (n + 3) (n = 5 and 6) Cycloaddition of Bicyclo[1.1.0]butanes to Medium Bicyclo[n.1.1]alkanes" Org. Lett. 2024, doi: 10.1021/acs.orglett.4c01219.五邑大學藥學與食品工程學院彭士勇課題組成立于2017年,研究方向為金屬有機化學,不對稱合成。現已在ACS Catal., Org. Lett., J. Org. Chem.等期刊發表相關學術論文30余篇,主持國家自然科學基金,廣東省自然科學基金、廣東省教育廳、五邑大學高層次人才項目5項,詳見課題組主頁:https://www.x-mol.com/groups/peng_shiyong