



(圖片來源:Nat. Catal.)
正文
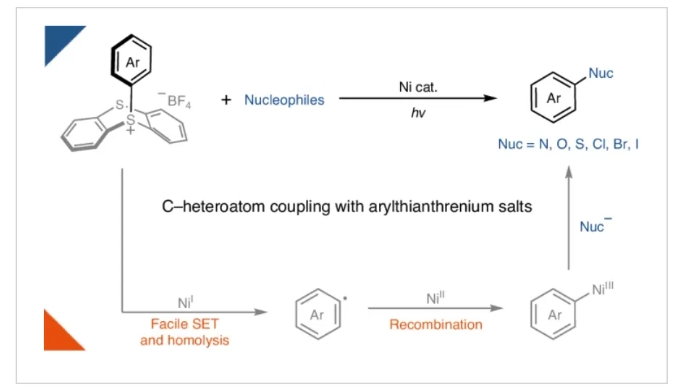
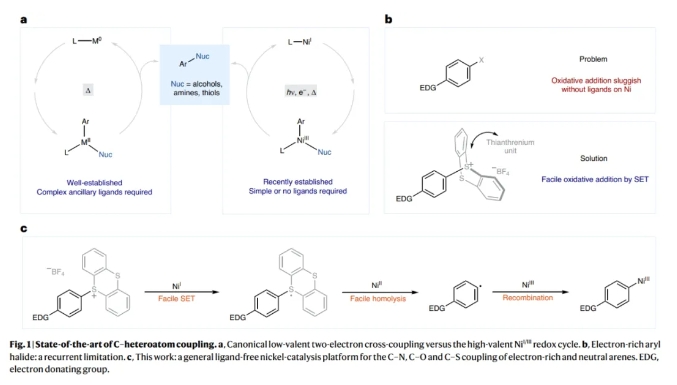
鎳光氧化還原催化使利用過渡金屬催化構(gòu)建碳-雜原子鍵的轉(zhuǎn)化豐富發(fā)展。通過利用光能,過渡金屬可以達(dá)到在催化反應(yīng)中通過熱化學(xué)難以達(dá)到的氧化態(tài)。例如,已被報道利用鎳光氧化還原反應(yīng)利用芳基(擬)鹵化物合成苯胺和芳基醚。然而,在缺乏特殊的富電子配體的情況下簡單鎳體系的氧化加成通常很慢,會導(dǎo)致催化劑分解。因此,富電子芳基親電試劑通常不能實現(xiàn)上述轉(zhuǎn)化。最近,德國馬克斯·普朗克煤炭研究所Josep Cornella和Tobias Ritter課題組提供了一個概念性的解決方案,在光/鎳共催化下實現(xiàn)了富電子芳環(huán)(芳基噻蒽鎓鹽)的胺化,氧化,硫化和鹵化過程,同時構(gòu)建了碳-雜原子鍵(Fig. 1)。化學(xué)加——科學(xué)家創(chuàng)業(yè)合伙人,歡迎下載化學(xué)加APP關(guān)注。
(圖片來源:Nat. Catal.)
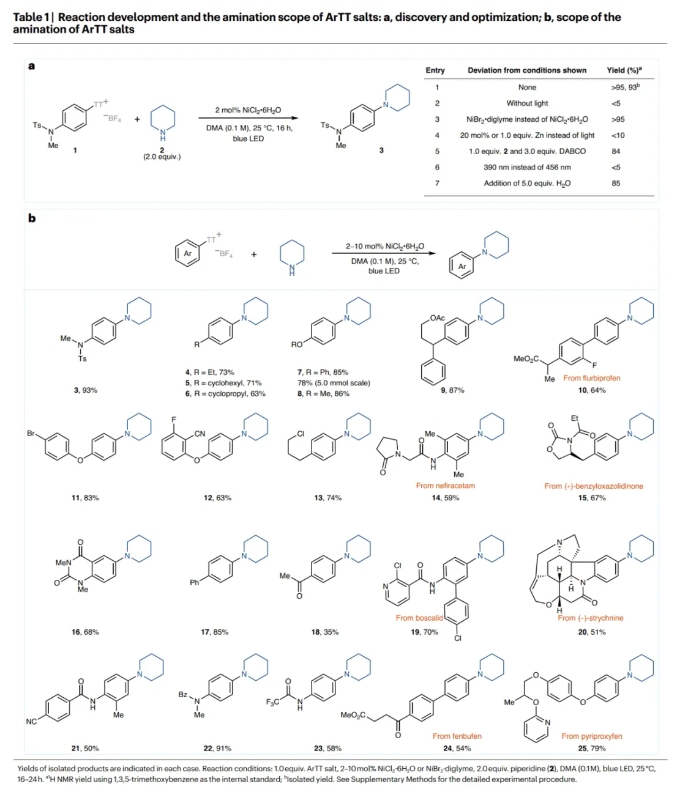
首先,作者以芳基噻蒽鎓鹽1和哌啶2作為模板底物對反應(yīng)進(jìn)行了探索(Table 1a)。通過一系列條件篩選,作者發(fā)現(xiàn)當(dāng)使用1(1.0 equiv),2(2.0 equiv),2 NiCl2·6H2O(2 mol%),在DMA (0.1 M)中,藍(lán)光照射下25 °C反應(yīng)16小時,可以以大于95%的核磁產(chǎn)率和93%的分離產(chǎn)率得到相應(yīng)的C-N偶聯(lián)產(chǎn)物3 (entry 1)。2023年,作者報道了無需光參與的鎳催化鹵化反應(yīng),其中鋅被用作還原劑(J. Am. Chem. Soc. 2023, 145, 9988)。但是,即使使用1.0當(dāng)量的鋅在此轉(zhuǎn)化中也僅能產(chǎn)生不到10%的產(chǎn)物3(entry 4)。由此表明此體系與之前的反應(yīng)體系有所不同。
在得到了最優(yōu)反應(yīng)條件后,作者對此轉(zhuǎn)化的底物范圍進(jìn)行了考察(Table 1b)。實驗結(jié)果表明,一系列不同取代的富電子和電中性的芳基噻蒽鎓鹽均可順利實現(xiàn)轉(zhuǎn)化,以50-93%的產(chǎn)率得到相應(yīng)的產(chǎn)物3-25。與其它的鎳催化胺化策略相比,缺電子底物的反應(yīng)效率相對較低(18)。通常來講缺電子芳烴的氧化加成會更快,但可能是由于競爭的氫化副反應(yīng)的存在使得目標(biāo)產(chǎn)物產(chǎn)率降低。一系列不同的官能團(tuán),包括磺酰胺、酰胺、環(huán)丙基、醚、聯(lián)芳基、鹵化物、腈、酯、雜環(huán)、氨基甲酸酯和胺等均可兼容。此外,一系列復(fù)雜的活性小分子,如flurbiprofen (10), nefiracetam (14), benzyloxazolidinone (15), boscalid (19), strychnine (20), fenbufen (24) 和 pyriproxyfen (25)也均可以轉(zhuǎn)化為相應(yīng)的胺化產(chǎn)物,這為生物活性分子為后期修飾提供了一個新的策略。雖然對位和間位取代的底物可以參與反應(yīng),但鄰位取代的芳基噻蒽鎓鹽不能實現(xiàn)轉(zhuǎn)化,得到的大部分是氫化的副產(chǎn)物以及未反應(yīng)的起始材料。
(圖片來源:Nat. Catal.)
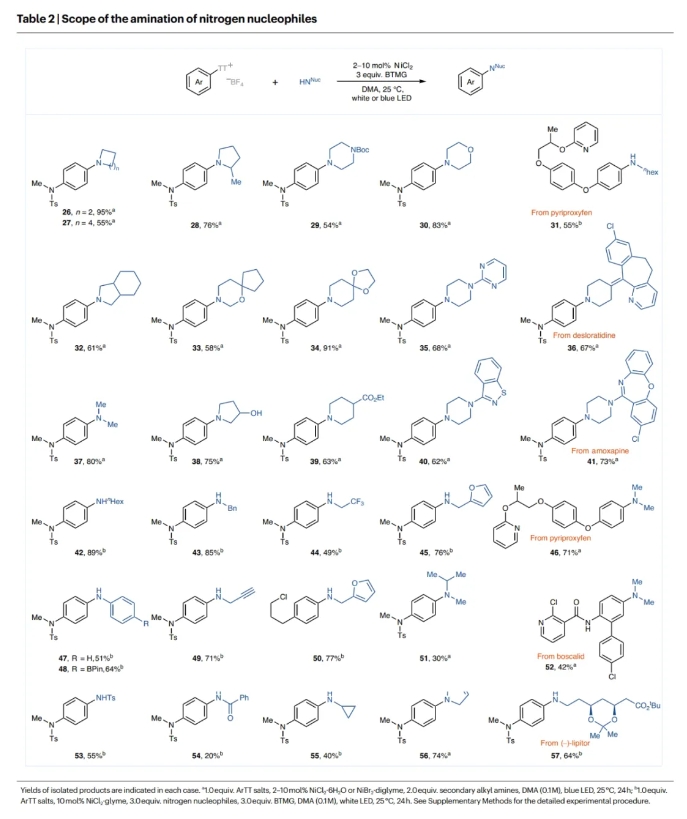
接下來,作者對N-親核試劑的底物范圍進(jìn)行了考察(Table 2)。一系列不同尺寸的環(huán)二級胺,如α-甲基取代的吡咯烷,N-Boc保護(hù)的哌嗪,嗎啡啉,嘧啶和苯并異噻唑胺等均可兼容。此外,二甲胺也可有效參與轉(zhuǎn)化,以80%的產(chǎn)率得到目標(biāo)產(chǎn)物37。然而,當(dāng)使用比二甲胺具有更大空間位阻的線性二級胺時,產(chǎn)率會有所下降(51)。產(chǎn)率較低的原因可能是由于位阻減緩了反應(yīng),并在與鎳催化劑配位時引起了β-H的消除。然而,當(dāng)加入3.0當(dāng)量2-叔丁基-1,1,3,3-四甲基胍(BTMG),并將鎳源切換為NiCl2·glyme(10 mol%)時,伯胺也可以參與反應(yīng),得到所需的產(chǎn)物。雖然藍(lán)色LED也很有效,但在伯胺反應(yīng)的情況下,白光LED的產(chǎn)率略高。環(huán)丙胺、丙胺、α-CF3取代胺和含呋喃環(huán)的伯烷基胺均可參與反應(yīng),以40-89%的產(chǎn)率得到產(chǎn)物。值得注意的是,具有在鈀催化的胺化反應(yīng)中容易發(fā)生副反應(yīng)的官能團(tuán)的底物在此反應(yīng)條件下也是耐受的。此外,酸性官能團(tuán)(OH)也是可以兼容的(38)。
(圖片來源:Nat. Catal.)
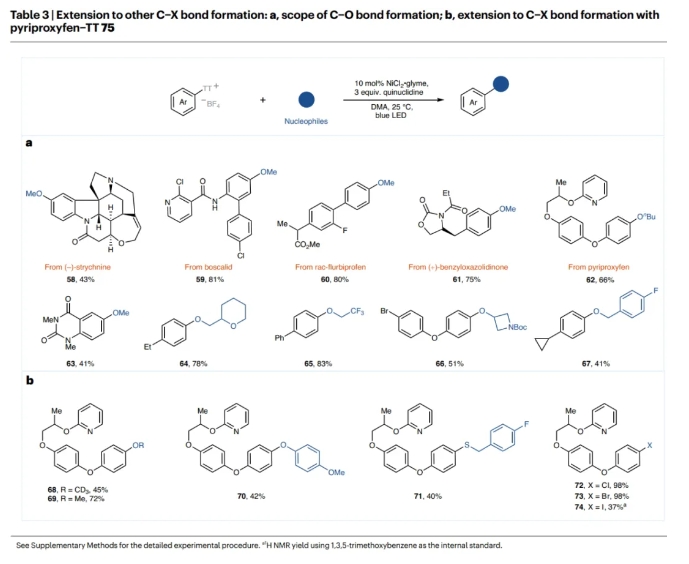
接下來,作者將所開發(fā)的催化劑體系擴(kuò)展到以MeOH為親核試劑的甲氧基化過程(Table 3)。無論簡單的和復(fù)雜官能團(tuán)化的含烷基、鹵素、酰胺、雜環(huán)和酯的芳基噻蒽鎓鹽以及伯醇、仲醇和酚均可參與這一過程,以41-83%的產(chǎn)率得到相應(yīng)的產(chǎn)物58-67。雖然之前已經(jīng)報道過使用芳基噻蒽鎓鹽構(gòu)建C?O鍵的轉(zhuǎn)化,但這些轉(zhuǎn)化并不是催化過程,并且需要使用化學(xué)計量的銅。此外,對于鹵化過程,需要使用非均相的鋅粉來形成Ni(I)催化劑,這可能會在大規(guī)模合成中帶來不便。此外,文獻(xiàn)報道的C?S鍵的形成過程僅限于芳香硫醇,而烷基硫醇則不能實現(xiàn)轉(zhuǎn)化。在此情況下,作者利用目前的方案克服了這些限制,并為使用氮,氧和硫親核試劑的轉(zhuǎn)化提供了統(tǒng)一的方法。此外,碘化鈉、溴化鈉和四丁基氯化銨(TBACl)也同樣可以作為親核試劑在來實現(xiàn)鹵化,這為類藥分子的后期官能團(tuán)化提供了一種直接和簡單的方法。遺憾的是,此轉(zhuǎn)化迄今為止尚未擴(kuò)展到氟化過程。
(圖片來源:Nat. Catal.)
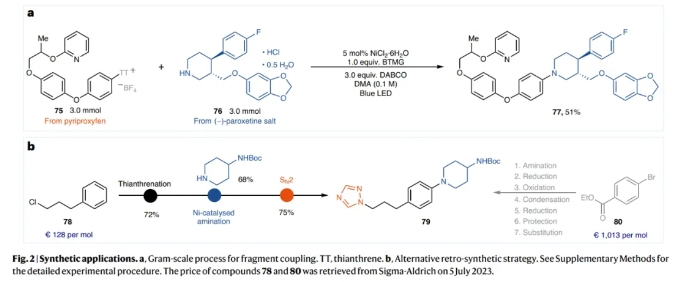
為了證明此轉(zhuǎn)化的實用性,作者對pyriproxyfen和(?)-paroxetine 鹽這兩個藥物分子進(jìn)行了克級規(guī)模(3.0 mmol)偶聯(lián),可以以51%的產(chǎn)率得到產(chǎn)物77(Fig 2a)。利用之前的方法,化合物79通常以芳基溴80為起始原料,經(jīng)過7步合成得到。而利用此策略可以從芳基噻蒽鎓鹽78開始,通過胺化和親核取代(SN2)反應(yīng),并且能夠?qū)⒑铣珊喕癁槿絹韺崿F(xiàn)合成(Fig 2b)。
(圖片來源:Nat. Catal.)
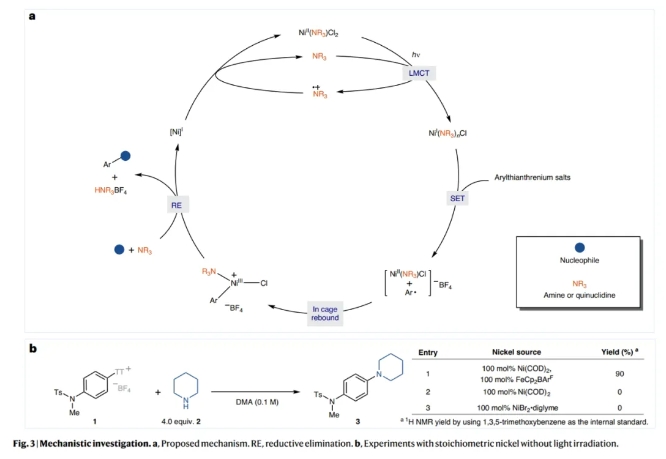
基于上述實驗結(jié)果,作者提出了可能的反應(yīng)機(jī)理(Fig 3a):反應(yīng)中Ni(I)可能是由簡單的Ni(II)鹽,在光照射下通過配體到金屬的電荷轉(zhuǎn)移(LMCT)過程生成的。當(dāng)1和2的混合物與Ni(COD)2 (100 mol%)和單電子氧化劑FeCp2BArF (100 mol%)在黑暗中結(jié)合時,C-N鍵產(chǎn)物3的產(chǎn)率為90%,由此進(jìn)一步證明了Ni(I)物種的存在(Fig 3b)。隨后,芳基噻蒽鎓鹽通過SET氧化加成以及再結(jié)合得到Ni(III)中間體,并經(jīng)歷還原消除得到產(chǎn)物并再生Ni(I)物種,進(jìn)入新的催化循環(huán)。
(圖片來源:Nat. Catal.)
總結(jié)
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點或證實其描述。若有來源標(biāo)注錯誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn