

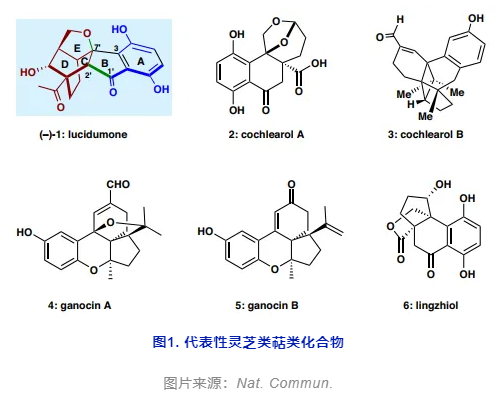
圖1. 代表性靈芝類萜類化合物
正文
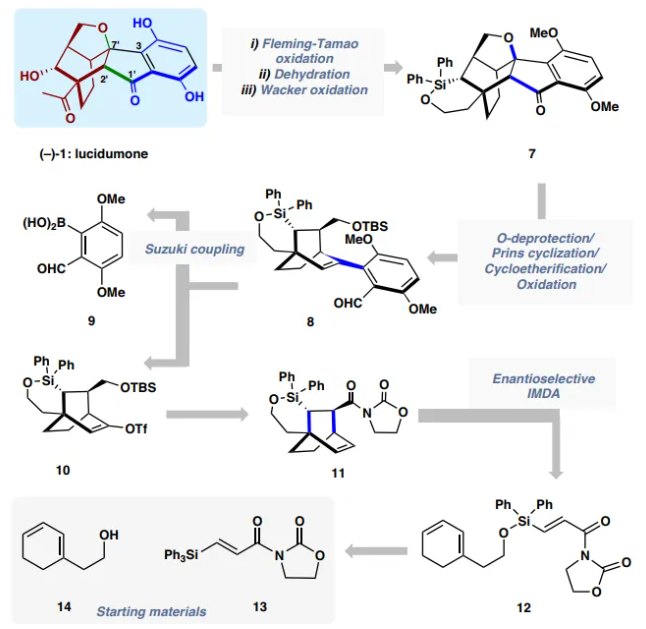
圖2. (?)-lucidumone的逆合成分析
圖片來源:Nat. Commun.
(?)-lucidumone (?)?1的逆合成分析如下:作者想通過Fleming-Tamao 氧化反應、Wacker氧化和O-去甲基化從六環中間體7中獲得(?)-1。稠合的茚滿酮框架可以通過關鍵的8的O-脫保護/Prins反應/環醚化序列來構建,而8又可以通過硼酸9和乙烯基三氟甲磺酸酯10之間的Suzuki偶聯得到。10可以追溯到 11,而11是12的不對稱分子內Diels-Alder反應的產物,12可以從已知的二烯14和容易獲得的丙烯酸酰亞胺13獲得。
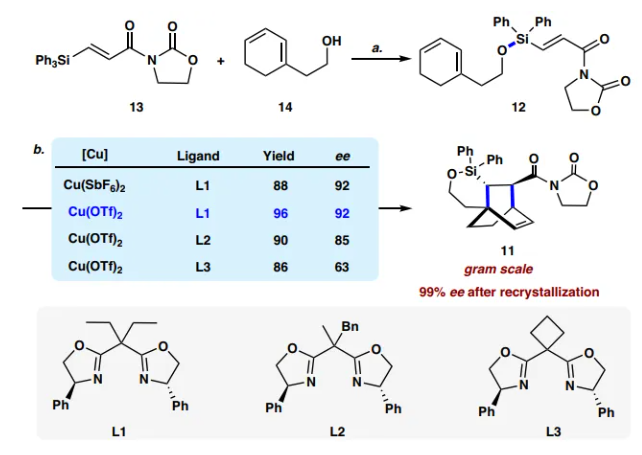
圖片來源:Nat. Commun.
1的合成路線如下,首先從12的制備開始(圖3)。按照 Sieburth開發的方案,將容易獲得的丙烯酸酰亞胺13暴露于三氟甲磺酸,然后添加已知的伯醇14,以91%的產率得到硅烷基醚12。在Et2AlCl(0.1當量)存在下,12在0 °C下的 Diels-Alder 環加成反應順利進行,以90%的收率得到所需的環加合物,為單一endo非對映異構體。接著,作者探索了這一反應的不對稱版本,通過改變反應溫度、配體和銅源來篩選反應條件,最終確定了50?°C 下,Cu(OTf)2 (10?mol%)和配體(S,S)-L1 (11?mol%)的優化反應條件,在該條件下,以96%的收率和92% ee分離出環加合物11。在Cu(OTf)2 (0.3 mmol)、(S,S)-L1 (0.33 mmol)存在下,在3.0 mmol下進行反應,11的收率和對映選擇性沒有明顯下降(95%收率,92% ee)。重結晶后ee值可進一步提高至99%。11的絕對構型通過其衍生物的X-射線衍射分析來確證。
在完成克級規模手性雙環[2.2.2]辛烷中間體11的合成后,作者開始合成高功能化的六環中間體22(圖4)。11的水解得到羧酸15,產率94%。另一方面,用LiBH4還原11得到醇16,產率85%。用BH3·THF(-30 °C 至室溫)處理 15,然后添加NaBO3·4H2O,通過同時還原羧酸得到混合二醇產物。無需純化,該二醇通過一系列選擇性O-保護和氧化轉化為酮17及其區域異構體18,總產率為89% (rr?=?3.4:1)。通過單晶確定了三環酮17的絕對構型。根據合成計劃,17將提供左旋目標分子(?)-lucidumone (?)-1。值得注意的是,對醇16應用相同的條件,以1:1 的比例分離出兩種區域異構酮的混合物。這些結果表明羧酸是硼氫化步驟中更好的導向基團。
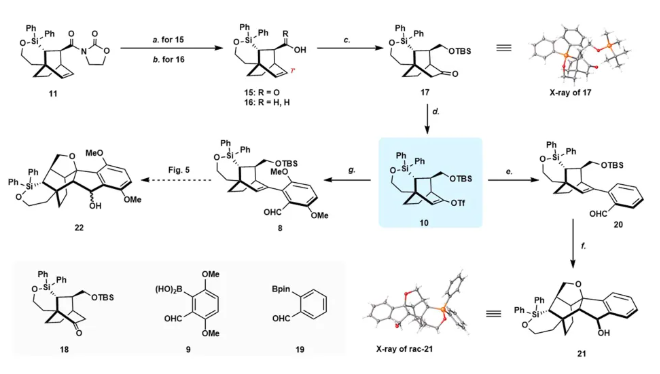
圖片來源:Nat. Commun.
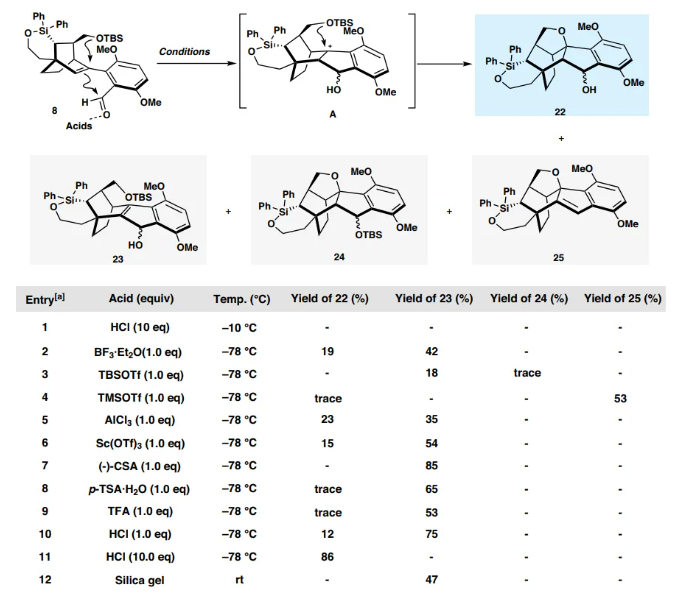
接下來,作者將構建天然產物的A-B-E環。在-78 ℃下用KHMDS對酮17進行去質子化,然后添加PhNTf2,得到所需的三氟甲磺酸乙烯酯10,分離收率為94%。Pd催化的10和已知的硼酸9之間的Suzuki-Miyaura交叉偶聯反應順利進行,以69%的產率得到官能團化的四環中間體8。接下來將尋求將8一步轉化為22,這是合成中的一個戰略步驟。在真實底物之前首先嘗試了模型反應。前體20是通過10和市售的2-甲酰基苯基硼酸頻哪醇酯19之間的Suzuki-Miyaura交叉偶聯生成的,在各種酸性條件下篩選關鍵轉化。最終,在 HCl(10 當量)存在下,在DCM中,在10 °C下,以89%的產率和20:1非對映選擇性獲得了所需的21。然而,四環的8不穩定,采用前述相同條件處理時會分解。所需產物作為一對非對映異構體22可以在一系列酸性條件下分離,同時形成Prins環化產物23。為了最大限度地減少副產物的產生,使用不同的酸[TFA、HCl、p-TsOH·H2O , (?)-CSA]和Lewis酸[BF3·Et2O、AlCl3、Sc(OTf)3、TBSOTf、TMSOTf等]在不同溫度下不同溶劑中進行篩選(圖5),HCl 仍然是最合適的啟動子。最佳反應條件包括在過量HCl(2M乙酸乙酯溶液,10 當量)存在下,在 -78 °C下攪拌8的DCM溶液24小時,以一對非對映異構體的形式生成22,產率為86%,也可以直接被Dess-Martin periodinane氧化,以一鍋法序列得到所需的產物7,總產率為80%(圖6)。通過X-射線晶體學分析證實了7的結構和絕對構型。其中,必須仔細控制反應溫度和時間,以避免副產物的形成。
圖片來源:Nat. Commun.
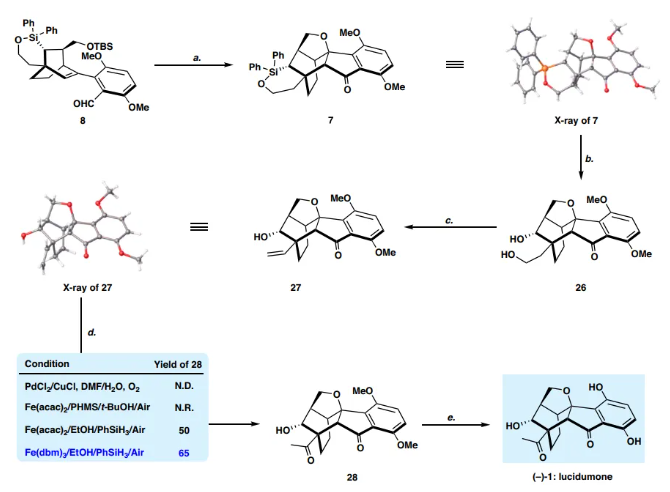
如圖 6 所示,最后就是將六環7合成為(?)-1。7的 Fleming-Tamao氧化(KF、H2O2、甲醇/THF,v/v?=?1:1)得到二醇 26,產率91%。值得注意的是,在連續的Dess-Martin氧化和Fleming-Tamao氧化下,通過自發脫保護/oxa-Michael加成,副產物23也可以轉化為二醇26。根據Grieco的方案,26的脫水過程順利進行,得到所需產物 27,分離產率為50%。正如Kawamoto和Ito提到的,乙烯基27到甲基酮28的后期Wacker氧化是具有挑戰性的。在經典條件下,可能由于空間位阻效應,由反馬氏加成產生的醛為主要產物。然后,作者借鑒了鐵催化Wacker型烯烴氧化為酮的方法。值得慶幸的是,將其標準條件應用于27 [Fe(dbm)3, PhSiH3, EtOH, RT],能以65%的產率獲得甲基酮28。最后,Lewis酸催化28的雙O-去甲基化,以70%的分離產率得到 (?)-lucidumone (?)-1。合成的(?)-lucidumone (?)-1的表征數據與天然產物報道的數據一致。
總結
李廣課題組完成了(?)-lucidumone (?)-1的對映選擇性全合成。該合成路線包括以下幾個關鍵的轉化:雙(噁唑啉)銅(II)配合物催化的對映選擇性分子內Diels-Alder反應,以構建多功能雙環[2.2.2]辛烷部分,一種Br?nsted酸促進串聯O-脫保護/Prins反應/環醚化,然后氧化以同時安裝四氫呋喃和稠合茚滿酮部分,Fleming-Tamao氧化提供仲羥基,以及鐵催化的受阻乙烯基的后期Wacker型氧化為甲基酮。該合成策略簡潔高效,將為靈芝類相關天然產物的合成及其生物活性研究提供重要基礎。
導師詳情
李廣,研究員,博士生導師,國家海外高層次青年人才引進計劃入選者。2008年畢業于西南大學獲得理學學士學位,2013年畢業于中國科學院化學研究所,獲得理學博士學位,師從史一安教授。2013年9月至2016年10月于清華大學藥學院從事博士后研究,師從祖連鎖教授。2017年1月至2021年6月于瑞士洛桑聯邦理工學院 (EPFL) 進行博士后研究,師從祝介平教授 (Prof. Jieping Zhu) 。2021年7月加入中國醫學科學院藥物研究所,目前主要從事活性天然產物全合成及后續的藥物化學和化學生物學研究。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn