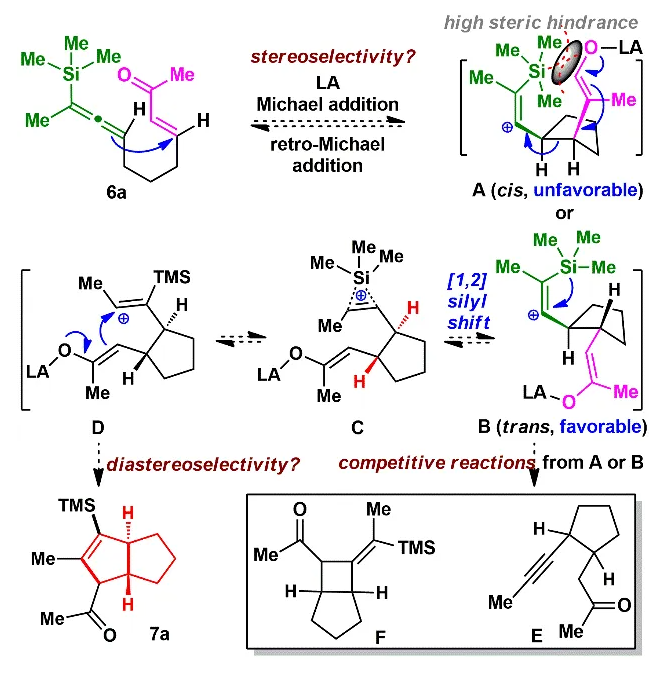
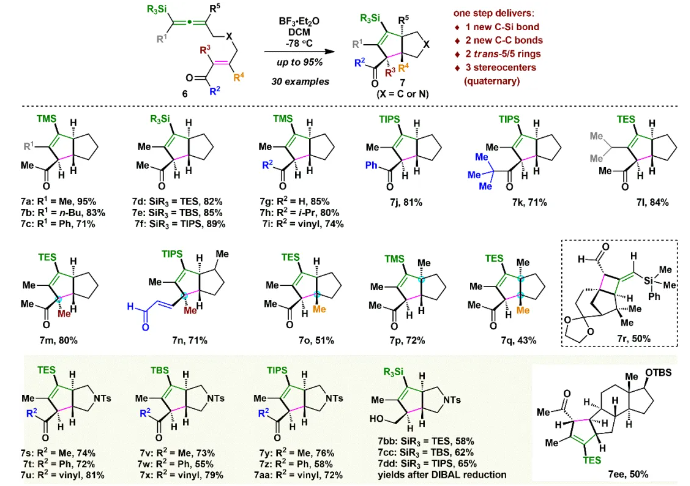
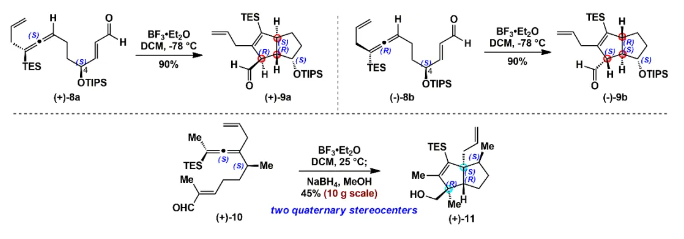
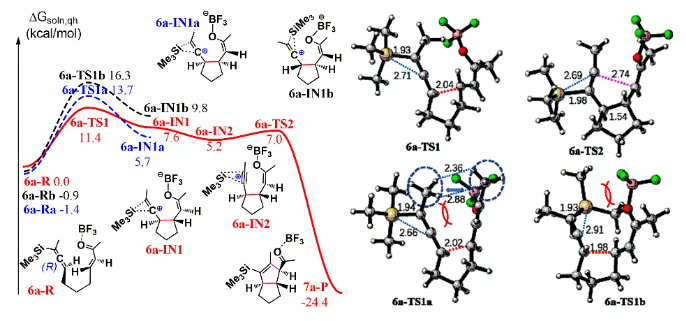
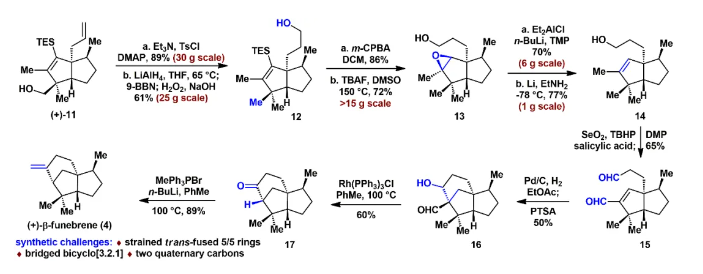
由于和生物靶標的特異性識別和結合,具有良好生物活性的高張力天然產物一直以來是研究的熱點和重點。其中代表性的高張力結構之一就是反式5/5并環,與其他高張力結構(彎曲苯環、共軛烯炔和橋頭雙鍵)的廣泛研究不同,反式5/5并環的合成研究較少。此外,計算和實驗數據表明順式和反式5/5并環之間存在約13 kcal/mol(計算)和6.4 kcal/mol(實驗)的能壘差,所以反式5/5并環的構建具有非常大挑戰性,迄今為止,只有4個具有全碳反式5/5并環的天然分子得到了全合成,且絕大部分依賴于反式5/6并環通過縮環策略來完成反式5/5并環的構建。而由線型分子一步立體選擇性地高效構建反式5/5并環體系,還未有相關報道。化學加——科學家創業合伙人,歡迎下載化學加APP關注。基于以上研究現狀,作者設想是否可以設計一個這樣的反應:一個鏈狀分子能否在某一條件下發生分子內特定反應,實現反式5/5并環的構建呢?然后作者首先查找了可以構建五元環的反應,排除了一些經典的反應,作者發現Danheiser環化反應可以順利合成五元環,雖然有分子間合成順式5/5并環的研究案例,但分子內反應還暫未有相關研究報道,于是作者選定以該反應(分子內[3+2]環化反應)為出發點,來驗證作者的想法。受Danheiser教授杰出工作的啟發,設想硅基聯烯與缺電子烯烴的分子內[3+2]環化反應,是有可能一步反應直接生成反式5/5并環的。假設以含有三甲基硅基聯烯和缺電子烯烴的化合物6a為底物(圖1),在路易斯酸作用下,聯烯會對缺電子烯烴進行分子內Michael加成,構建第一個五元環,由于三甲基硅基聯烯和缺電子烯烴的位阻效應,Michael反應更趨向于生成凡是構型的中間體B,隨后,中間體發生分子內[1,2]-硅基遷移得到中間體D,最后分子內親核進攻乙烯基碳正離子得到目標產物化合物7a。然而該反應中的化學選擇性(潛在性生成副產物E和F)、非對映選擇性和聯烯手性遷移問題使得該反應的實現依舊具有很大的挑戰性。為了驗證該反應的可行性(圖2),作者先合成了化合物6a,在三氟化硼乙醚條件下,選擇性地得到了單一化合物,經過X射線單晶衍射證實了產物7a的構型確實是反式5/5并環。為了進一步證實該反應的底物普適性,作者合成了17個含有不同硅取代基和多取代的缺電子烯烴,在標準反應該條件下,都以中等至優秀的收率得到了對應反式5/5并環產物。值得一提的是,二取代聯烯只能得到5/4并環,不能生成5/5并環,可能由于氫原子不能有效穩定碳正離子;含有5/5/6/5復雜四環骨架的化合物也可順利合成。此外,含有氮原子的12個底物也能以中等收率得到氮雜反式5/5并環。為了解決聯烯手性是否可以發生轉移(圖3),作者合成了一對非對映體(+)-8a、(-)-8b和化合物(+)-10,在標準反應條件下,均得到對應的產物,單晶結果證實了化合物(-)-9b的絕對構型,該實驗結果說明了分子內[3+2]環化反應是可以發生手性轉移的。且DFT計算也進一步解釋了該反應的區域選擇性、非對映選擇性(圖4),并預測該反應的立體選擇性(手性傳遞)。至此,該分子內[3+2]環化反應一步實現了一個碳硅鍵、兩個碳碳鍵、兩個反式5/5并環和三個手性中心的構建,且化學選擇性、區域選擇性和立體選擇性高,底物普適性良好。在得到化合物11之后,作者將該化合物應用于天然產物β-funebrene的不對稱全合成。化合物11經過一級醇上Ts和LiAlH4還原脫掉,后接著硼氫化氧化單取代雙鍵得到化合物12;化合物12在m-CPBA和TBAF條件下脫掉TES,隨后在Et2AlCl作用下開環氧以及Li/EtNH2條件下切斷二級羥基生成化合物14;化合物14通過烯丙位氧化和DMP氧化得到二醛15,Pd/C氫化雙鍵后,PTSA即可誘使二醛發生aldol反應得到化合物16,最后經過Wilkson催化劑脫羰反應和Wittig反應,即可順利拿到天然產物β-funebrene。除此之外,作者對該天然產物的核磁共振碳譜進行了糾正(圖5)。李闖創課題組發展了一個分子內[3+2]環化高效直接構建高張力反式5/5并環的新方法,該方法具有很好的化學選擇性和立體選擇性,利用該反應,成功實現了天然產物β-funebrene的首次不對稱全合成。該反應豐富了反式5/5并環的構建方法,也為含有反式5/5并環的天然產物全合成提供一個新的合成策略。論文DOI:https://doi.org/10.1016/j.chempr.2023.08.009李闖創教授課題組在天然產物全合成、合成方法學等領域,已取得了一系列頗具特色的學術成果,并在教書育人方面積累了豐富的經驗:(1)先后發展了若干獨特的合成方法學,例如,首次建立了獨特的[5+2]環加成反應,并使該反應成為高效構建多種橋環的新方法,以該反應為新策略,高效合成了一批具有橋環體系的重要天然產物,包括甾體、萜類、生物堿等,進而推動了新型環加成研究方向的發展。(2)發展了新策略,以世界上最短的合成路線,實現了有機合成歷史上最難分子之一紫杉醇(重要抗癌藥)的高效全合成。(3)在過去的五年中,完成了60余個具有合成挑戰性的復雜天然產物全合成(50余個為首次合成),包括了15類不同家族,為后續的藥物化學、藥理學等研究提供了豐富的物質基礎。(4)研究成果多次得到國家基金委(2)、國家科技部、Nature、Nat. Chem.等學術機構或媒體雜志的亮點報道。(5)已培養10余名畢業優秀博士生(先后到哈佛大學、芝加哥大學等大學進行博士后研究),多名學生已在國內知名大學任教授。(6)李闖創教授曾獲得或入選:國家杰出青年基金、第三批中組部萬人計劃領軍人才、科技部中青年科技創新領軍人才、國家基金委優秀青年基金、廣東省自然科學獎一等獎、深圳市自然科學獎一等獎、中國化學會“維善”天然產物合成化學獎、藥明康德生命化學研究獎等。課題組網站鏈接:https://li.chem.sustech.edu.cn/李闖創教授課題組常年招聘博士后、博士研究生、保送推免研究生等,歡迎來信與李闖創教授聯系(E-mail: ccli@sustech.edu.cn)。文獻詳情:
Intramolecular [3 + 2] annulation of allenylsilane-enes: Direct synthesis of highly strained trans-fused 5/5 ring systemsNa Lv,Jing-Chun Han,Peng Zhang,Xin Li,Lung Wa Chung,Chuang-Chuang Lihttps://doi.org/10.1016/j.chempr.2023.08.009