

(圖片來源:Nature)
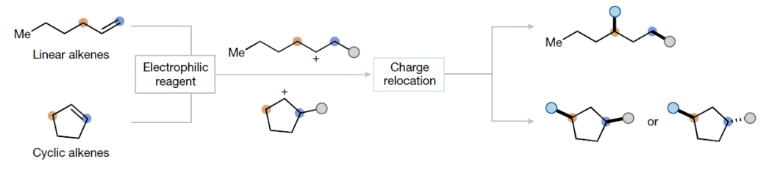
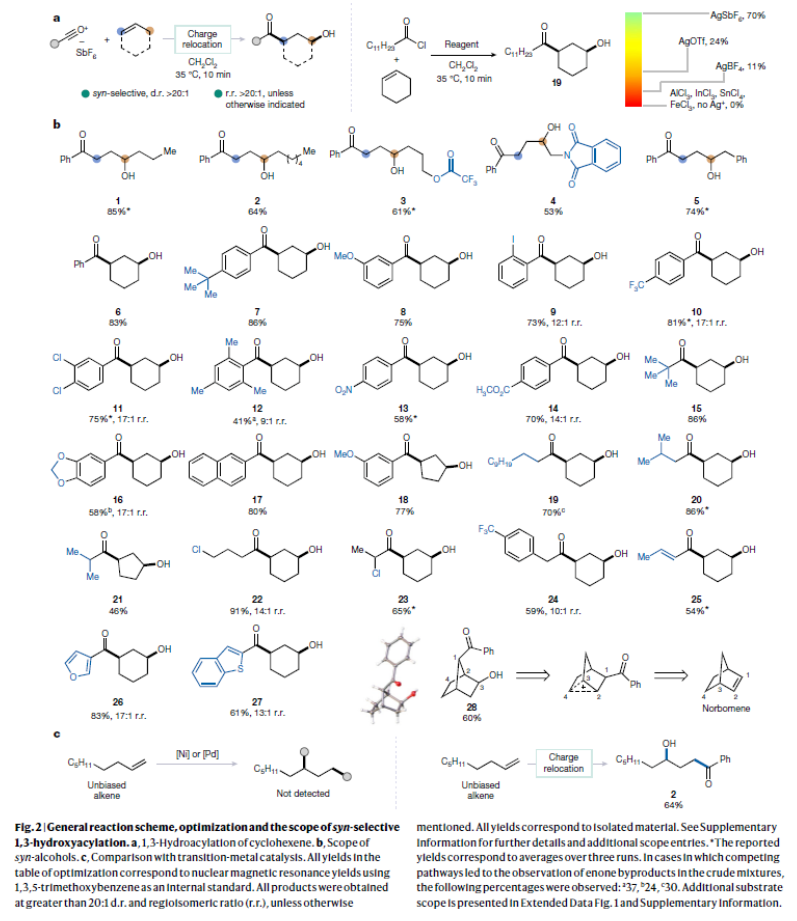
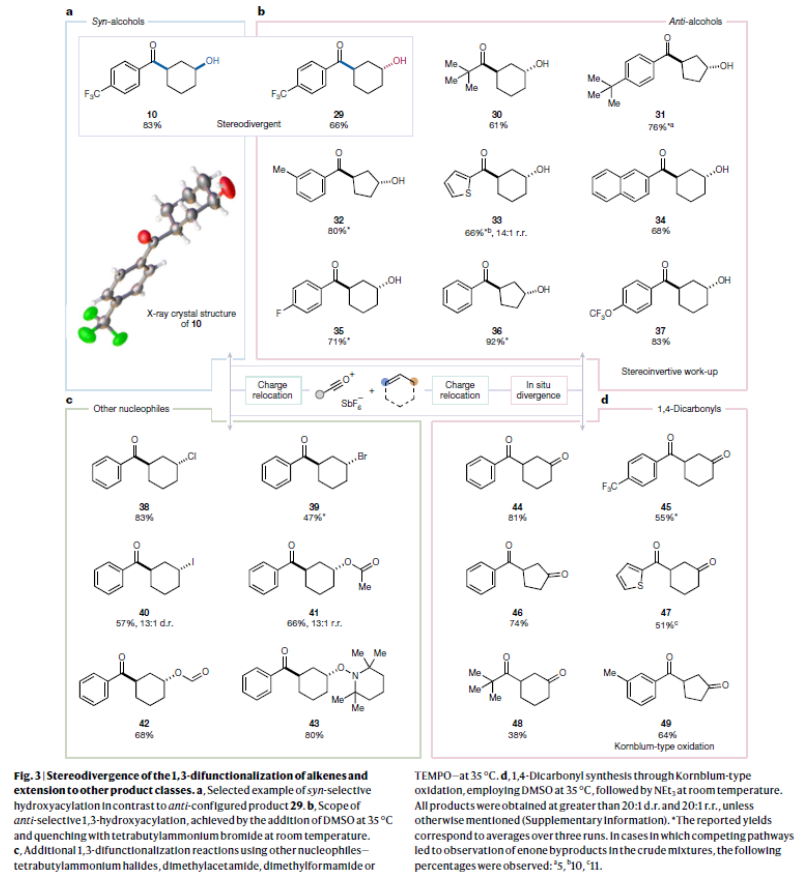
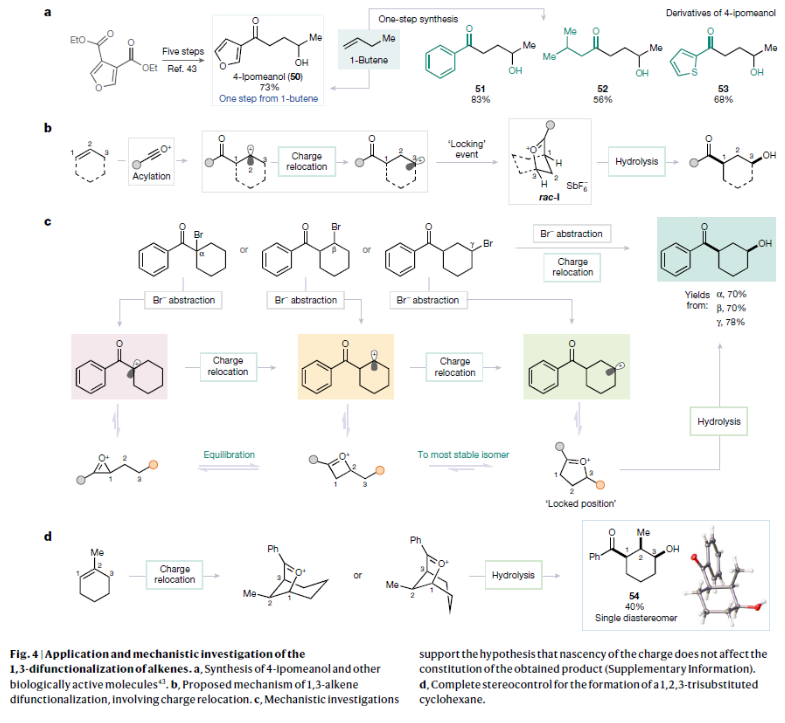
正文 烯烴的官能團化反應是每位本科生在化學學習過程中的重要內容,其可以大致分為兩類:1)臨時(烯烴復分解)或永久(臭氧分解)C=C鍵斷裂的轉化;2)產物保持原始C-C σ鍵連接的轉化。在后者中,1,2-雙官能化反應包括從經典的鹵化反應到復雜的過渡金屬催化反應。近些年,化學家們實現了遠程官能團化反應。目前,文獻中出現了許多利用過渡金屬催化實現烯烴1,3-雙官能化反應的例子。此類方法總是依賴于導向基團或“stopper”來實現區域選擇性(Fig. 1a)。同樣,烯烴的Friedel–Crafts類型反應也得到了廣泛的探索(Fig. 1b)。但化學家們對控制這種轉化的選擇性或可預測性的因素知之甚少,而非活化和非官能團化烯烴的直接1,3-雙官能團化仍是一個未解決的挑戰。最近,奧地利維也納大學Nuno Maulide課題組發展了一種基于“電荷重定位”概念的烯烴1,3-雙官能團化反應。該轉化利用非活化烯烴,在不需要導向基團的情況下,以立體發散的方式分別獲得了順式或反式構象的1,3-雙官能團化產物(Fig. 1c)。下載化學加APP到你手機,收獲更多商業合作機會。 (圖片來源:Nature) 通過一系列嘗試,作者發現使用環己烯與酰氯和六氟銻酸銀原位生成的酰基正離子反應,通過水解可以選擇性地形成相應的1,3-羥酰基化產物。隨后,作者探索了此轉化的底物范圍(Fig. 2b),一系列線性烯烴在一系列鏈長范圍展現出良好的收率(1, 85%和2, 64%)。此外,一系列官能團也可以兼容,以良好的收率得到相應的三氟乙酸酯(3, 61%)或鄰苯二胺(4, 53%)產物。值得注意的是,使用4-苯基-1-丁烯(由于芐基存在而具有潛在偏倚的底物)時也僅得到了1,3-雙官能團化產物5(74%),而芐位保持不變。此外,各種芳烴取代的酰基離子,無論其電性或空間位阻如何,均可得到相應的產物7-17(41-86%)。對于環戊烯衍生的酮醇18以及由脂肪族酰基離子加成所得的產物19-24也均觀察到了相同的立體化學結果。值得注意的是,丙烯酰基衍生的酰基離子也以54%的產率得到目標產物25,且帶有雜芳基的產物26(83%)和27(61%)也是如此。最后,當使用降冰片烯反應時,中間形成的帶正電物種通過重排,以60%的產率得到28。 Fig. 2c展示了該方法與先前報道的方法分別實現烯烴的1,3-雙官能團化比較。當使用1-壬烯為底物反應時,在鎳或鈀催化條件下并沒有得到1,3-雙官能團化產物,僅觀察到Heck偶聯產物或分解的產物。相比之下,利用此方法本可以以64%的分離產率得到1,3-雙官能團化產物2。 (圖片來源:Nature) 在隨后的研究中,作者發現如果在后處理之前加入二甲基亞砜(DMSO),則可以以良好的立體選擇性得到相應的反式-羥酰基化產物29-37(通常大于20:1 dr),從而能夠以立體發散的方式實現任何一種異構體的合成(Fig. 3)。當在體系正弘加入其它親核源如氯化物(38)、溴化物(39)或碘化物(40)時可以以47-83%的產率得到反式鹵化產物38-40。有趣的是,當加入N,N-二甲基乙酰胺或甲酰胺等酰胺時,可以分別以66%和68%的產率得到反式酰氧基酰化產物41和42。更有趣的是,加入TEMPO時可以以80%的產率得到43。值得注意的是,當加入DMSO后再用三乙胺處理,可以以38-81%的產率得到1,3-酮酰化反應產物44-49。這也是首次實現了將簡單烯烴轉化為1,4-二羰基化合物。 (圖片來源:Nature) 為了探索此1,3-雙官能化反應的實用性,作者探索了其潛在的合成應用。4-ipomeanol (50)是一種具有蛋白質結合活性(N-乙酰半胱氨酸和N-乙酰賴氨酸)的肺原毒素,據報道其需要經歷五步才能合成出來(Fig. 4a)。而利用作者所發展的烯烴1,3-雙官能化反應可以從廉價的1-丁烯一步直接實現該化合物的合成。此外,利用此方法還可以實現其苯基類似物51(83%)和其它衍生物52(56%)和53(68%)的合成。從機理的角度來看(Fig. 4b),作者認為上述1,3-雙官能化反應的實現是通過快速的異構化。在熱力學控制下,親電加成所形成的第一個中間體β-酮陽離子轉化為重排的環氧碳正離子rac-I,而rac-I的形成可以防止進一步異構化和非選擇性產物的形成。隨后,這種中間體以水解方式(順式構型產物)或者通過與其它親核試劑在取代反應形成反式構型產物。 Fig. 4c所展示的機理實驗可以很好的證明“電荷重定位”的概念。作者發現無論碳正離子最初是在哪里形成的,絕大多數起始原料均可以轉化為預期的1,3-雙官能化產物。即碳正離子被遷移到γ位,與它的生成狀態無關。 (圖片來源:Nature) 總結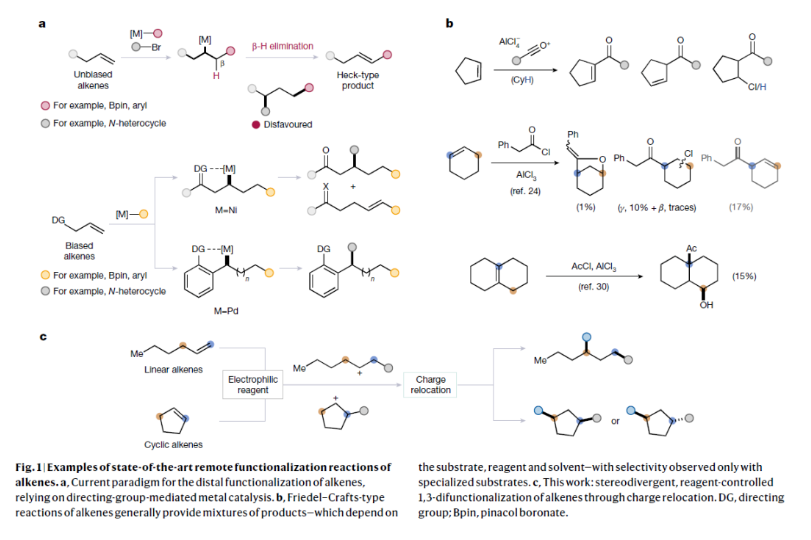
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn