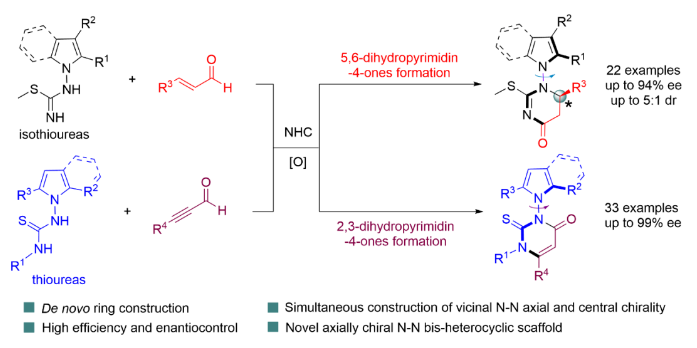
N-N軸向手性化合物由于其獨特的骨架,在有機催化、藥物傳遞以及手性配體領域有著廣泛的應用。尤其是吲哚衍生物在藥物的發現和開發中起著重要的作用(Figure 1a)。因此,N-N軸手性吲哚框架的構建成為一個重要的研究方向。近幾年報道合成它的方法包括金屬催化策略,如銅、鈀、銥和銠等催化;有機小分子催化策略如手性磷酸、布朗斯特堿等催化。然而,這些方法主要集中在單一N-N軸手性的構建(Figure 1b)。值得注意的是,N-N軸手性吡咯/吲哚骨架六元雜環的高選擇性合成,同時控制多手性元素(軸手性和中心手性)仍然具有較大的挑戰性。近日,西北工業大學魯神賜課題組與新加坡國立大學Ming Wah Wong教授(提供理論計算)合作報道了一種用氮雜環卡賓催化阻轉選擇性(3 + 3)環加成反應策略,利用異硫脲與烯醛反應從而構建具有連續中心手性和N-N軸手性的吡咯/吲哚骨架六元雜環化合物;利用硫脲與炔醛合成N-N軸手性吡咯/吲哚骨架六元雜環化合物(圖1c) 。
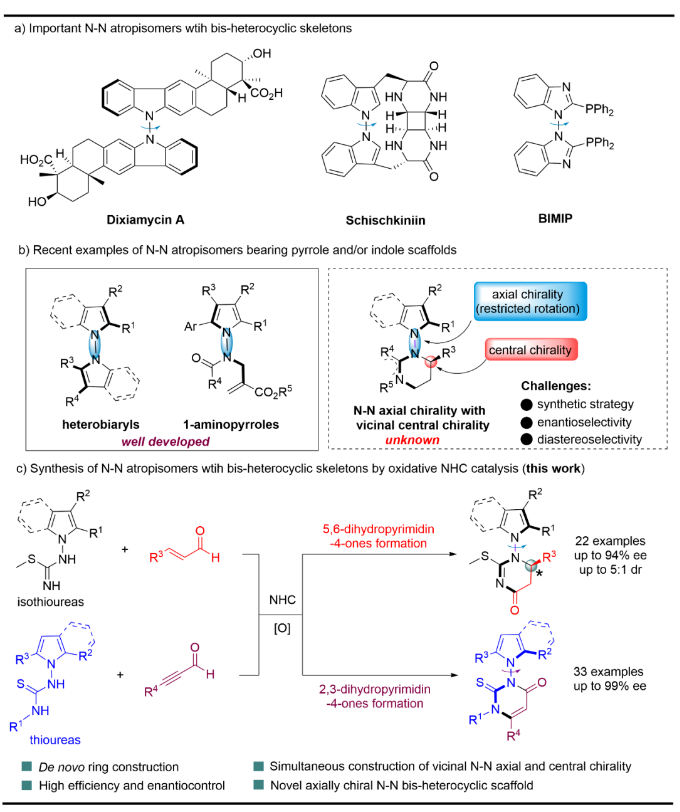
Figure 1.Importance and atroposelective synthesis of N–N Linked bis-heterocyclic skeletons(圖片來源: Nat. Commun.)
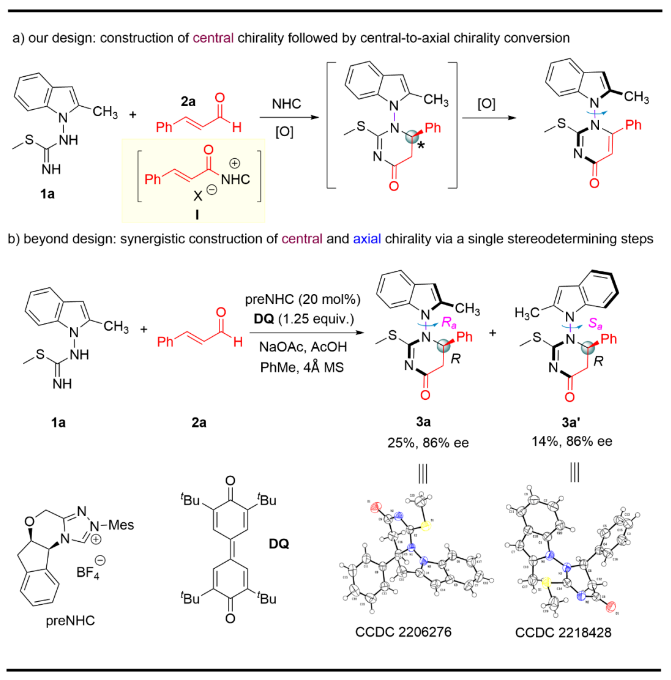
通過氧化中心手性轉化為軸手性是合成軸手性化合物的有效策略之一,基于這一策略,作者設計在氮雜環卡賓(NHC)催化下, 以異硫脲1a和肉桂醛2a作為底物生成中心手性化合物,進一步氧化生成N-N軸手性化合物(Figure 2a)。實驗結果表明,異硫脲1a和肉桂醛2a在卡賓催化下生成兩個化合物3a和3a′,它們可以通過柱層析分離,分別得到25%和14%的產率,對映選擇性均為86%。通過單晶X射線衍射分析,它們為一對非對映異構體,并且確定了它們的絕對構型。此結果表明通過該方法可以一步高效構造含有相鄰碳手性中心的N-N軸手性吲哚軸手性化合物(Figure 2b)。 Figure 2. Discovery of N–N axially chiral indole with vicinal central chirality synthesis(圖片來源: Nat. Commun.)
通過條件篩選,獲得最優反應條件后,以異硫脲1a和烯醛2作為底物探究了該反應的適用范圍(Figure 3)。反應結果表明,烯醛的苯環被雜芳環取代不受電子效應和定位效應的影響,均能以良好的產率和優秀的對映選擇性得到目標產物(3a-3j)。烯醛的苯環被雜原芳環取代不影響反應結果,生成相應的產物3k。此外,該策略也適用于β-乙烯基烯醛,得到相應的產物(3l),產率中等,對映體選擇性良好。烷基烯醛也可在最優條件下以73-80%的ee值得到所需的兩種非對映異構體(3m)和(3m’)。 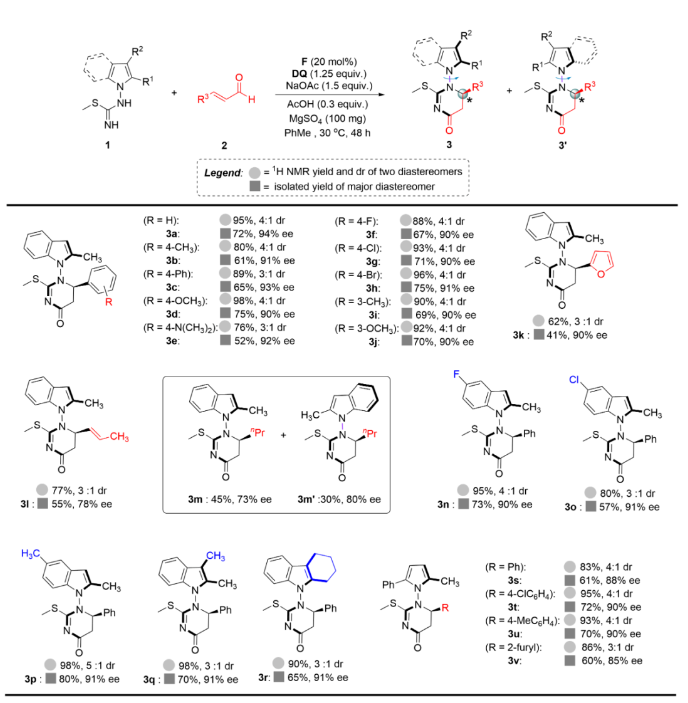
Figure 3. Scope of N–N axially chiral indoles and pyrroles with vicinal central chirality(圖片來源: Nat. Commun.)
隨后,作者對異硫脲底物1進行了擴展。5位不同取代的吲哚底物、2,3-二甲基或環己基也能得到相應的產物(3n-3r),產率良好,ee值優異。為了進一步擴大底物的適應范圍,作者還對吡咯異硫脲進行了測試。對位吸電子基和給電子基肉桂醛包括呋喃丙烯醛對該反應耐受性良好,反應產率高,對映選擇性優異(3s-3v)。最后,在室溫條件下,使用碘作為氧化劑在DMSO溶液中氧化兩個非對映異構體3a和3a',分別得到了單一軸手性產物4以及其對映異構體ent-4(Figure 4),同時,在吲哚的3位上引入碘原子。單晶X射線衍射分析明確了4的絕對構型。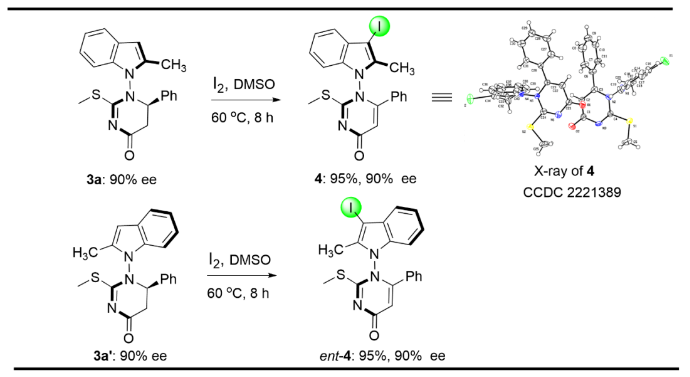
Figure 4. Oxidation of 3a and 3a' into enantiomeric compounds 4 and ent-4(圖片來源: Nat. Commun.)
除此之外,作者使用硫脲類底物5與炔醛類化合物6實現了單一N-N軸手性產物的合成。作者在最優條件下進行了反應的底物擴展(Figure 5)。底物5的N -苯基上常用的強吸電子基團(CF3)有很好的耐受性 (7b-7c),產率中等,對映選擇性為90-94%。不幸的是,N -苯基上帶有中性或給電子基團的底物導致了副產物的產生。在確定的最佳條件下,作者研究了底物5吡咯苯基對位上給電子基團和吸電子基團的變化,它們具有良好的耐受性,以中等產率和優異的對映選擇性(85-93% ee)得到相應的產物7d-7j。作者對吡咯苯環上不同的鄰位和間位取代基進行了測試,得到了相應的產物7k- 7o,產率中等,對映選擇性優異(90-99% ee)。單晶X射線衍射分析明確了7l的絕對構型。隨后,對炔醛6苯環上電子效應進行了考察,電子效應對反應結果有明顯影響,給電子取代基有利于該反應的發生。反應產物7p-7ab產率中等,對映選擇性良好(95-98% ee)。為了進一步擴大底物的范圍,還對吲哚硫脲進行了測試。二位取代(甲基或苯基)吲哚硫脲耐受性良好,分別得到產率中等,對映選擇性高的7ac和7ad。含有P(O)Ph2基團的底物以65%的產率和86%的ee值成功地合成產物7ae。 
Figure 5. Scope of N–N axially chiral pyrroles and indoles bearing a 2,3-dihydropyrimidin-4-one moiety(圖片來源: Nat. Commun.)
該N-N軸手性化合物可以通過簡單的操作轉化為帶有高活性官能團的產物:3a與苯基格氏試劑以四氫呋喃為溶劑在零下15度下反應6個小時,發生了水的消除反應以91%的產率和90%的對映選擇性得到目標產物10(Figure 6-1)。此外,產物4在金屬鈀的催化下與三甲基硅基乙炔反應得到硅基保護的炔類軸手性化合物,該化合物無需任何的純化,隨后使用KF脫去硅烷保護基得到了具有乙炔基的軸手性產物11,該反應的兩步反應總產率為95%且反應過程中產物的對映選擇性保持不變(Figure 6-2)。具有二苯基磷氧基團的化合物7ae通過三氯硅氫的還原反應可得到軸手性膦配體13(Figure 6-3)。該反應在減壓下除去溶劑后,殘渣無需進一步純化即可使用,反應產率為84% yield,對映選擇性為85%。該N-N軸手性的單磷配體13作為手性配體在金屬鈀的催化下進行了烯丙基化反應,結果得到了具有81%產率和40%對映選擇性的烯丙基化產物16 (Figure 6-4)。實驗結果表明,所得到的N-N軸手性的單磷配體在金屬催化領域具有廣闊的應用前景。 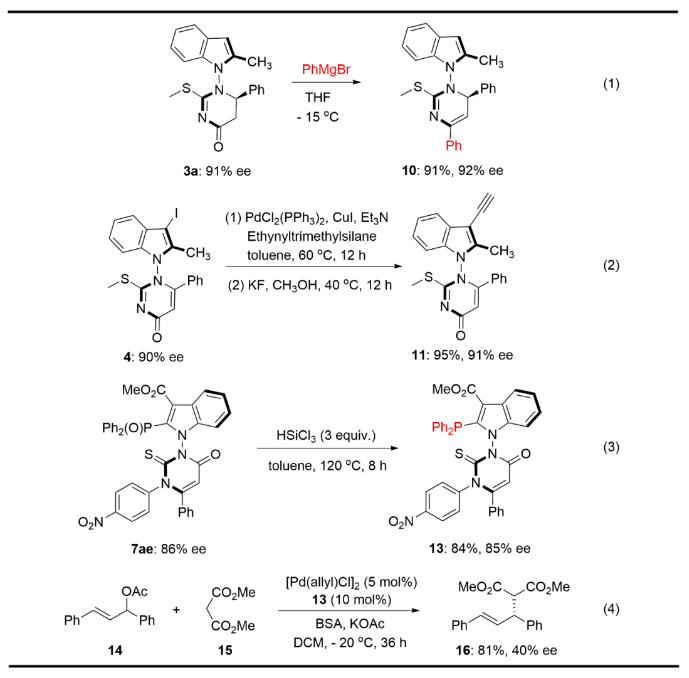
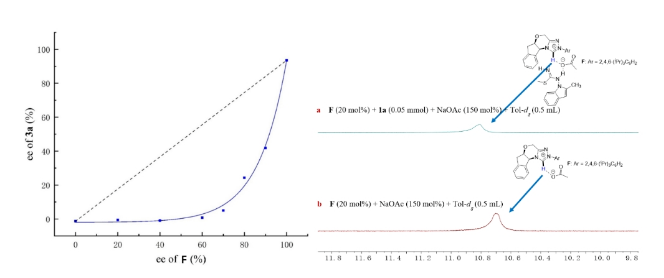
Figure 6. Transformations and application of chiral phosphine ligand.(圖片來源: Nat. Commun.)Figure 7. (left) Nonlinear effect with respect to product ee and catalyst ee; (right)chemical shift of the acidic proton of the NHC pre-catalyst F under various conditions.(圖片來源: Nat. Commun.)
為了研究卡賓催化劑F的ee值與產物3a的ee值之間的變化過程,反應體系中使用了不同ee值的催化劑。如圖Figure 7 left所示,當卡賓催化劑F的ee值由0%逐漸增加到70%時,產物3a的ee值并沒有明顯的提升;當卡賓催化劑F的ee值由70%增加到100%時,產物3a的ee值有了驟升的現象。手性卡賓催化劑F的ee值與產物3a的ee值并不是線性關系。該結果證明該反應呈現負向非線性效應。為了進一步了解該反應機理,證實催化劑F和異硫脲1a之間的相互作用,作者進行了1H NMR分析(Figure 7 right)。在催化劑F和堿NaOAc的混合物中加入異硫脲1a后,F的酸性質子的化學位移下降了0.15 ppm (Figure 7 a vs 7b)。這一結果表明催化劑F與異硫脲1a之間存在相互作用。結合NLE實驗,第二個NHC分子可能與異硫脲1a之間存在氫鍵作用。基于以上的實驗結果作者對該反應機理進行猜測,從F-2生成F-3開始,他們提出第二個卡賓催化劑可以作為布朗斯特堿,通過氫鍵來激活1a (Figure 8)。 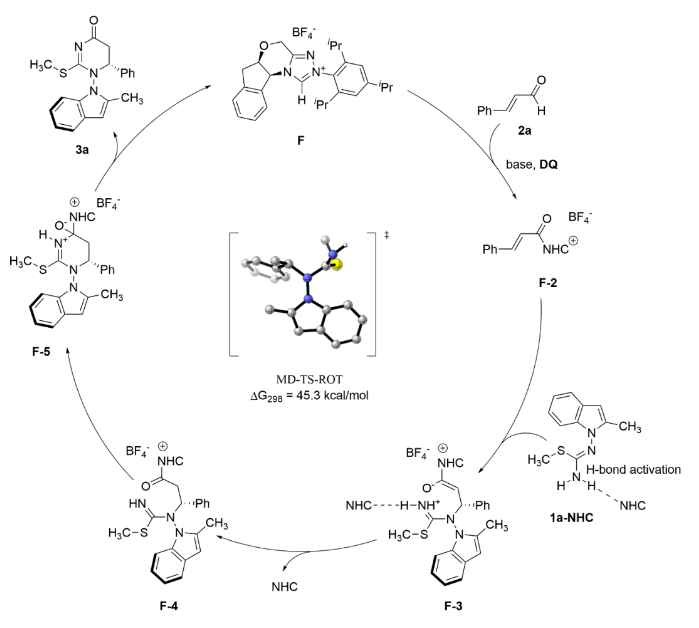
Figure 8. Proposed catalytic cycle. C-H hydrogens are hidden for clarity.(圖片來源: Nat. Commun.)
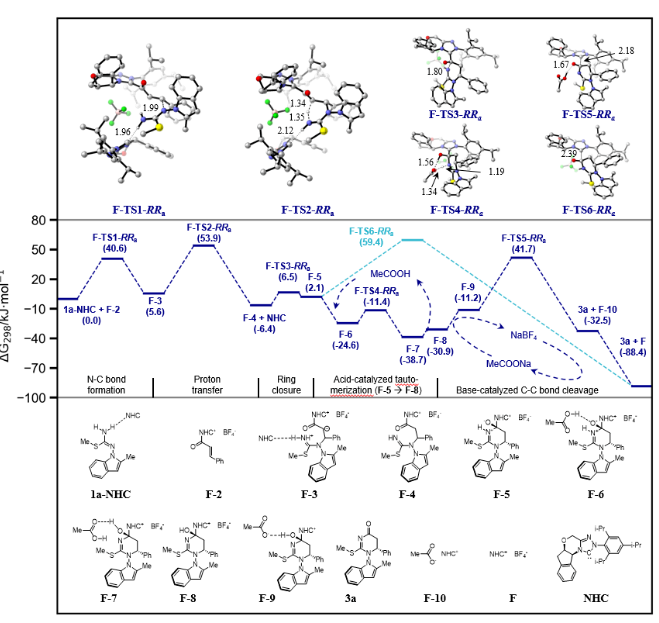
并且通過計算對反應機理進行了近一步佐證,計算結果顯示(Figure 9),C-C鍵斷裂時的過渡態F-TS6-RRa的能量最高,為59.4 kJ/mol。N-C鍵形成(過渡態F-TS1-RRa)、質子轉移(過渡態F-TS2-RRa)環閉合過渡態F-TS3-RRa的能量較低,分別為40.6、53.9和6.5 kJ/mol。排除計算誤差,這將意味著該反應符合Curtin-Hammett定律,反應的立體選擇性將由C-C鍵斷裂時的過渡態控制。作者注意到F-TS6-RRa的直接產物是一個質子化的3,需要將這個質子重新轉移到催化劑F上來完成催化循環。接下來,作者研究了是否可以通過添加堿或酸來降低這一步的高勢壘,并通過這個思路找到了一條能量較低的新反應路徑。新路徑的第一步是醋酸催化F-5 (2.1 kJ/mol)異構化為能量較低的F-8 (-30.9 kJ/mol)。計算結果表明這一步是相當容易的。在共軛堿乙酸鈉存在的情況下,C-C鍵裂解的過渡態變為F-TS5-RRa,能量也降至41.7 kJ/mol。根據計算結果和Curtin-Hammett原理,作者得出了反應的立體化學是由反應路徑中的F-TS2過渡態的不同非對映體所控制。由于過渡態中存在許多低頻率的分子振動(frequencies < 30 cm-1),并且第二個卡賓分子僅通過弱氫鍵結合,使得計算很難非常準確得預測反應的立體選擇性。事實上,計算得到的立體選擇性與實驗并不完全一致。目前仍然缺乏對負NLE機制的明確解釋。 Figure 9. Calculated reaction profile at M06-2X/6-311+G(2d,p)-SMD(toluene)//M06-2X/6-31G(d)-SMD(toluene) level of NHC-catalyzed atroposelective construction of N–N axially chiral indoles.(圖片來源: Nat. Commun.)