



正文
Peniciketal A-C(1-3)于2014年首次從真菌Penicillium raistrickii中分離獲得。這些化合物具有共同的苯環(huán)、苯并環(huán)化的6,6-或6,5-螺縮酮環(huán)系統(tǒng)和2,8-二氧雜雙環(huán)[3.3.1]壬烷部分,其絕對構(gòu)型通過單晶X-射線衍射分析確定(圖1)。這些結(jié)構(gòu)在天然產(chǎn)物中并不常見,具有挑戰(zhàn)性的骨架。Peniciketals對A549、HL-60和 K562癌細胞系表現(xiàn)出潛在的細胞毒性(IC50值分別為0.31、0.085和0.23 μM)。下載化學加APP到你手機,更加方便,更多收獲。
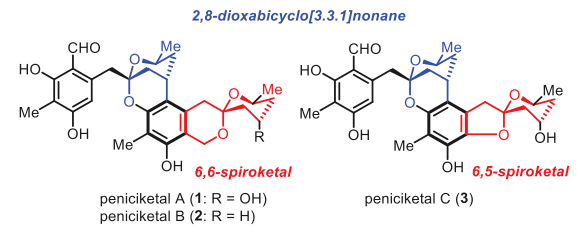
圖1. Peniciketals的結(jié)構(gòu)
由于其有趣的結(jié)構(gòu)和生物活性,Peniciketals引起了有機化學家和生物科學家的廣泛關(guān)注。然而,直到2021年,Amos B. Smith III課題組才首次報道了(+)-Peniciketal A和B的全合成,作者應(yīng)用了三組分I型陰離子接力化學策略構(gòu)建苯并環(huán)[6,6]螺縮酮結(jié)構(gòu)以及他們開發(fā)的光異構(gòu)化/環(huán)化聯(lián)合方案構(gòu)建復(fù)雜的苯并稠合2,8-二氧雜雙環(huán)[3.3.1]壬烷骨架。盡管取得了重大進展,但通過異頭效應(yīng)穩(wěn)定的苯環(huán)化[6,6]螺縮酮片段在酸性條件下或多或少不穩(wěn)定,這可能使后續(xù)合成更具挑戰(zhàn)性。開發(fā)一種匯聚且有效的Peniciketal合成方法,包括螺縮酮的后期構(gòu)建,對于加速合成和生物活性研究是非常必要的。
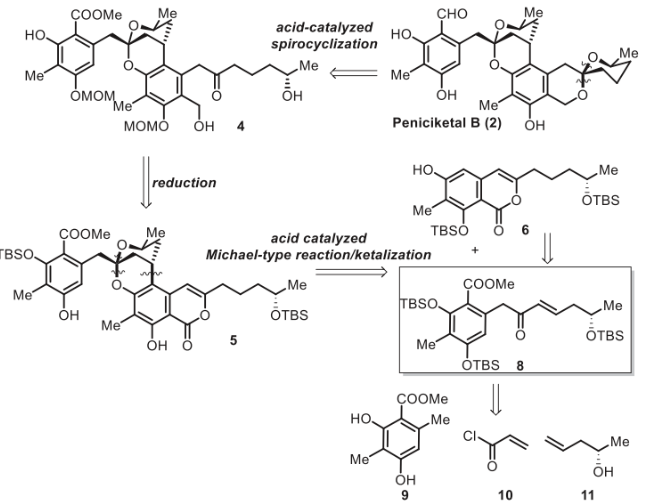
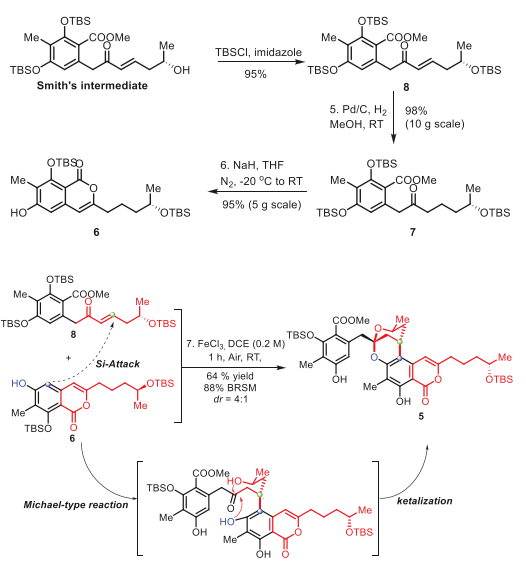
馬愛軍團隊長期致力于高效合成結(jié)構(gòu)獨特的螺縮酮天然產(chǎn)物。在此,他們報道了(+)-Peniciketal B (2)的簡明不對稱全合成。逆合成分析如圖2所示。首先,注意到(+)-Peniciketal B (2)的結(jié)構(gòu)似乎包含了兩分子化合物8的大部分結(jié)構(gòu)。(+)-Peniciketal B (2)可由前體二羥基酮4通過酸催化螺環(huán)化反應(yīng)生成。前體4可以通過5的內(nèi)酯開環(huán)來構(gòu)建。5中的苯并稠合2,8-二氧雜雙環(huán)[3.3.1]壬烷結(jié)構(gòu)可以通過8與6的串聯(lián)分子間酸催化的連續(xù)Michael加成/雙環(huán)化直接形成。然而,這種在天然產(chǎn)物合成中安裝高度功能化片段的應(yīng)用鮮有報道。這些因素使得6和8所需的串聯(lián)反應(yīng)極具挑戰(zhàn)性。化合物8由手性起始原料(+)-高烯丙醇制備。
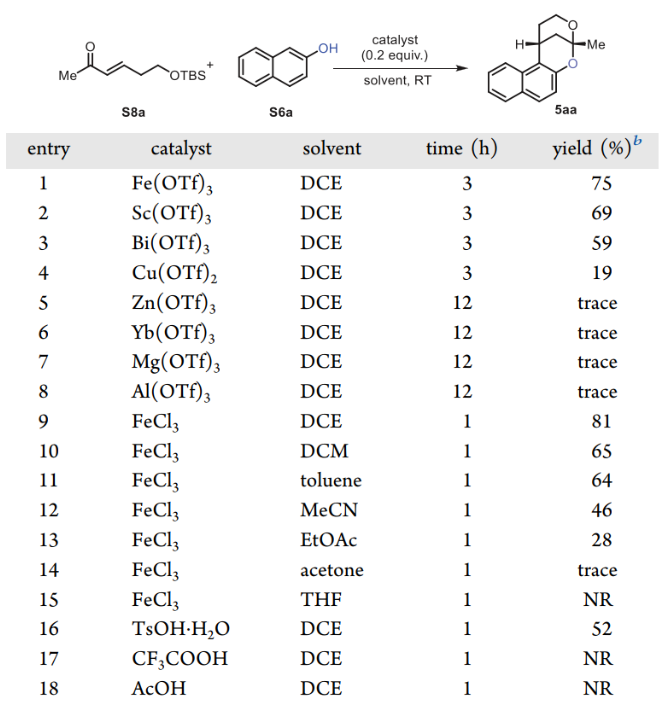
有了前體6和8,作者探索了關(guān)鍵的分子間催化劑控制的串聯(lián)Michael-型反應(yīng)/雙環(huán)化過程。從模擬底物 2-萘酚S6a和S8a 開始,考慮到關(guān)鍵過程包括三個步驟(Michael-型反應(yīng)、脫硅基化和縮酮化),首先篩選了一系列Lewis酸以找到有前景的催化劑。當使用Fe(OTf)3作為催化劑,DCE作為溶劑,成功獲得了所需的產(chǎn)物5aa,收率75%。其他Lewis酸導(dǎo)致產(chǎn)率較低或僅得到痕量的產(chǎn)物。FeCl3 的產(chǎn)率最高,為81%,同時反應(yīng)時間更短。在對不同的Br?nsted酸進行簡單篩選后,只有TsOH·H2O能以52%的產(chǎn)率得到所需的產(chǎn)物5aa。這一關(guān)鍵串聯(lián)過程是在室溫空氣下完成的。
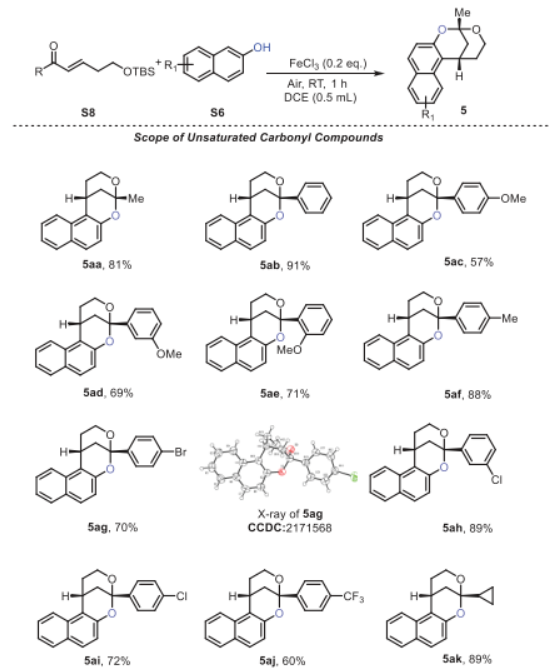
有了最佳反應(yīng)條件,作者通過使用不同的底物形成各種苯并稠合2,8-二氧雜雙環(huán)[3.3.1]壬烷結(jié)構(gòu)來考察該策略的通用性,如圖4中總結(jié)的,取代的α, β-不飽和羰基化合物和萘,在苯環(huán)上的不同位置上具有給電子基(5aa-5af和5ea-5ga)和吸電子基(5ag-5aj和5ba-5da),得到所需的苯并-稠合2,8-二氧雜雙環(huán)[3.3.1]壬烷產(chǎn)物,產(chǎn)率中等至良好。通過單晶確證了5ag的相對構(gòu)型。還可以耐受環(huán)丙烷取代的不飽和羰基,得到相應(yīng)的產(chǎn)物,產(chǎn)率為89% (5ak)。此外,4-羥基香豆素和1,3-環(huán)己二酮也具有耐受性,并分別以48%和46%的產(chǎn)率提供了所需的化合物5ha和5ia。
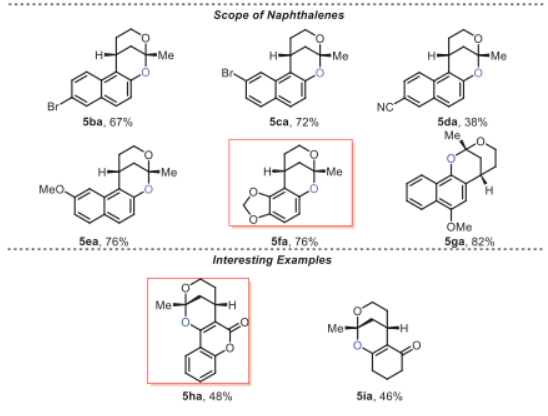
受到這些結(jié)果的鼓舞,特別是5fa和5ha的成功合成,作者將該反應(yīng)擴展到更具挑戰(zhàn)性的化合物5的合成,該化合物具有苯并稠合的2,8-二氧雜雙環(huán)[3.3.1]壬烷部分。首先,從中間體8的不對稱合成開始。化合物8是由Smith中間體通過TBS保護制備的。通過氫化8得到酮7,產(chǎn)率98%。然后,用氫化鈉的THF溶液處理化合物7,得到取代的異香豆素6,產(chǎn)率95%。在標準條件下,6和8反應(yīng),以 4:1 dr獲得了5,分離收率為64%(基于回收的6為88%)。8的高烯丙基OTBS基團導(dǎo)致si-面進攻是有利的方式。值得一提的是,在此步驟中同時脫除了兩個TBS基。
圖片來源:Org. Lett.
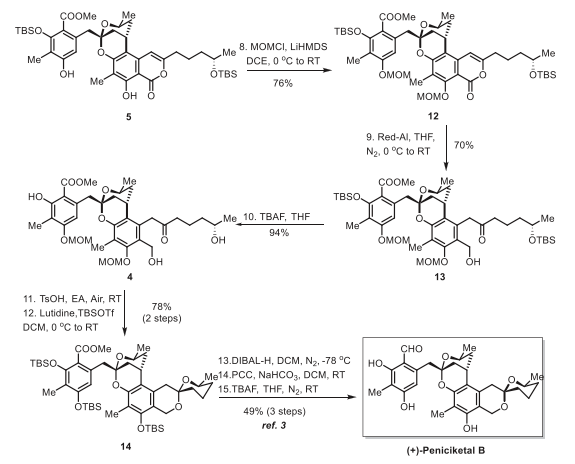
完成關(guān)鍵的串聯(lián)反應(yīng)后,繼續(xù)完成(+)-Peniciketal B (2)的合成(圖6)。從中間體 5開始,最初的努力旨在還原內(nèi)酯羰基以得到苯并吡喃。然而,在嘗試許多還原條件后都沒有順利得到期望的產(chǎn)物。作者將注意力轉(zhuǎn)向內(nèi)酯的還原開環(huán)。發(fā)現(xiàn)苯酚的保護在這種轉(zhuǎn)變中是必要的。因此,5的酚羥基的用MOM保護以76%的產(chǎn)率得到化合物12,當在0 °C的THF中使用Red-Al時,內(nèi)酯環(huán)迅速還原為所需的酮13,產(chǎn)率為70%。因此,脫去13的TBS基團得到前體4,收率94%。獲得關(guān)鍵前體4后,接下來就是苯并環(huán)化[6,6]螺縮酮的構(gòu)建。在考察了一系列酸后,發(fā)現(xiàn)在乙酸乙酯中用對甲苯磺酸處理4生成了苯并環(huán)化的[6,6]螺縮酮,直接TBS保護,通過兩步獲得了Smith中間體14,產(chǎn)率為78%。最后,根據(jù)文獻報道,通過三步將螺酮縮醛14輕松轉(zhuǎn)化為(+)-Peniciketal B (2),合成樣品的所有數(shù)據(jù)與文獻報道一致。
總結(jié)
聲明:化學加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn