



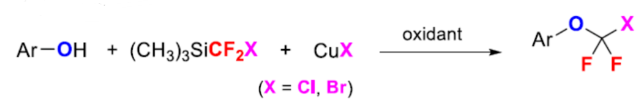
(圖片來(lái)源:J. Am. Chem. Soc.)
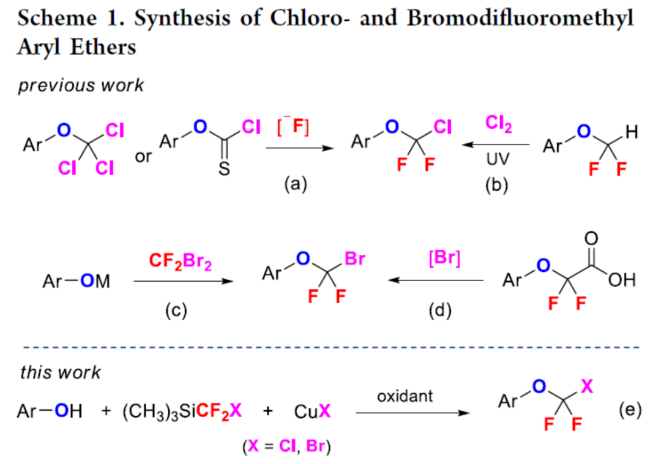
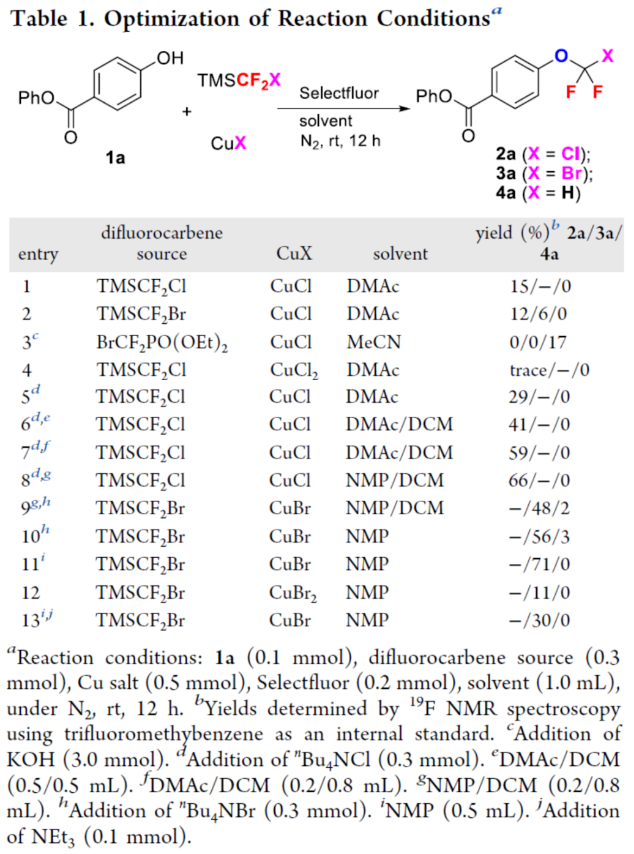
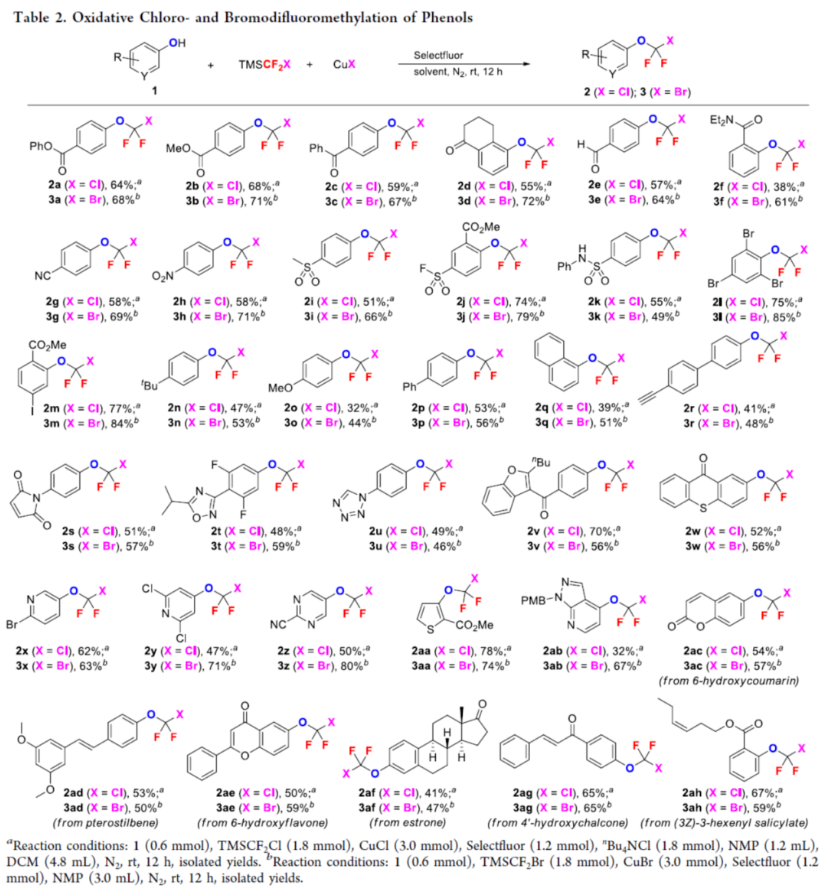
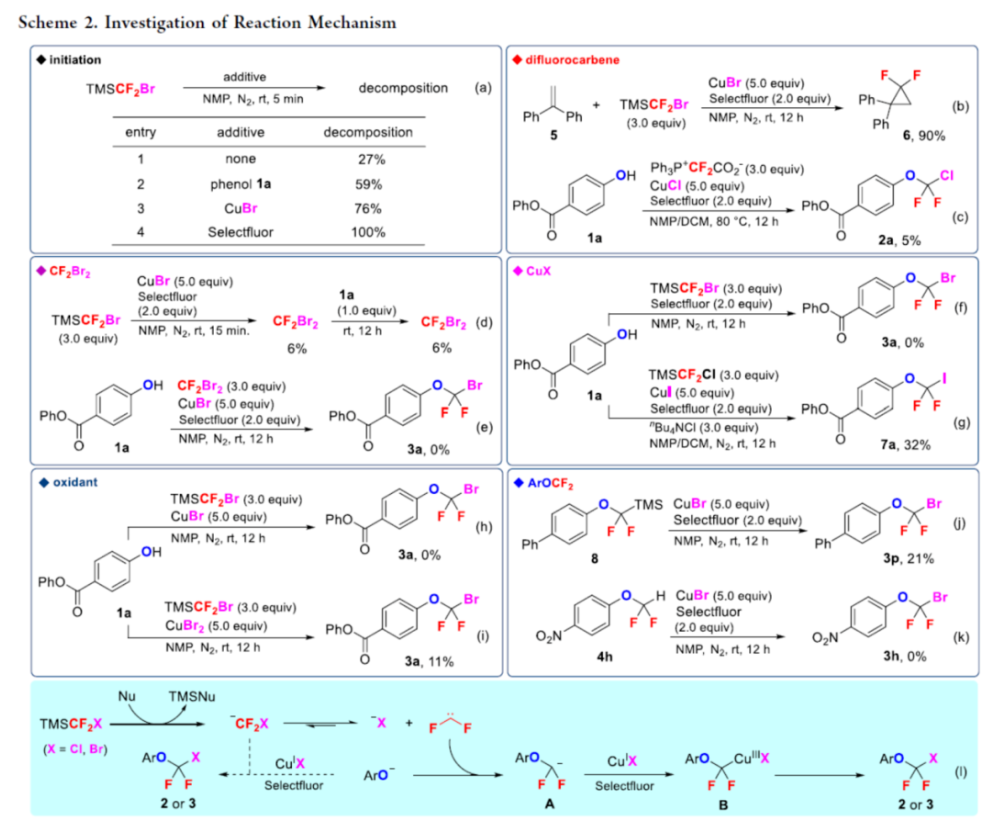
正文 氟烷基醚是開(kāi)發(fā)新藥、農(nóng)用化學(xué)品和材料中具有價(jià)值的結(jié)構(gòu)骨架。其中,氯代和溴代二氟甲基芳醚(ArOCF2X,X為Cl或Br)廣泛存在于各類(lèi)生物活性化合物中(Figure 1)。例如,2021年FDA批準(zhǔn)的一種BCR-ABL1變構(gòu)抑制劑Asciminib。同時(shí),氯代和溴代二氟甲基芳醚也是制備各種含氟化合物的有用前體。通常,氯代二氟甲基芳醚是通過(guò)三氯甲基芳醚和芳基氯代硫代甲酸酯的親核氟化反應(yīng)(Scheme 1a)或二氟甲基芳醚的光氯化反應(yīng)(Scheme 1b)制備的,但這些方法需使用預(yù)官能團(tuán)化的底物,存在反應(yīng)條件苛刻、化學(xué)選擇性差等問(wèn)題。溴代二氟甲基芳醚的合成主要依賴(lài)于CF2Br2與酚鹽的溴代二氟甲化反應(yīng)(Scheme 1c)。然而,CF2Br2是一種消耗臭氧層的物質(zhì)(ODS),并且溴代二氟甲基芳醚的純化難度大和收率低。2015年,Gouverneur課題組報(bào)道了一種通過(guò)芳氧基二氟乙酸的脫羧溴化制備溴代二氟甲基芳醚的方法,但存在反應(yīng)步驟過(guò)長(zhǎng)的弊端(Scheme 1d)。因此,開(kāi)發(fā)一種通過(guò)苯酚直接合成氯代和溴代二氟甲基芳醚的高效方法非常重要和迫切。近日,上海有機(jī)所卿鳳翎課題組首次報(bào)道了一種通過(guò)苯酚、二氟卡賓前體(CH3)3SiCF2X和CuX(X = Cl或Br)的三組分氧化偶聯(lián)反應(yīng),合成了一系列氯代和溴代二氟甲基芳醚衍生物(Scheme 1e)。下載化學(xué)加APP到你手機(jī),更加方便,更多收獲。 (圖片來(lái)源:J. Am. Chem. Soc.) (圖片來(lái)源:J. Am. Chem. Soc.) 首先,作者以4-羥基苯甲酸苯酯(phenyl 4-hydroxybenzoate)1a作為模型底物,進(jìn)行了相關(guān)三組分偶聯(lián)反應(yīng)條件的篩選(Table 1)。當(dāng)以TMSCF2Cl(3.0 equiv)作為二氟卡賓源,Selectfluor(2.0 equiv)作為氧化劑,CuCl(5.0 equiv)作為銅鹽,nBu4NCl(3.0 equiv)作為添加劑,在NMP/DCM(v/v : 1/4)溶劑中室溫反應(yīng)12 h,可以66%的收率得到氯代二氟甲基芳醚產(chǎn)物2a。同時(shí),當(dāng)以TMSCF2Br(3.0 equiv)作為二氟卡賓源,Selectfluor(2.0 equiv)作為氧化劑,CuBr(5.0 equiv)作為銅鹽,在NMP溶劑中室溫反應(yīng)12 h,可以71%的收率得到溴代二氟甲基芳醚產(chǎn)物3a。 (圖片來(lái)源:J. Am. Chem. Soc.) 在獲得上述最佳反應(yīng)條件后,作者對(duì)底物范圍進(jìn)行了擴(kuò)展(Table 2)。首先,一系列不同電性取代的酚,均可順利反應(yīng),獲得相應(yīng)的產(chǎn)物2a-2w和3a-3w,收率為32-84%。其次,雜芳基酚也與體系兼容,獲得相應(yīng)的產(chǎn)物2x-2ab和3x-3ab,收率為32-80%。此外,該策略還可用于復(fù)雜生物活性分子的后期衍生化,獲得相應(yīng)的產(chǎn)物2ac-2ah和3ac -3ah,收率為42-67%。值得注意的是,該反應(yīng)具有出色的官能團(tuán)兼容性,一系列活性的基團(tuán)(炔基、烯基、羰基、鹵素等)均與體系兼容。然而,硫代酚以低收率獲得相應(yīng)的氯和溴二氟甲基化產(chǎn)物,并且大多數(shù)底物沒(méi)有轉(zhuǎn)化。 (圖片來(lái)源:J. Am. Chem. Soc.) 緊接著,作者對(duì)反應(yīng)機(jī)理進(jìn)行了進(jìn)一步的研究(Scheme 2)。首先,TMSCF2Br在NMP中緩慢分解,并且在1a、CuBr或Selectfluor存在下加速分解(Scheme 2a)。因此,這種氧化反應(yīng)可以通過(guò)用酚鹽、鹵化物或BF4陰離子活化TMSCF2Br來(lái)引發(fā)。其次,當(dāng)1,1-二苯乙烯(5)在上述標(biāo)準(zhǔn)條件下進(jìn)行氧化溴代二氟甲基化反應(yīng)時(shí),可以90%的收率得到偕-二氟環(huán)丙烷6(Scheme 2b)。同時(shí),當(dāng)以Ph3P+CF2CO2?(PDFA)作為二氟卡賓前體,在上述標(biāo)準(zhǔn)條件下進(jìn)行氧化氯代二氟甲基化反應(yīng),可以5%的收率得到產(chǎn)物2a(Scheme 2c)。這些結(jié)果表明,該氧化反應(yīng)通過(guò)二氟卡賓中間體進(jìn)行。此外,將TMSCF2Br與CuBr和Selectfluor混合反應(yīng)后,可以6%的收率得到CF2Br2,并且在向該混合物中加入苯酚1a后,CF2Br2的量沒(méi)有改變(Scheme 2d)。然而,苯酚1a與CF2Br2、CuBr和Selectfluor的反應(yīng)沒(méi)有產(chǎn)生3a(Scheme 2e)。這些結(jié)果表明,原位生成的CF2Br2不參與這種氧化溴代二氟甲基化反應(yīng)。對(duì)照實(shí)驗(yàn)結(jié)果表明,銅鹽對(duì)溴代二氟甲基芳基醚(3a)的形成至關(guān)重要(Scheme 2f)。當(dāng)在氧化氯代二氟甲基化反應(yīng)條件下使用CuI代替CuCl作為銅鹽源時(shí),僅形成碘代二氟甲基產(chǎn)物7a,并且沒(méi)有檢測(cè)到氯代二氟甲烷化產(chǎn)物2a(Scheme 2g)。這些結(jié)果,與CF2Cl陰離子相比,CF2I陰離子的穩(wěn)定性較低,表明銅鹽參與形成ArOCF2-X鍵,而不是ArO-CF2X鍵(X = Cl,Br,I)。反應(yīng)在沒(méi)有氧化劑的情況下沒(méi)有進(jìn)行(Scheme 2h)。相反, TMSCF2Br、CuBr2與苯酚1a反應(yīng),可以11%的收率得到產(chǎn)物3a(Scheme 2i)。這一結(jié)果表明,高價(jià)銅配合物具有雙重作用,即參與ArOCF2?X鍵形成以及合成活性銅(III)配合物的氧化劑。在Selectfluor存在下,(芳氧基二氟甲基)三甲基硅烷8與CuBr的反應(yīng),可以21%的收率得到產(chǎn)物3p(Scheme 2j),從而表明芳氧基三氟甲基陰離子可能是反應(yīng)中間體。相反,將二氟甲基醚4h置于相同的反應(yīng)條件下并沒(méi)有獲得溴化產(chǎn)物3h(Scheme 2k),從而排除了二氟甲基芳基醚作為反應(yīng)中間體的可能性。 基于上述的研究以及相關(guān)文獻(xiàn)的查閱,作者提出了一種合理的催化循環(huán)過(guò)程(Scheme 2l)。首先,TMSCF2X(X = Cl,Br)與親核試劑(酚鹽、鹵化物或BF4陰離子)經(jīng)初始的脫硅基化以及α-消除反應(yīng),生成鹵代二氟甲基陰離子,其可進(jìn)一步轉(zhuǎn)化為二氟卡賓和鹵化物陰離子。然后,苯酚鹽和二氟卡賓的反應(yīng)生成芳氧基二氟甲基陰離子A。在Selectfluor的存在下,芳氧基二氟甲基陰離子A可與CuX(X = Cl,Br)進(jìn)行氧化偶聯(lián)反應(yīng),生成高價(jià)的ArOCF2CuIIIX配合物B。最后,配合物B經(jīng)還原消除后可獲得所需的氯代或溴代二氟甲基芳醚。值得注意的是,通過(guò)銅介導(dǎo)的苯酚與鹵代二氟甲基陰離子的氧化偶聯(lián)的替代途徑不太可能,可能是因?yàn)镃uCF2X(X = Cl,Br)配合物的穩(wěn)定性低。 (圖片來(lái)源:J. Am. Chem. Soc.) 總結(jié)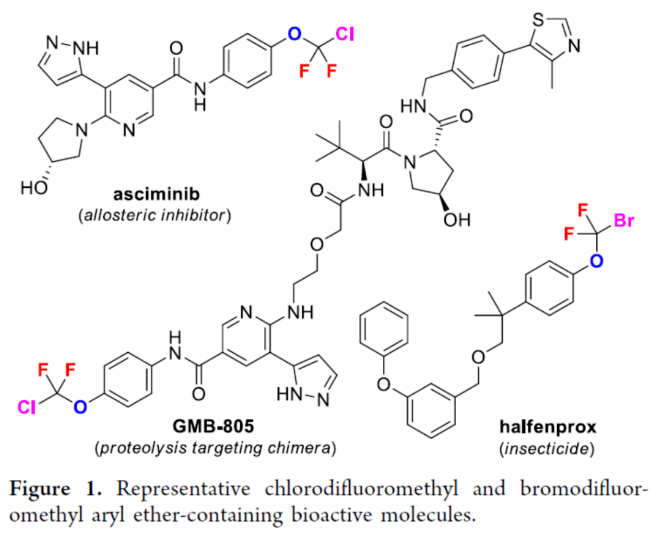
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來(lái)源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請(qǐng)作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話(huà):18676881059,郵箱:gongjian@huaxuejia.cn