

(圖片來源:Nat. Catal.)
正文
高效實現具有多立體中心的復雜結構分子是有機合成中的一個重要目標。理想情況下,從經濟和可持續性的角度來考慮,通過非活化的C(sp3)-H鍵的直接官能團化是一種有效的策略。下載化學加APP到你手機,更加方便,更多收獲。
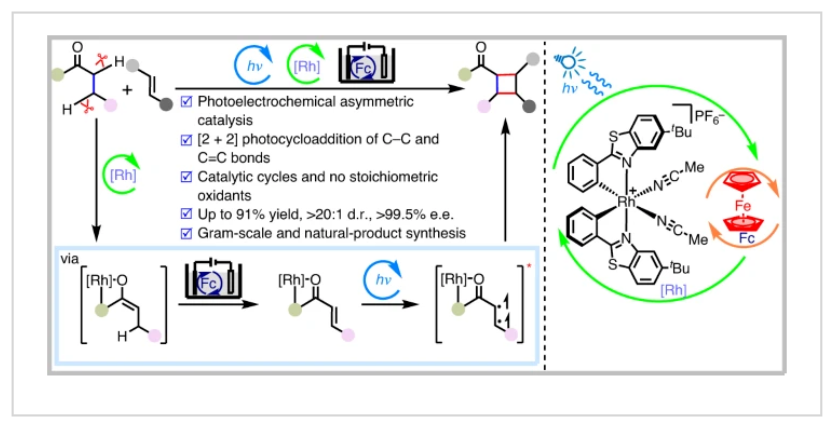
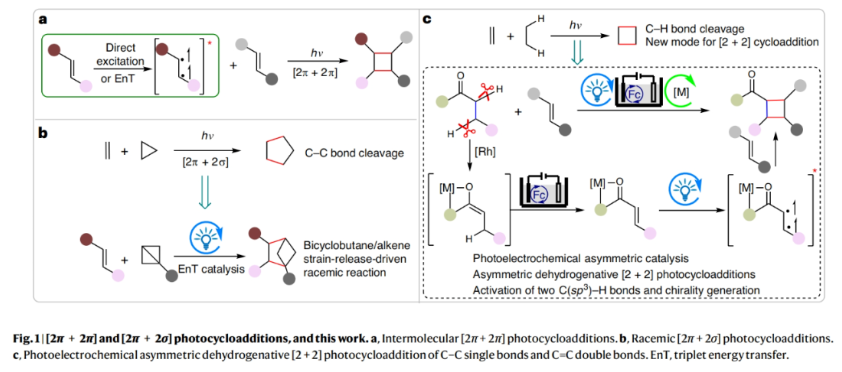
環加成反應是合成化學中的基礎反應,它能在一步反應中高效、原子經濟的構建復雜分子結構。在此類反應中,兩個烯烴的催化不對稱[2+2]光環加成反應是合成手性環丁烷的重要策略之一(Fig. 1a)。然而,經典的[2π+2π]光環加成反應需要兩個C=C雙鍵。而將這些烯烴官能團結合到底物中則需要額外的合成步驟。盡管Glorius課題組和Brown課題組實現了C-C單鍵和C=C雙鍵的[2π+2σ]光環加成反應。但底物僅局限于雙環[2.1.1]己烷,其通過張力釋放促進C-C σ-鍵的裂斷裂,從而得到環戊烷類化合物,且目前僅實現了消旋產物的合成(Fig. 1b)。然而,使用簡單易得的起始原料,通過C-C單鍵與C=C雙鍵直接反應,以立體控制的方式實現環丁烷的合成仍具有很大的挑戰。最近,德國馬爾堡-菲利普大學Eric Meggers課題組發展了一種光/電共催化反應策略,通過C-C單鍵與C=C雙鍵的直接環加成反應,構建了一系列具有多達四個連續立體中心的復雜環丁烷產物(Fig. 1c)。
(圖片來源:Nat. Catal.)
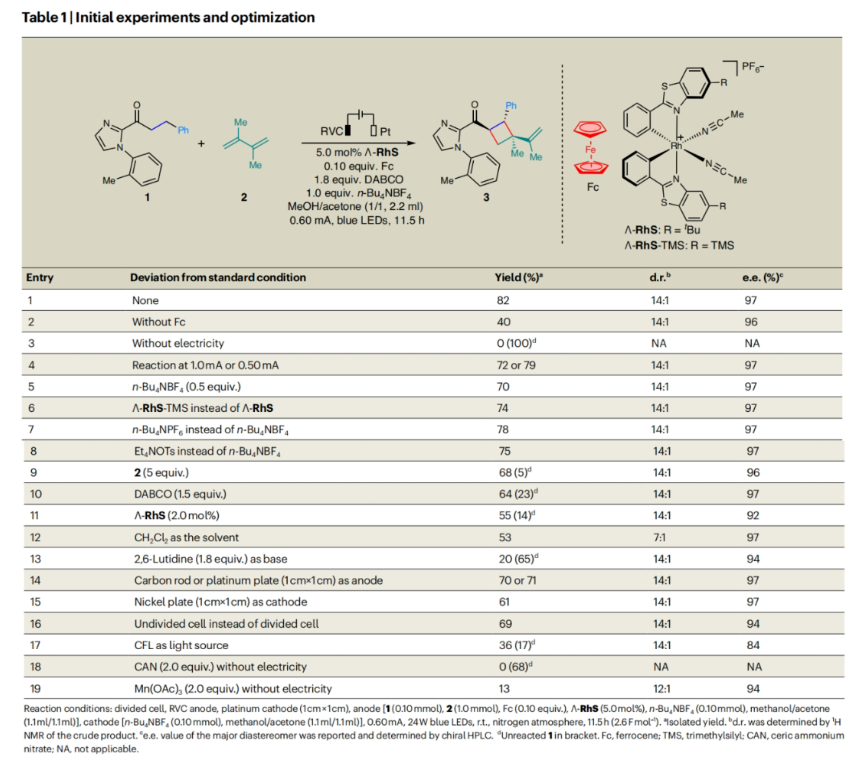
首先,作者選擇2-酰基咪唑1和2,3-二甲基-1,3-丁二烯2作為模板底物,使用RVC作陽極以及鉑板作陰極,對反應條件進行了篩選(Table 1),當使用陽極[1 (0.10 mmol), 2 (1.0 mmol), Fc (0.10 equiv.), Λ-RhS (5.0 mol%), n-Bu4NBF4 (0.10 mmol), 甲醇/丙酮(1.1 ml/1.1 ml)], 陰極[n-Bu4NBF4 (0.10 mmol), 甲醇/丙酮(1.1 ml/1.1 ml)], 0.60 mA, 24 W blue LEDs照射下,室溫,氮氣氛圍中反應11.5 h (2.6 F mol–1)可以以82%的分離產率,97%的ee得到產物3(d.r. = 14:1)(entry 1)。
(圖片來源:Nat. Catal.)
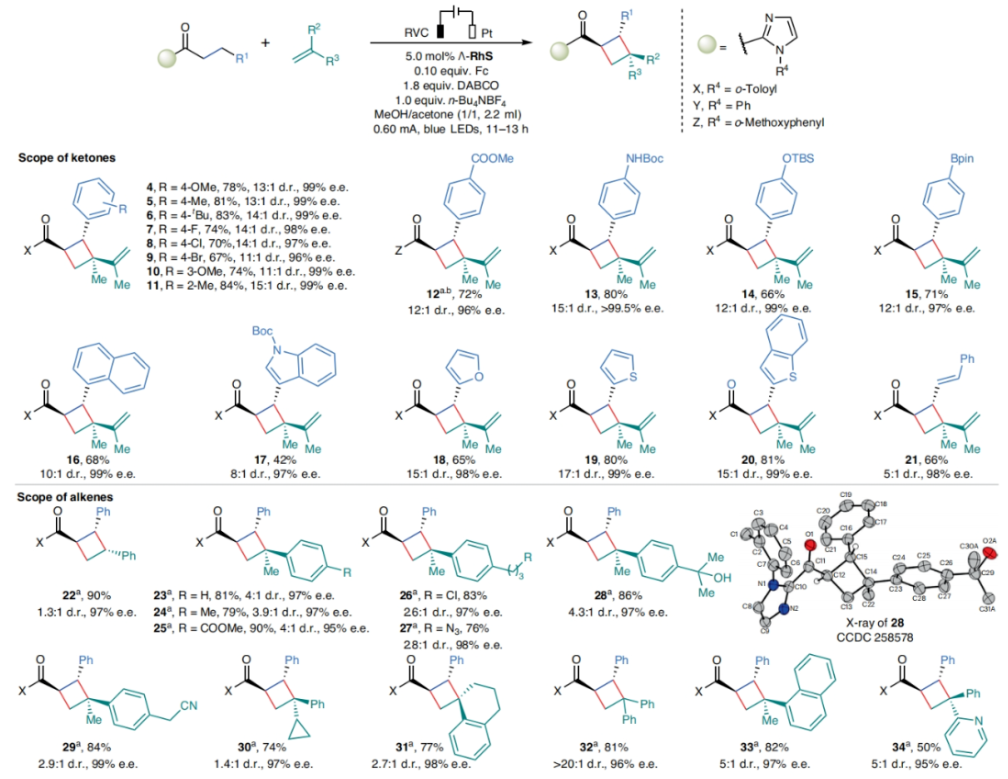
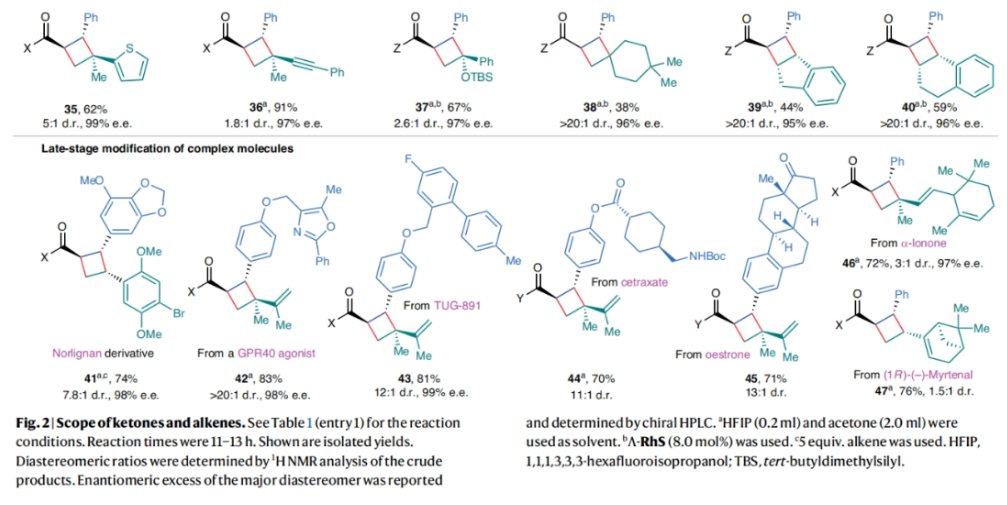
在得到了最優條件后,作者對此轉化的底物范圍進行了探索(Fig. 2)。實驗結果表明,不同取代的酮和烯烴均可以良好的實現此轉化,以38-91%的產率,>95% ee得到相應的產物4-40。其中甲氧基、烷基、鹵素、酯基、硅基、頻哪醇硼酯、芳基、雜芳基、萘基、環烷基等一系列官能團均可良好兼容。值得注意的是,此轉化可以實現一系列復雜天然產物和藥物分子的后期官能團化,包括norlignan (41), GPR40激動劑(42), TUG-891 (43), cetraxate (44), oestrone (45), α-lonone (46) 和myrtenal (47),以70-83%的產率,> 98% ee得到相應的產物41-47。
(圖片來源:Nat. Catal.)
為了進一步探索該方法的實際應用,作者對烷基酮1與二烯烴2的轉化進行了克級規模試驗(1.0 g 1)(Fig. 3a)。當降低催化劑Λ-RhS的用量為3.7 mol%、二烯烴2的用量為6.4 equiv、電解液的用量為0.5 equiv時,仍可以以68%的產率,99%的ee得到目標環丁烷產物3(d.r. = 14:1)。此外,產物3中的咪唑輔基可以很容易的移除,以89%的產率,98%的ee得到甲酯產物48。值得注意的是,作者還利用此方法實現了天然產物Melicoptine C的簡潔全合成(Fig. 3b)。49和50在Δ-RhS催化下可以以60%的產率,94%的ee得到單一的非對映異構體產物51。隨后51經歷咪唑輔基的移除以81%的產率,94%的ee得到手性Melicoptine C產物。

(圖片來源:Nat. Catal.)
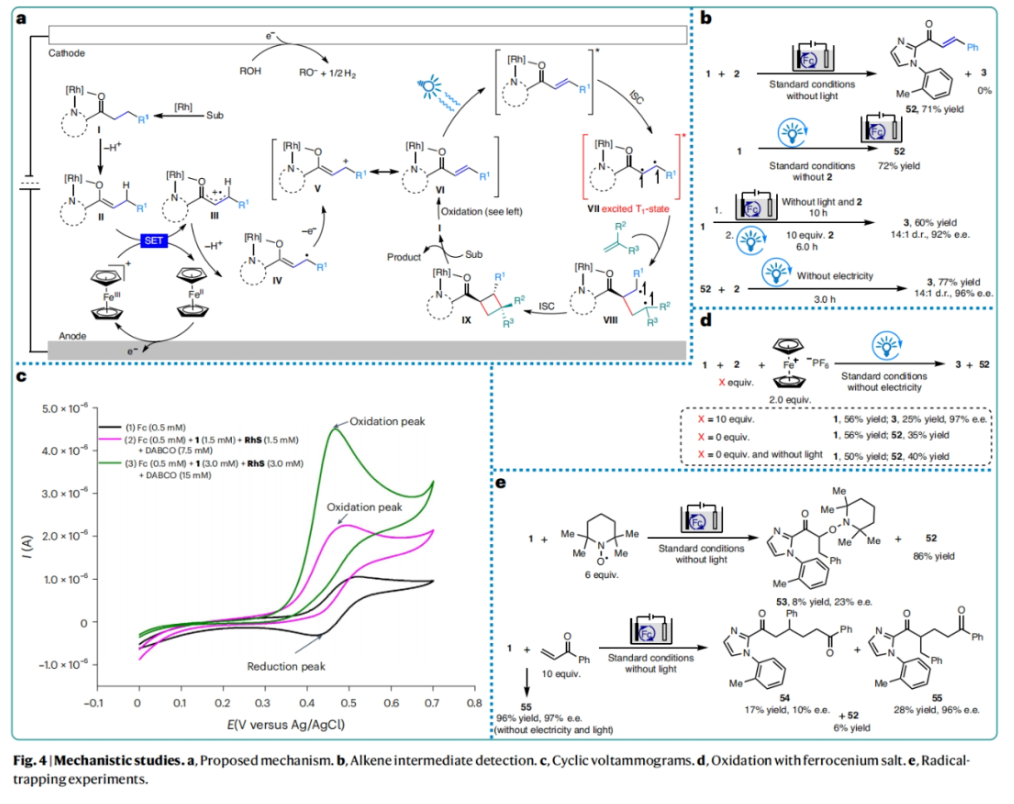
基于上述實驗結果,作者提出了此轉化可能的反應機理(Fig. 4a):催化循環開始于烷基酮與銠催化劑的雙齒配位形成中間體I,隨后通過去質子生成烯醇中間體II。同時,電化學過程開始于陽極上的Fc氧化為Fc+,陰極上醇還原為H2和醇鹽。烯醇中間體II通過與Fc+經歷單電子轉移被氧化為碳自由基陽離子中間體III,這有利于促進Fc的再生。強酸性中間體III在反應性更強的烯丙位迅速失去質子,得到自由基中間體IV。由于自由基中間體IV較為富電子,因此不能與烯烴反應。相反,它可以通過單電子轉移被迅速氧化為中間體V,其是關鍵烯酮中間體VI的互變異構體。烯酮VI經過直接光激發和體系間交叉得到激發三線態中間體VII (T1)。接下來,雙自由基中間體VII與烯烴加成形成三線態雙自由基中間體VIII,隨后發生體系間交叉和C-C鍵形成得到銠配位的環丁烷IX。最后,產物釋放和酮底物的重新配位分別得到所需產物和中間體I,從而進行新的催化循環。
為了更深入的理解此光電共催化過程,作者進行了一系列控制實驗。使用酮1與二烯2在無光條件下反應,可以以71%的產率生成α,β-不飽和酮52,由此支持了作者所提出的在催化循環過程中脫氫生成中間體VI的過程(Fig. 4b)。由于反應中并未檢測到環丁烷產物,由此排除了反應經歷一富電子烯烴與另一種烯烴通過電氧化生成自由基陽離子并形成環丁烷的猜想。此外,在沒有二烯2存在的情況下,反應不能形成環丁烷。當將1完全光解后再加入二烯2,在連續無電的條件下照射則可以生成產物3,由此說明中間體VI與烯烴通過光環加成機理反應得到目標產物,這與作者之前所發現的烯酮直接激發過程相一致。循環伏安(cyclic voltammetry)實驗表明反應中涉及一個氧化還原介質Fc的催化電流(氧化峰增強和還原峰消失),它支持Fc+和烯醇中間體II之間的有效電子轉移(Fig. 4c)。這種電子轉移進一步直接證實了反應中使用化學計量的Fc+PF6?作為氧化劑而不是通過電來獲得環丁烷產物3或α,β-不飽和酮52(Fig. 4d)。隨后,作者在β-羰基位置檢測到了TEMPO-加合物53和C-C偶聯產物54,由此表明反應中存在自由基中間體III和IV。此外,作者通過酮與苯基烯基酮的Michael加成得到偶聯產物55,進一步證實了烯醇中間體II的存在(Fig. 4e)。
(圖片來源:Nat. Catal.)
總結
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn