

(圖片來源:J. Am. Chem. Soc.)
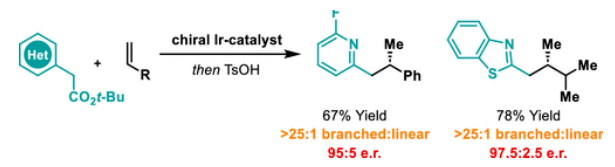
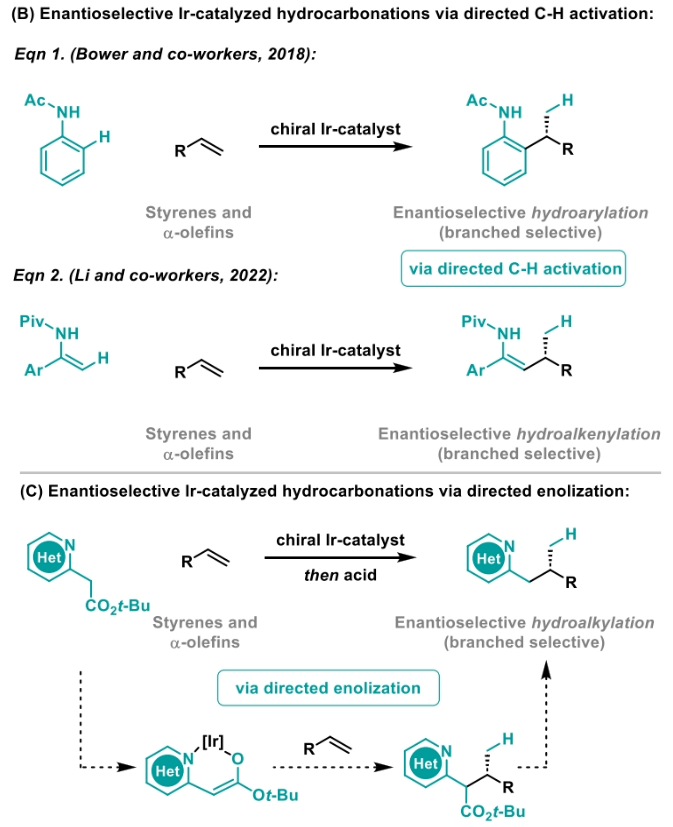
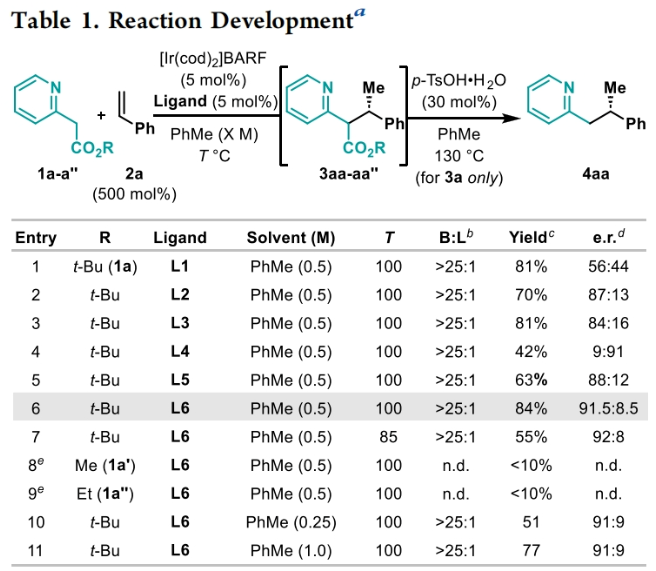
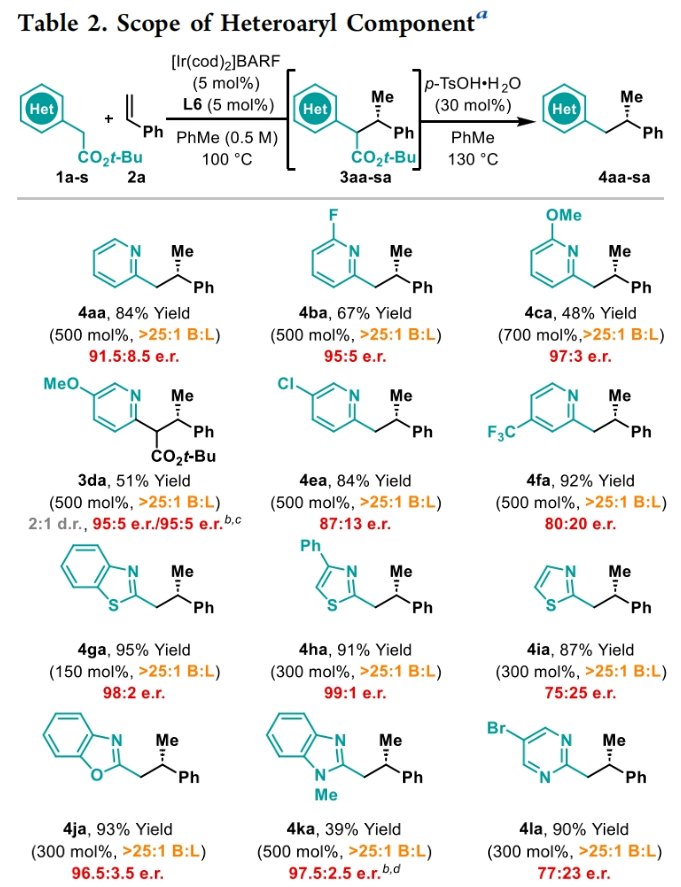
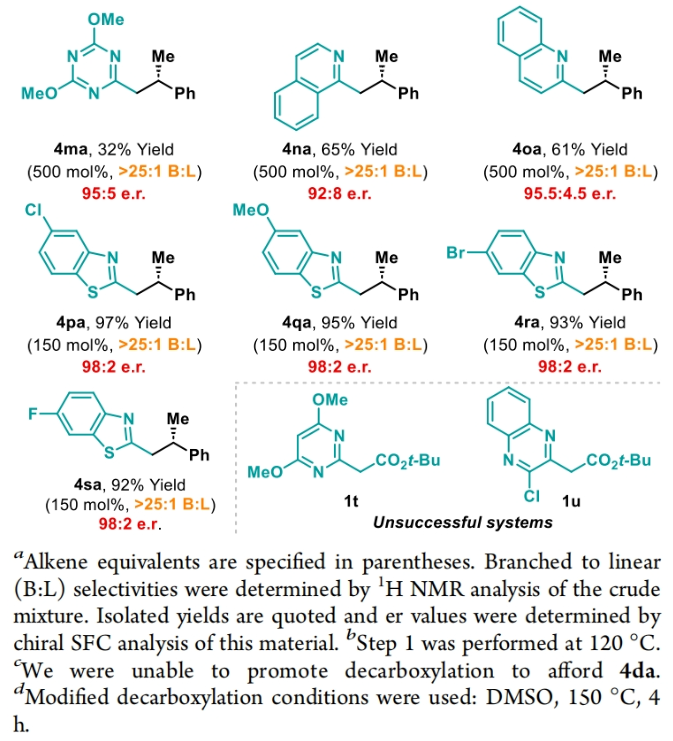
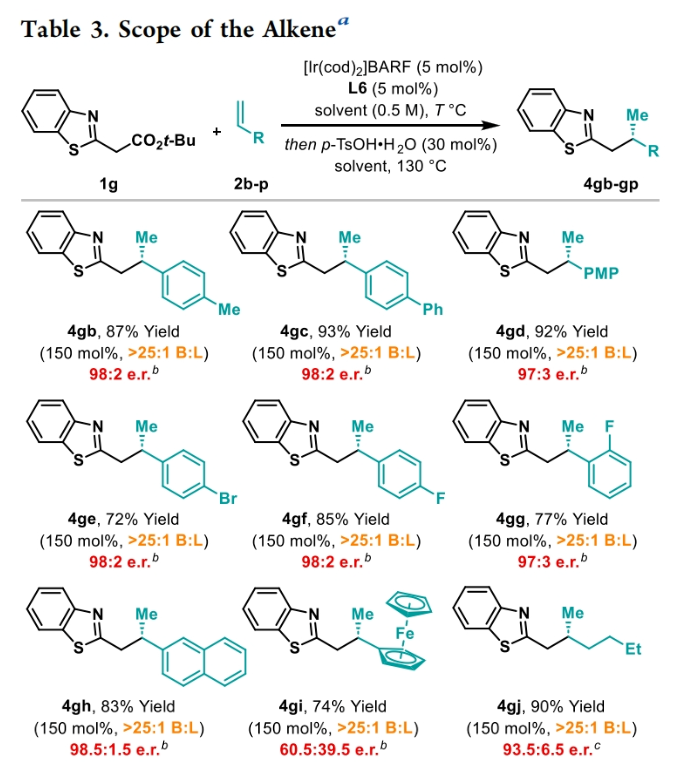
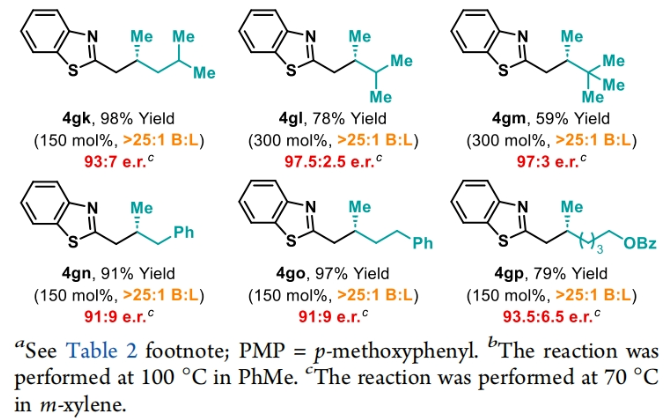
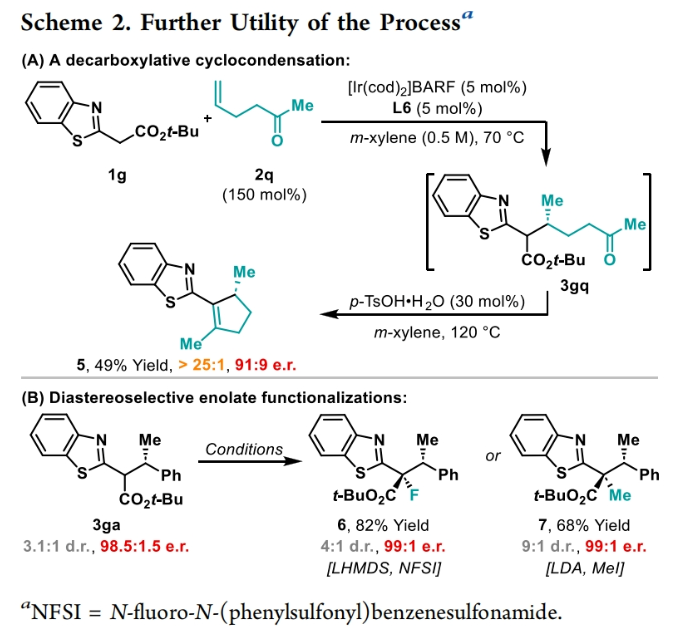
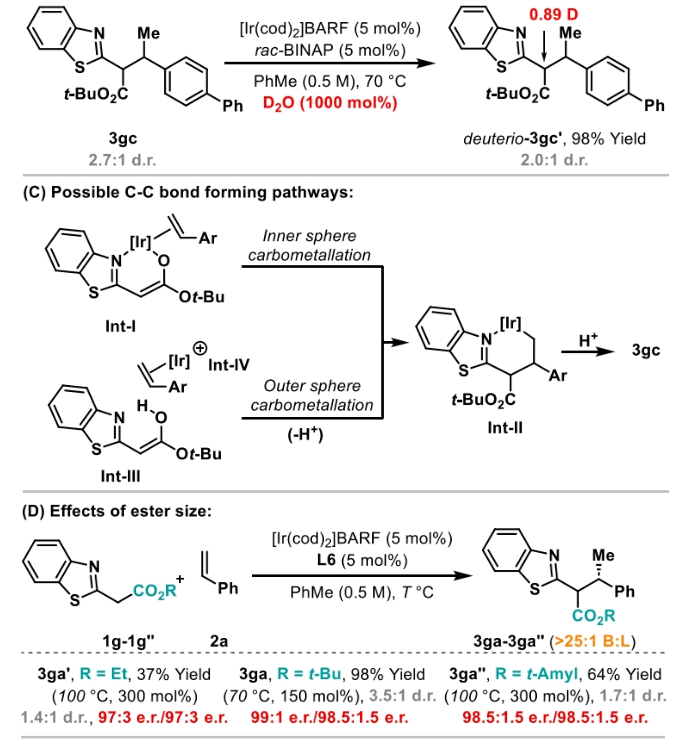
正文 包含對映選擇性分子間C-H鍵與烯烴加成的交叉偶聯是極具吸引力的,主要是由于:(a)可以減少起始原料的預官團化過程;(b)具有較高的步驟和原子經濟性;(c)可以使用簡單易得的起始原料作為偶聯配偶體(Scheme 1A)。而實現這一過程的最有效途徑就是導向金屬插入到C-H鍵中,例如C-H活化。此方法通常需要使用極化的烯烴,主要是由于:(a)可以增強反應性;(b)通過電子效應來控制反應的區域選擇性。事實上,目前僅有少數的對映選擇性策略可以適用于最低活化的單取代烯烴(如苯乙烯和α-烯烴),其中基于銥催化劑轉化被證明是特別有希望實現氫-芳基化和氫-烯基化反應過程(Scheme 1B)。最近,英國利物浦大學John F. Bower課題組發展了銥催化烯烴的對映選擇性氫-烷基化反應。反應中使用手性雙膦配體DuanPhos修飾的陽離子Ir(I)絡合物,以完全的分枝選擇性和良好的對映選擇性實現了苯乙烯和α-烯烴的氫-烷基化(Scheme 1C)。下載化學加APP到你手機,更加方便,更多收獲。 (圖片來源:J. Am. Chem. Soc.) 首先,作者選用2-吡啶基乙酸叔丁酯1a和苯乙烯2a作為模板底物對此轉化進行了探索(Table 1)。通過一系列條件篩選,作者發現當使用[Ir(cod)2]BARF (5 mol%), L6 (5 mol%), 在甲苯中 (0.5 mL)中100 °C反應,隨后加入p-TsOH (30 mol%)在130 °C反應可以一鍋法以84%的產率,良好的區域選擇性(B:L > 25:1),91.5:8.5的er得到目標脫酸氫-烷基化產物4aa(entry 6)。 (圖片來源:J. Am. Chem. Soc.) 在得到了最優反應條件后,作者首先對雜芳基骨架兼容性進行了考察(Table 2)。實驗結果表明此轉化對于一系列不同雜芳基,如取代吡啶(4aa-4fa)、苯并噻唑(4ga, 4pa-4sa),噻唑(4ha-4ia),苯并噁唑(4ja),苯并咪唑(4ka),吡嗪(4la)、三嗪(4ma)、異喹啉(4na)和喹啉(4oa)等均具有良好的兼容性,以39-97%的產率,良好的區域選擇性(B:L > 25:1),75:25-99:1的er得到相應的脫羧氫-烷基化產物4aa-4sa。遺憾的是,嘧啶類起始原料1t和1u不能兼容此轉化。 (圖片來源:J. Am. Chem. Soc.) 接下來,作者對烯烴的兼容性進行了探索(Table 3)。實驗結果表明不同取代的苯乙烯、萘乙烯、二茂鐵取代的烯烴甚至是烷基烯烴均可兼容,以59-98%的產率,良好的區域選擇性(B:L > 25:1),60.5:39.5-98:2的er得到相應的脫酸氫-烷基化產物4gb-4gp。值得注意的是,在4gn的合成過程中,作者并未觀察到由烯丙基苯2n向β-甲基苯乙烯的潛在異構化競爭過程。 (圖片來源:J. Am. Chem. Soc.) 有趣的是,反應中的脫羧步驟可用于觸發進一步的C-C鍵形成(Scheme 2)。例如,連有乙酰基的烯烴2q可以與1g經歷氫-烷基化反應得到3gq。而在加入p-TsOH (30 mol%)后120 °C反應可以以49%的產率,良好的區域選擇性(B:L > 25:1),91:9的er得到手性環戊烯產物5(Scheme 2A)。此外,產物3ga還可以通過烯醇化官能團化,立體選擇性的實現氟取代和甲基取代的產物6 (82%, 4:1 dr, 99:1 er)和7(68%, 9:1 dr, 99:1 er)(Scheme 2B)。 (圖片來源:J. Am. Chem. Soc.) 最后,為了深入理解反應機理,作者進行了一系列控制實驗(Scheme 3)。首先,當作者使用消旋的BINAP作配體時,分別嘗試利用2a與2-,3-或4-號位取代的吡啶參與反應時,僅2-號位取代的吡啶能夠實現轉化,由此表明氮中心合適位置的重要性(Scheme 3A)。此外,氘交換實驗表明在反應中固有的烯醇化和銥催化的烯醇化途徑都可能存在。且C2位的氘交換發生在C-C鍵形成之前或之后。而甲基和次甲基位點的氘交換則發生在烯烴2c階段,最有可能是通過可逆的氫金屬化過程發生的(Scheme 3B)。動力學分析表明,催化劑([Ir(cod)2]BARF/L6)的級數近似為1。目前,作者傾向于認為碳金屬化途徑形成Int-II。這一反應可能經歷由Ir-烯醇Int-I進行的內球烯烴碳金屬化過程,也可能經歷通過外球烯醇Int-III進攻Ir-π-絡合物Int-IV。如果后者是有效的,那么其它可烯醇化的前親核試劑將會以高水平的對映體選擇性參與反應。然而,實際情況并非如此。例如,作者利用β-酮酯反應得到的基本上是外消旋氫-烷基化產物。因此,在Scheme 3C中展示的兩種C-C鍵形成途徑中,支鏈選擇性可以歸因于電子效應和/或銥中心傾向于加成到位阻較小的末端烯烴。在Table 1中,作者發現含有叔丁酯的底物最適合此轉化。為了驗證這一點,作者分別選擇連有乙酯、叔丁酯以及叔戊酯的底物1g’, 1g, 和1g’’分別與苯乙烯2a反應。實驗結果表明,1g在最溫和的條件下(70 oC)反應,可以以最高的產率(98%)得到產物3ga。有趣的是,產物3ga-3ga’’的對映體富集程度接近,由此表明酯基的結構對反應性至關重要,但對對映選擇性誘導過程影響很小(Scheme 3D)。而當作者使用相對弱酸性的前親核試劑反應時,則會對對映誘導過程產生影響(Scheme 3E)。 (圖片來源:J. Am. Chem. Soc.) 總結


聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn