



(圖片來(lái)源:Science)
正文
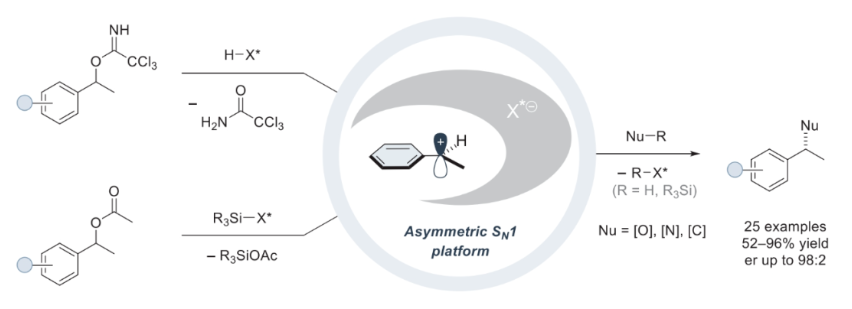
芐位立體中心在天然產(chǎn)物和藥物中普遍存在。化學(xué)家們已經(jīng)發(fā)展出了一系列方法來(lái)實(shí)現(xiàn)芐位C-C或C-雜原子鍵的不對(duì)稱構(gòu)建。目前已知的方法包括使用手性助劑、金屬催化劑、有機(jī)催化劑和酶等策略。然而,盡管利用上述策略可以作為一種通用的方法來(lái)構(gòu)建芐基立體中心,但親核試劑與芐基正離子的催化對(duì)映選擇反應(yīng)仍然有待發(fā)展。在過去十年中,盡管這一策略曾被化學(xué)家嘗試且已被報(bào)道,但其通常會(huì)涉及氧化芳烴,其會(huì)穩(wěn)定相應(yīng)的芐基碳正離子為鄰醌或?qū)︴募谆铮虼讼拗屏诉@些方法的應(yīng)用范圍。最近,德國(guó)馬克斯-普朗克研究所Benjamin List課題組基于課題組前期所發(fā)展的具有高酸性和類酶受限空間結(jié)構(gòu)的手性催化劑IDPi,實(shí)現(xiàn)了將外消旋化的起始原料轉(zhuǎn)化為具有重要應(yīng)用價(jià)值的對(duì)映體富集的芐位立構(gòu)中心產(chǎn)物(Fig. 1)。下載化學(xué)加APP到你手機(jī),更加方便,更多收獲。

(圖片來(lái)源:Science)
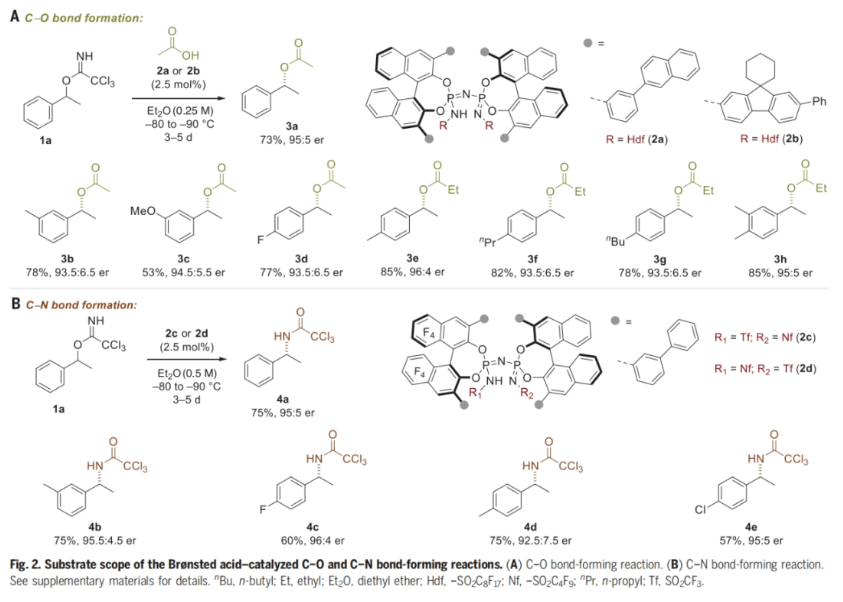
首先,作者選用rac-1-苯乙基-2,2,2-三氯乙酰亞胺酯1a作為碳正離子前體與親核試劑乙酸作為模板底物,對(duì)芐位C-O鍵的構(gòu)建反應(yīng)進(jìn)行探索(Fig. 2A)。通過一系列IDPi催化劑以及反應(yīng)參數(shù)的篩選,作者發(fā)現(xiàn)當(dāng)使用2a作為催化劑,在Et2O中,-90 oC反應(yīng)5天可以以73%的產(chǎn)率得到目標(biāo)產(chǎn)物3a(95:5 er)。在得到了最優(yōu)反應(yīng)條件后,作者對(duì)此轉(zhuǎn)化的底物范圍進(jìn)行了考察。實(shí)驗(yàn)結(jié)果表明此體系對(duì)一系列取代的三氯乙酰亞胺酯具有良好的兼容性,以53-78%的產(chǎn)率,93.5:6.5-94.5:5.5的er得到相應(yīng)的產(chǎn)物3b-3d。其中,具有間位或?qū)ξ蝗〈牡孜锓磻?yīng)性最佳。此外,當(dāng)以丙酸為親核試劑時(shí),IDPi催化劑2b展現(xiàn)出優(yōu)異的性能,以78-85%的產(chǎn)率,93.5:6.5-96:4的er得到相應(yīng)的產(chǎn)物3e-3h。當(dāng)作者在體系中使用氮親核試劑時(shí),且使用基于BINOL骨架的F8-取代IDPi催化劑2c,可以以57%-75%的產(chǎn)率,92.5:7.5-96:4的er得到相應(yīng)的產(chǎn)物4b-4e(Fig. 2B)。
(圖片來(lái)源:Science)
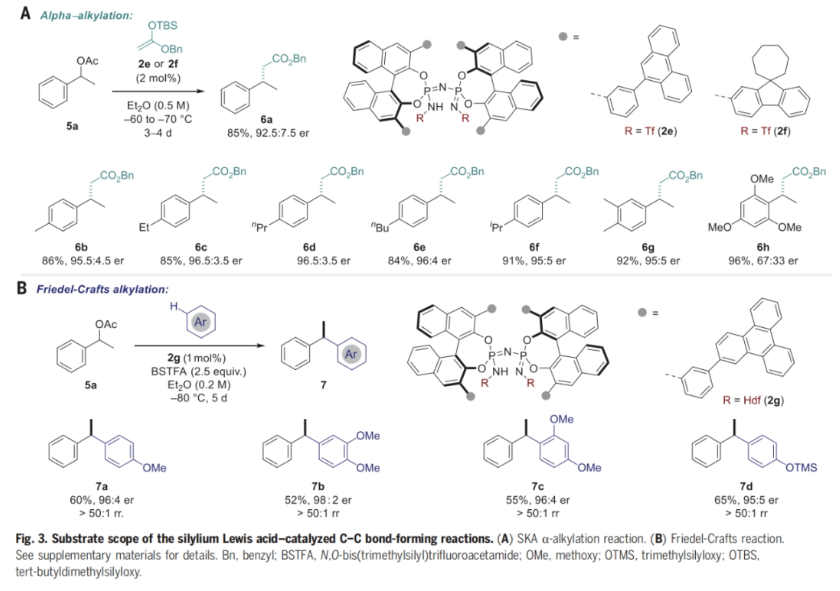
在成功實(shí)現(xiàn)了Br?nsted酸催化的不對(duì)稱C-O和C-N鍵形成SN1反應(yīng)后,作者進(jìn)一步探索了利用類似方法實(shí)現(xiàn)C-C鍵構(gòu)建的可能性(Fig. 3)。當(dāng)作者使用1-苯乙基醋酸酯5a時(shí),在IDPi催化劑2e的催化下與碳親核試劑烯醇硅醚2e反應(yīng)可以以85%的產(chǎn)率,92.5:7.5的er值得到相應(yīng)的產(chǎn)物6a。此外,作者對(duì)不同取代的1-苯乙基醋酸酯兼容性進(jìn)行了考察,同樣以良好的產(chǎn)率(84-96%)和對(duì)映選擇性得到相應(yīng)的產(chǎn)物6b-6h(Fig. 3A)。值得注意的是,作者還對(duì)其它碳親核試劑的兼容性進(jìn)行了考察(Fig. 3B)。當(dāng)時(shí)用IDPi催化劑2g時(shí),還可以與芳烴實(shí)現(xiàn)涉及芐基碳正離子的不對(duì)稱Friedel-Crafts烷基化反應(yīng),以52-65%的產(chǎn)率,96:4-98:2的er得到相應(yīng)的產(chǎn)物7a-7d(> 50:1 rr)。
(圖片來(lái)源:Science)
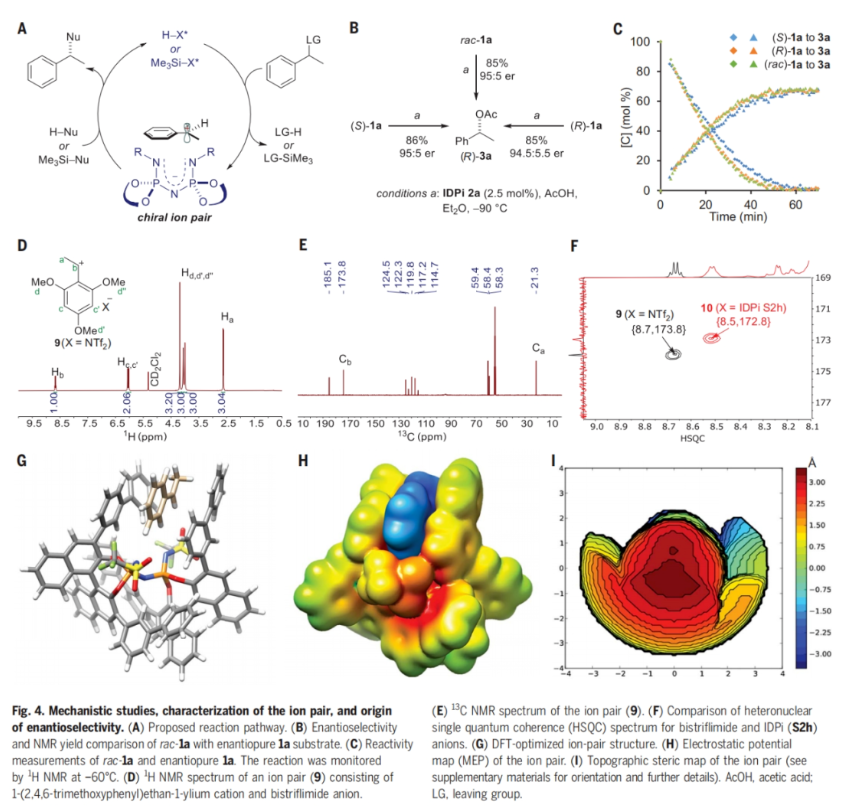
為了深入理解芐基正離子SN1反應(yīng)機(jī)理,作者進(jìn)行了實(shí)驗(yàn)和計(jì)算研究(Fig. 4A)。首先,作者分別利用消旋的底物rac-1a和光學(xué)純的底物(R)-1a與(S)-1a在最優(yōu)條件下反應(yīng)時(shí),所得到的產(chǎn)物3a的主要對(duì)映體相同,且產(chǎn)率基本相同。這與作者設(shè)想的離子對(duì)形成后,通過親核試劑進(jìn)攻芐位碳正離子機(jī)理(SN1)相一致(Fig. 4B)。有趣的是,當(dāng)作者使用1H NMR在-60°C下分別監(jiān)測(cè)每種底物[rac-1a,(S)-1a和(R)-1a]的C-O成鍵反應(yīng)時(shí),發(fā)現(xiàn)兩種對(duì)映體的反應(yīng)速率相似,幾乎沒有動(dòng)力學(xué)上的差異(Fig. 4C)。接下來(lái),作者分別通過1H NMR、13C NMR和HSQC來(lái)觀察離子對(duì)的形成,并通過核磁波譜清楚地表明不同的抗衡陰離子與碳正離子非常接近(Fig. 4D-4F)。最后,作者通過DFT計(jì)算展示了一系列催化劑與碳正離子的相互作用在形成主要對(duì)映體的過渡態(tài)過程中發(fā)揮著至關(guān)重要的作用(Fig. 4G-4I)。
(圖片來(lái)源:Science)
總結(jié)
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來(lái)源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請(qǐng)作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn