

(圖片來源:Angew. Chem. Int. Ed.)
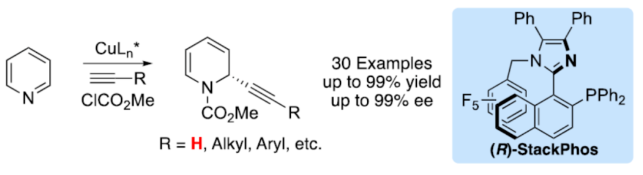
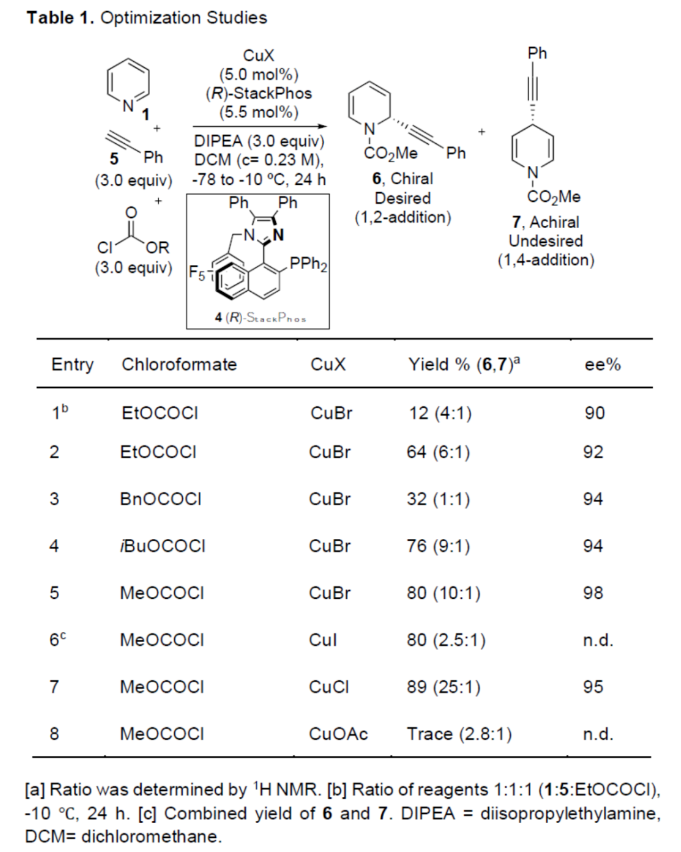
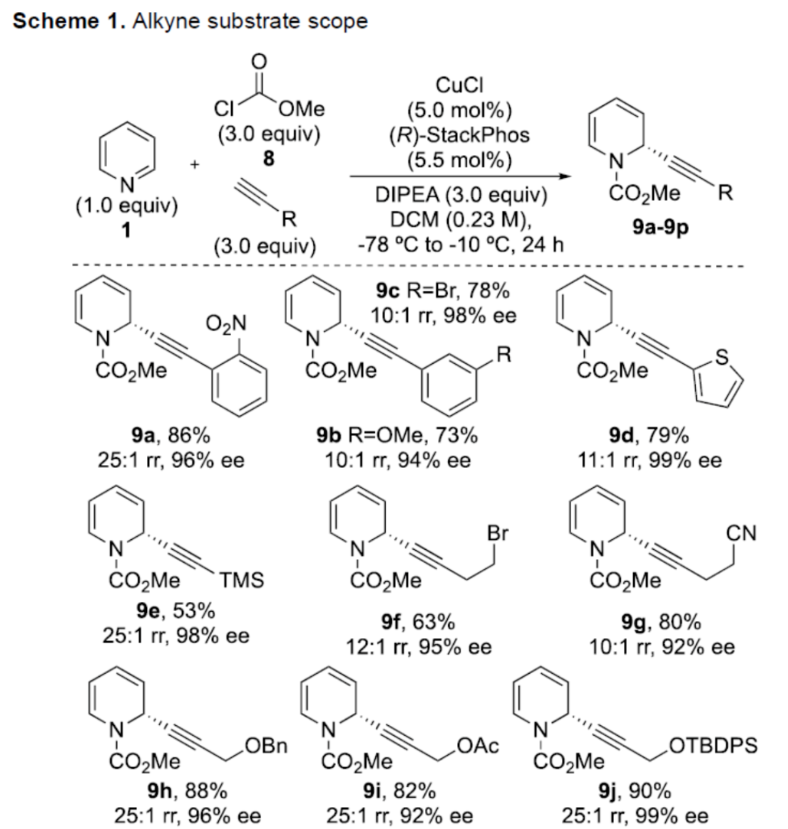
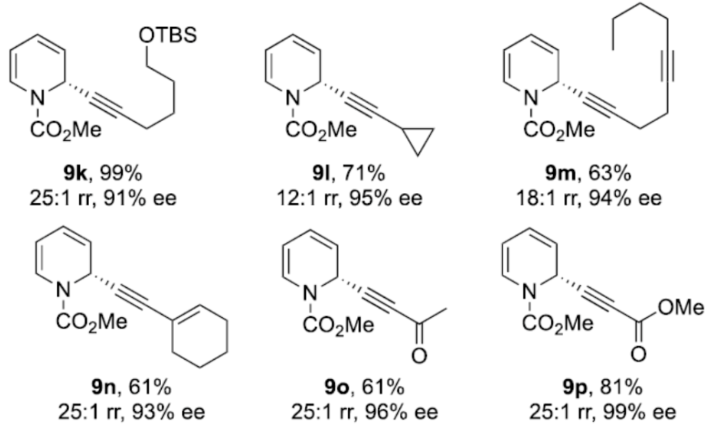
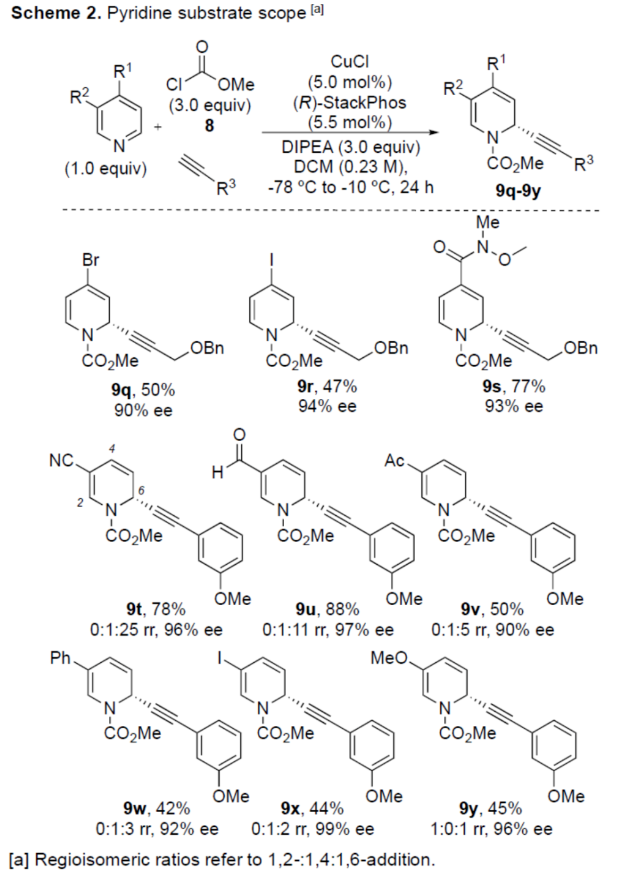
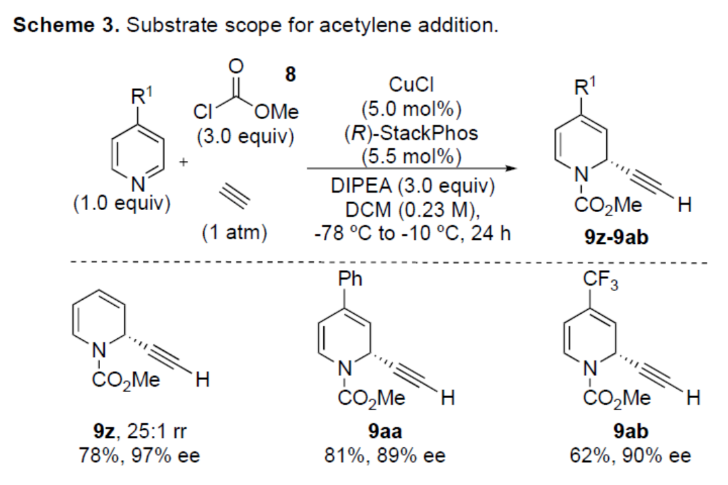
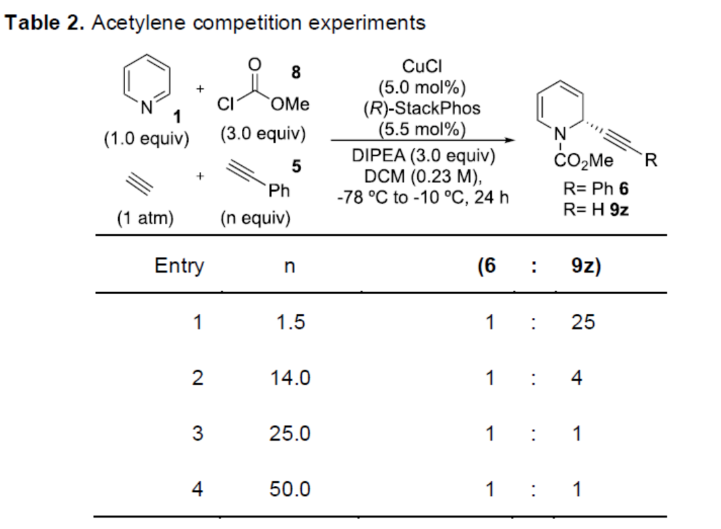
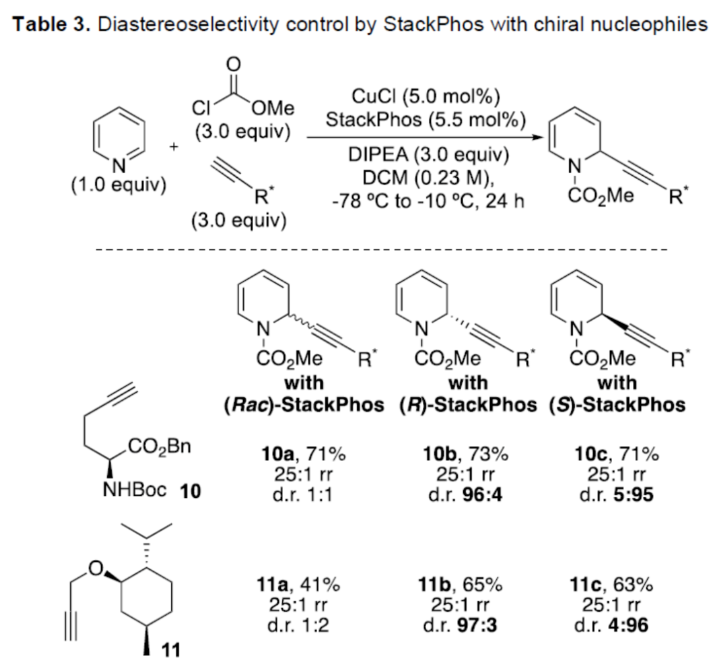
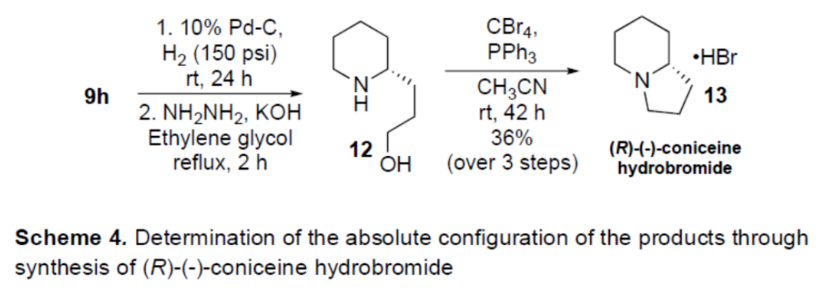
正文 對映選擇性催化是制備手性非外消旋化合物最為直接的途徑之一,并且化學家們已開發了大量用于引入手性的催化策略。其中,前手性π-鍵的一個特定面的選擇性反應是這些方法中最常見和最成功例子之一。近年來,利用平面芳烴制備高度官能團化分子的策略越來越受歡迎。其中,吡啶的親核加成是典型的例子,因為2-、4-和6-位都可以在去芳構化反應中進行加成反應。最近,化學家們已經開發出了使用氫化物進行吡啶去芳構化的巧妙策略,隨后使用手性催化劑對3-位進行官能團化反應。前期,Comins和Charette課題組利用在2-和4-位具有取代基的底物的手性助劑來區分前手性π-面,同時也有助于化學選擇性的控制。對于母體吡啶,Doyle課題組報道了鎳催化芳基有機鋅試劑的加成反應,其中利用鎳配合物中間體破壞了吡啶的對稱性。鑒于溫和的反應條件和產物的高實用性,炔基化化學仍然是一種強大的方法。馬大為課題組(J. Am. Chem. Soc. 2007, 129, 9300.)報道了一種吡啶與炔烴的加成反應,但親核試劑的范圍僅限于丙二醇酯和丙炔酮底物(對于常見的苯乙炔底物,僅觀察到1%ee)。因此,對于吡啶的催化對映選擇性加成仍然具有難度。近日,美國佛羅里達大學Aaron Aponick課題組報道了一種銅催化吡啶、末端炔烴和氯甲酸甲酯的去芳構化炔基化反應,合成了一系列手性2-炔基-1,2-二氫吡啶,具有優異的區域選擇性和對映選擇性(Figure 1)。下載化學加APP到你手機,更加方便,更多收獲。 (圖片來源:Angew. Chem. Int. Ed.) 首先,作者以吡啶1a、苯乙炔5與MeOCOCl作為模型底物,進行了相關三組分反應條件的篩選(Table 1)。當以CuCl(5.0 mol %)作為催化劑,(R)-StackPhos(5.5 mol %)作為配體,DIPEA(3.0 equiv)作為堿,在DCM溶劑中-78 oC至-10 oC反應24 h,可以89%的收率得到產物6,rr為25:1,ee為95%。 (圖片來源:Angew. Chem. Int. Ed.) 在獲得上述最佳反應條件后,作者對炔烴底物范圍進行了擴展(Scheme 1)。研究表明,一系列不同取代的苯乙炔、噻吩基乙炔以及烷基取代的炔烴,均可順利反應,獲得相應的產物9a-9p,收率為53-99%,ee為91-99%,rr為10:1->25:1。值得注意的是,該策略具有出色的官能團兼容性,一系列活性的基團,如鹵素、炔基、烯基、羰基、烷氧羰基等,均與體系兼容。 (圖片來源:Angew. Chem. Int. Ed.) 緊接著,作者對吡啶底物的范圍進行了擴展(Scheme 2)。研究表明,當吡啶底物中的R1為鹵素與酰胺基時,均可順利反應,獲得相應的產物9q-9s,收率為47-77%,ee為90-94%。當吡啶底物中的R2為氰基、甲酰基、乙酰基、苯基、鹵素與甲氧基時,也與體系兼容,獲得相應的產物9t-9y,收率為42-88%,ee為90-99%,rr為0:1:2-0:1:25。然而,2-取代吡啶在標準反應條件下未能有效的進行反應。 (圖片來源:Angew. Chem. Int. Ed.) 同時,在標準條件下,當使用乙炔氣體作為底物時,可獲得相應的產物9z-9ab,收率為62-81%,ee為89-97%(Scheme 3)。 (圖片來源:Angew. Chem. Int. Ed.) 隨后,作者進行了乙炔和苯乙炔之間親核加成選擇性的競爭性實驗(Table 2)。反應結果表明,隨著苯乙炔當量的增加,產物9z的比例在逐漸降低,因此乙炔比其它炔烴衍生物更具反應性。 (圖片來源:Angew. Chem. Int. Ed.) 此外,作者發現,利用手性炔烴(10與11)以及非手性StackPhos作為配體時,反應也能夠順利進行,獲得相應的產物10a(d.r.為1:1,rr為25:1)和11a(d.r.為1:2,rr為25:1)(Table 3)。值得注意的是,當使用(R)-StackPhos或(S)-StackPhos作為配體時,反應具有出色的非對映選擇性。 (圖片來源:Angew. Chem. Int. Ed.) (圖片來源:Angew. Chem. Int. Ed.) 總結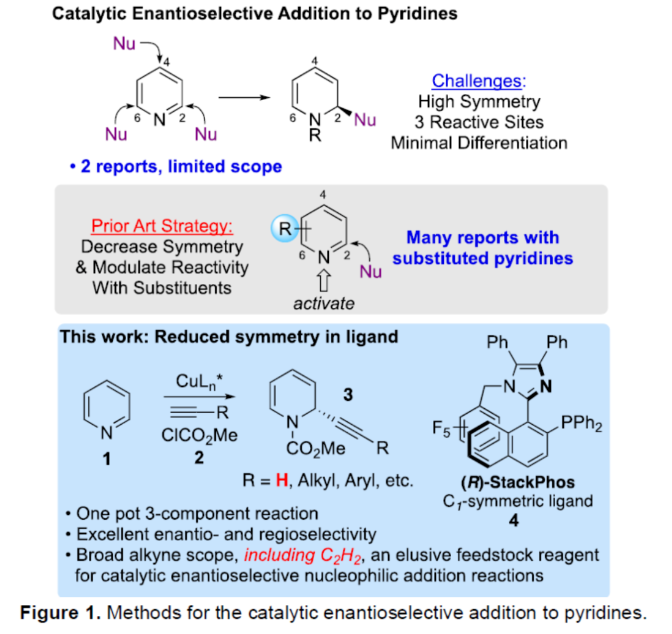
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn