(圖片來源:J. Am. Chem. Soc.)
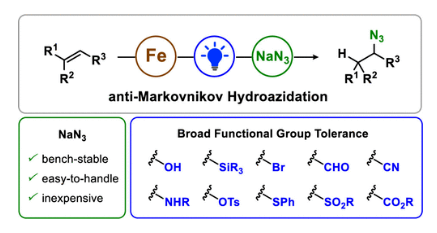
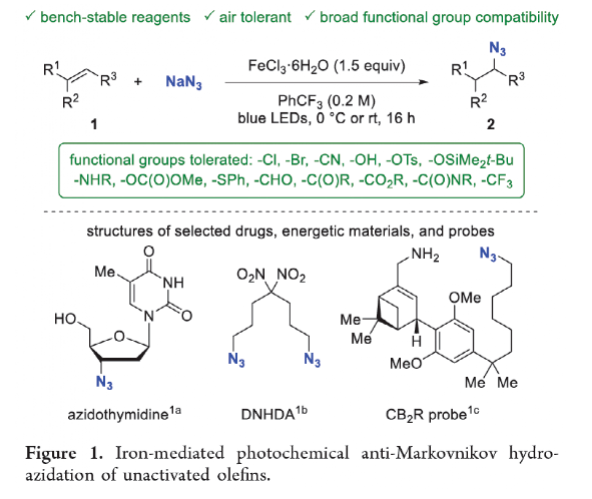
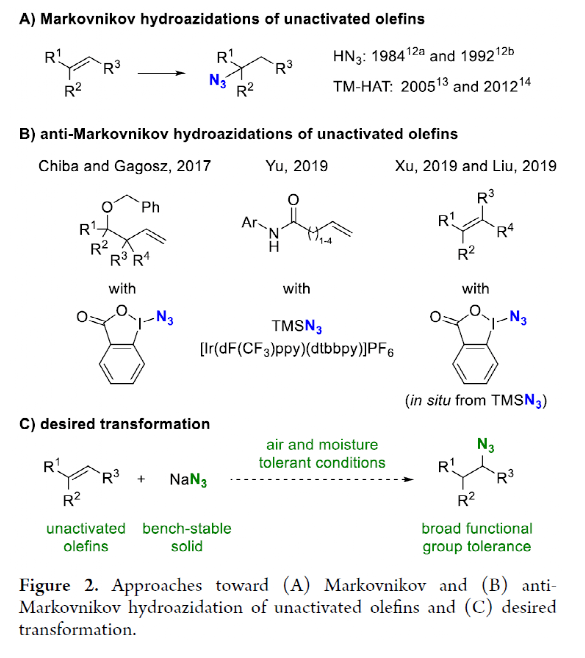
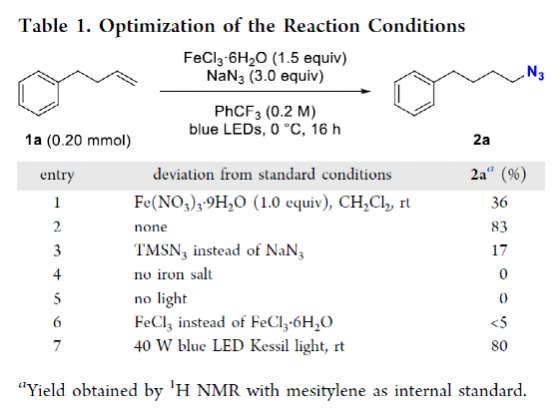
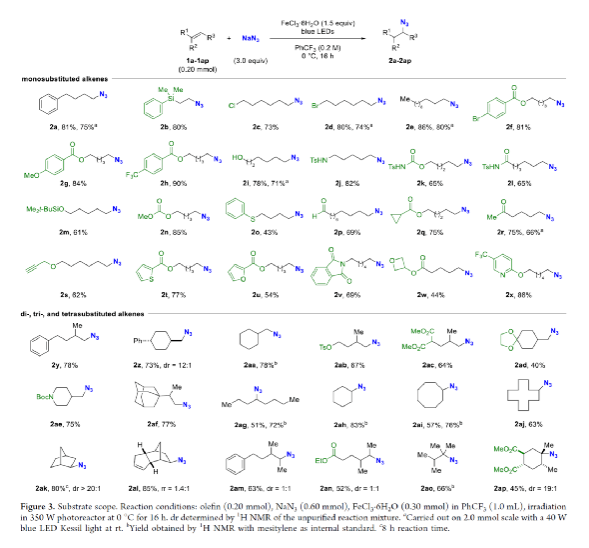
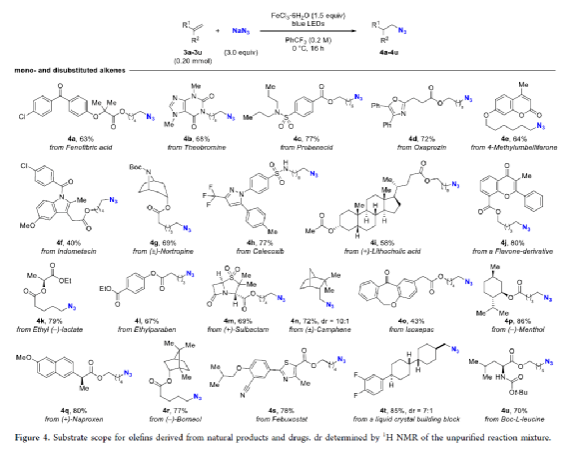
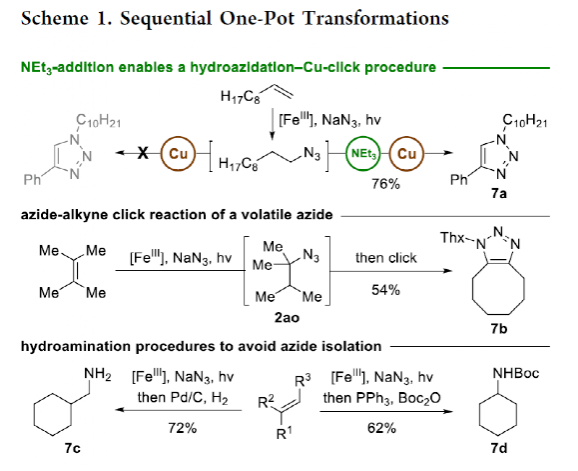
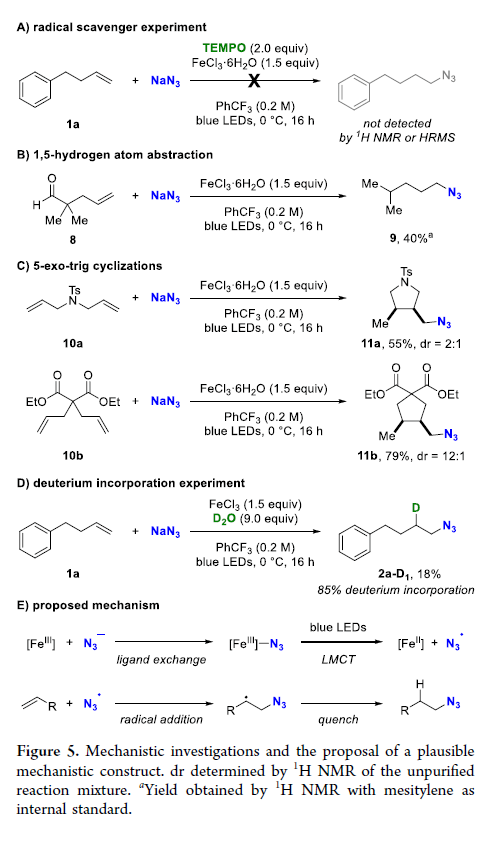
有機疊氮化物是一系列藥物分子、高能材料和化學探針的重要組成部分。它們也是合成天然產物、藥品和農用化學品的寶貴合成砌塊。此外,疊氮化物在經典合成方法中得到了廣泛的應用,如Staudinger還原,Huisgen環加成,點擊化學,Schmidt和aza-Wittig反應等。最近,疊氮化物作為亞硝基前體被廣泛應用于過渡金屬催化的C-H鍵胺化反應中。特別是在多步合成的情況下,R-N3可以作為保護的胺來使用(Figure 1)。下載化學加APP到你手機,更加方便,更多收獲。傳統上,有機疊氮化合物是通過親核取代以及重氮和疊氮轉移反應合成的。作為一種互補的方法,利用烯烴直接轉化為烷基疊氮化物得到了化學家們的關注。Hassner和Kropp的早期研究工作主要集中在將HN3加成到烯烴上,從而得到相應的馬氏加成產物(Figure 2A)此后,Chiba 和 Gagosz,于煒, 項昊,劉國生等課題組分別使用高價碘試劑ABX(azidobenziodoxolone)和TMSN3實現了烯烴的反馬氏氫-疊氮化反應(Figure 2B)。盡管此領域已取得了一系列進展,但使用簡單易得的NaN3作為廉價疊氮化物來源的方法仍未有報道(Figure 2C)。最近,瑞士蘇黎世聯邦理工學院Erick M. Carreira課題組發展了首例光/鐵共催化,非活化烯烴的反馬氏氫-疊氮化反應。該轉化采用耐空氣和水分的NaN3作為穩定的疊氮源,在溫和的條件下進行,且具有廣泛的官能團兼容性(Figure 2)。作者首先以4-苯基丁烯1a為模板底物,NaN3作為穩定的疊氮源,對烯烴的反馬氏氫-疊氮化反應進行了探索(Table 1)。通過一系列條件篩選,作者發現當使用1a (0.20 mmol), NaN3 (0.60 mmol, 3.0 equiv), FeCl3·6H2O (0.30 mmol, 1.5 equiv)在PhCF3 (1.0 mL)中,350 W 光反應器的引發下,0 °C反應16 h可以以83%的核磁產率得到反馬氏氫-疊氮化產物2a(entry 2)。控制實驗表明,鐵鹽和光照的存在對此轉化至關重要(entries 4和5)。此外,FeCl3·6H2O的結晶水不可缺少(entry 6)。接下來,作者對此轉化的底物范圍進行了考察(Figure 3)。實驗結果表明一系列連有不同取代基的單取代烯烴、二取代烯烴、三取代烯烴以及四取代烯烴均可順利實現此轉化,以40-90%的產率得到相應的反馬氏氫-疊氮化產物2a-2z, 2aa-2ap。值得注意的是,鹵素、羥基、炔基、醛基等官能團均可順利兼容,這為產物的后續合成轉化提供了可能性。此外,當將反應放大至2.0 mmol規模時,仍可以以75%的產率得到產物2a,證明了此轉化的實用性。在對此方法的底物適用范圍進行了考察后,作者探索了對生物活性和生物相關分子衍生物的兼容性(Figure 4)。實驗結果表明,Fenofibric acid, Theobromine, Probenecid, Oxaprozin, Indometacin, Nortropine, Celecoxib, Lithocholic acid, Flavone, Sulbactam, Camphene, Isoxepac, Menthol, Naproxen, Borneol, Febuxostat等一系列藥物或天然產物衍生物均可兼容,以40-86%的產率得到相應的產物4a-4u。特別是,含有不同取代芳烴和雜環的分子,如噁唑、吲哚、噻唑、β-內酰胺和二唑等均具有良好的耐受性,表明該方法具有實現后期應用的潛力。為了應對低分子量疊氮化物的揮發性和固有風險,作者探索了氫-疊氮化反應后的幾種合成轉化。使用一鍋法策略可以有效避免后處理過程,包括溶劑蒸發、純化、分離和疊氮化物中間體的處理(Scheme 1)。作者首先嘗試了Cu(I)-催化的原位click反應,但并未成功。隨后,作者觀察到NEt3的加入對三唑7a(76%)的生成至關重要。利用揮發性的疊氮化物2ao與環辛炔反應,可以以54%的產率得到三唑產物7b。此外,利用環己基疊氮化物2ah分別經歷鈀催化的氫化以及Staudinger還原可以分別以72%和62%的產率得到7c和7d。為了深入理解反應機理,作者進行了控制實驗(Figure 5)。首先,在體系中加入自由基捕獲劑TEMPO后,作者并未監測到目標產物,由此表明反應中會涉及自由基中間體(Figure 5A)。隨后,當作者使用醛8作為底物時,以40%的產率觀察到了1-疊氮基-4-甲基戊烷9作為唯一產物。這說明疊氮自由基與烯烴加成后形成的二級碳自由基會經歷1,5-自由基氫原子攫取,并經歷脫羰得到更穩定的三級自由基,并被淬滅(Figure 5B)。接下來,作者利用二烯底物10a和10b反應,可以經歷5-exo-trig環化,分別以55%和79%的產率得到吡咯啉產物11a和環戊烷產物11b。對這兩個底物,作者僅觀察到了環化產物的生成,由此表明淬滅過程要慢于環化過程(Figure 5C)。緊接著,作者利用同位素實驗得出水是產物中氫的來源,且氫原子轉移到二級碳中心自由基的過程可能是此轉化的決速步驟(Figure 5D)(Figure 5E)。Erick M. Carreira課題組發展了首例光/鐵共催化,非活化烯烴的反馬氏氫-疊氮化反應。該轉化使用廉價易得的NaN3作為穩定的疊氮源,在溫和的反應條件下實現了一系列烷基疊氮化物的合成。該轉化具有廣泛的底物適用性和官能團兼容性,并可以兼容一系列藥物和天然產物分子骨架。此反應的發展為有機疊氮化物的合成提供了新的策略。文獻詳情:
Henry Lindner, Willi M. Amberg, Erick M. Carreira*. Iron-Mediated Photochemical Anti-Markovnikov Hydroazidation of Unactivated Olefins. J. Am. Chem. Soc.,2023,https://doi.org/10.1021/jacs.3c09122.