- 首頁
- 資訊
華東理工大學諾獎中心醫(yī)工合作發(fā)展了一種蛋白質(zhì)正交化學修飾策略
來源:華東理工大學 2023-09-22
導(dǎo)讀:近日,華東理工大學化學與分子工程學院、費林加諾貝爾獎科學家聯(lián)合研究中心田禾院士、賀曉鵬教授團隊與海軍軍醫(yī)大學附屬上海東方肝膽外科醫(yī)院王紅陽院士團隊合作發(fā)展了一種蛋白質(zhì)正交化學修飾策略,通過協(xié)同靶向癌細胞表面抗原與抑制巨噬細胞吞噬,實現(xiàn)了原發(fā)性肝癌的精準可視化及光驅(qū)動治療,相關(guān)成果發(fā)表于《美國化學會志》。
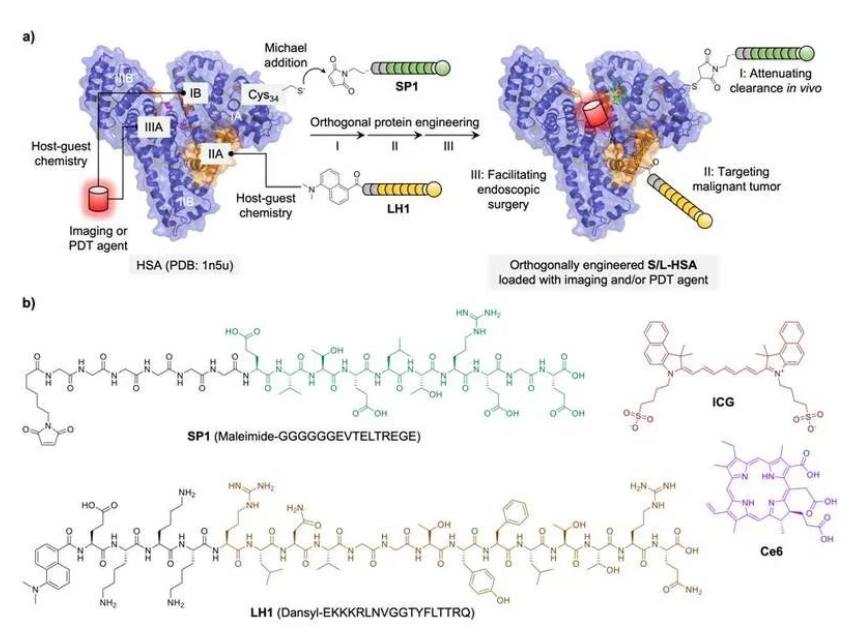
肝細胞癌(HCC)是臨床最常見的原發(fā)性肝癌類型,由于腫瘤的高異質(zhì)性和早期血液標志物的缺乏,HCC的5年總生存率低于20%,并已成為全球死亡率第二高的癌癥。目前,手術(shù)切除仍然是HCC的首選治療方案,但僅適用于偏早期且未發(fā)生大面積轉(zhuǎn)移的HCC患者。其它包括放化療、靶向治療、嵌合抗原受體T細胞(CAR-T)治療和免疫治療在內(nèi)的臨床療法,均存在療效與獲益群體有限及毒副作用大等缺陷。磷脂酰肌醇蛋白聚糖3(GPC-3)是一種跨膜表達的硫酸乙酰肝素蛋白多糖,參與調(diào)控個體發(fā)育、細胞增殖和分化等過程。王紅陽院士團隊率先發(fā)現(xiàn)GPC-3是HCC的高特異性腫瘤標志物,在病理組織上的陽性率高達90%;此外,靶向GPC-3的CAR-T療法也已于近期取得了臨床進展。基于上述基礎(chǔ),研究團隊開發(fā)了一種基于人血清白蛋白(HSA)正交修飾的化學策略,實現(xiàn)了GPC-3靶向的HCC診療。HSA是一種FDA批準用于臨床的高生物相容性藥物載體,然而天然HSA易被肝臟吸收,降低了其所負載藥物的腫瘤靶向性。此外,常規(guī)藥物載體到達腫瘤部位前,往往易被體內(nèi)免疫系統(tǒng)清除。前期研究表明,整合素相關(guān)蛋白CD47在多種癌細胞中過表達,其可與巨噬細胞表面的SIRPα(信號調(diào)節(jié)蛋白-α)相互作用,從而激活“別吃我”信號,使癌細胞逃逸免疫清除。基于此,本研究工作提出了一種對HSA單體共價與非共價化學結(jié)合的“正交”修飾策略,以1:1的摩爾比在HSA上定量引入兩種不同功能的多肽,一種靶向原發(fā)性肝細胞癌(HCC),另一種模擬免疫檢查點信號從而沉默巨噬細胞吞噬,通過SAXS結(jié)合Alphafold2解析了蛋白質(zhì)修飾結(jié)構(gòu)。有趣的是,該修飾策略不干擾HSA結(jié)合其它功能分子的結(jié)構(gòu)域構(gòu)象,從而進一步實現(xiàn)了FDA批準臨床使用的近紅外熒光造影劑ICG及/或光動力試劑Ce6的協(xié)同負載。最終,通過系列動物水平實驗驗證了其對HCC實體瘤的體內(nèi)靶向、長效熒光可視化及光驅(qū)動消融性能,為基于內(nèi)源性蛋白質(zhì)的結(jié)構(gòu)可控多功能修飾提供了新的化學正交策略,同時為HCC的腹腔鏡下術(shù)中熒光導(dǎo)航與光驅(qū)動治療提供了靶向特異性的新試劑原型。圖片說明:生物正交策略構(gòu)建多功能人血清白蛋白示意圖華東理工大學化學與分子工程學院博士后出站人員豆偉濤(現(xiàn)為華東師范大學專任副研究員)為本文第一作者,生物學實驗由碩士畢業(yè)生邱鵬、博士研究生郭宸等協(xié)作完成,美國德克薩斯大學奧斯汀分校Jonathan L. Sessler教授,海軍軍醫(yī)大學附屬上海東方肝膽外科醫(yī)院王紅陽院士、談冶雄研究員,中科院上海藥物研究所李佳研究員和賀曉鵬教授為論文共同通訊作者,研究工作得到了田禾院士的悉心指導(dǎo)。小角度散射實驗得到了蛋白質(zhì)科學研究(上海)設(shè)施五線六站(BL19U2)李娜博士的指導(dǎo)與支持,計算模擬實驗由上海科技大學劉婷婷博士完成,并得到了趙素文研究員的指導(dǎo)。本研究獲得了國家自然科學基金委醫(yī)學部重大研究計劃“腫瘤演進與診療的分子功能可視化研究”、化學部重大研究計劃“生物大分子動態(tài)修飾與化學干預(yù)”和材料生物學與動態(tài)化學教育部前沿科學中心、上海市科技重大專項、費林加諾貝爾獎科學家聯(lián)合研究中心等資助。原文鏈接:https://pubs.acs.org/doi/ 10.1021/jacs.3c05052
聲明:化學加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn