

軸手性聯芳廣泛存在于天然產物與藥物分子結構中,同時也是手性配體與手性催化劑重要的優勢骨架。因此,軸手性聯芳的合成備受關注。近年來,過渡金屬催化不對稱碳氫鍵活化為軸手性聯芳骨架的構筑提供了一種直接、高效的合成策略。當前的研究報道大多依賴基于4d和5d過渡金屬鈀、銠、銥等貴金屬催化劑,而利用廉價的地球豐產金屬催化構建軸手性聯芳極具挑戰性,目前僅有兩種策略被報道(圖1A)。
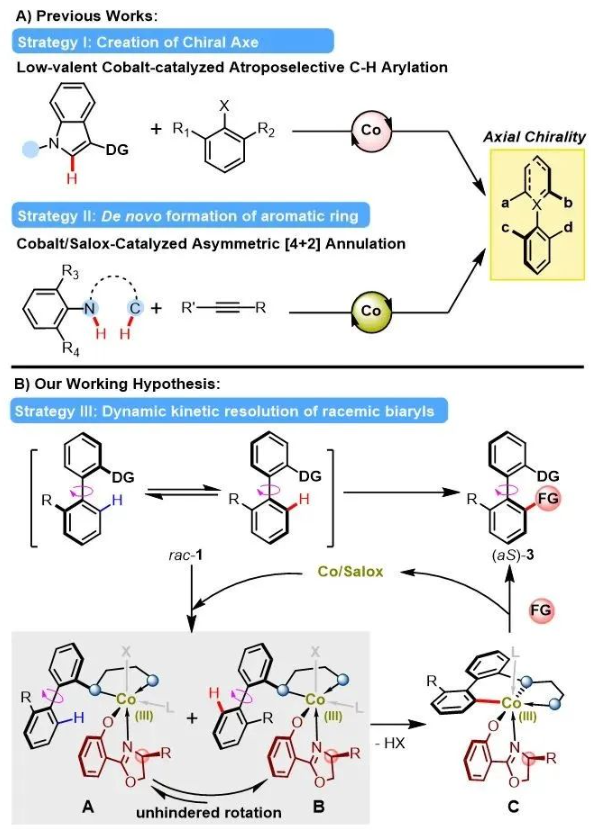
圖1. 鈷催化不對稱碳氫鍵活化構建軸手性化合物。
圖片來源:Angew. Chem. Int. Ed.
受到此前研究成果的啟發,作者設想將Co(II)/Salox催化體系應用于外消旋聯芳基化合物的動態動力學拆分中,并基于此設想展開研究。首先作者以聯萘苯胺衍生物1a和苯硼酸2a作為模型底物,進行了相關反應條件篩選,篩選結果表明,當以Co(SO4)2?7H2O(10 mol%)作為催化劑,LiOAc(20 mol%.)作為添加劑,Br-Salox(S-L3)(15 mol%)作為配體,KMnO4(10 mol%)與氧氣作為共氧化劑,在MeOH/TFE混合溶劑中80 ℃反應12小時后,可以95%的收率得到產物3aa,ee為95%。
在獲得上述最佳反應條件后,作者首先對苯硼酸底物2的范圍進行了考察(圖2)。總體來講,各種官能團的苯硼酸均可被兼容,其中,各類含供電子基團的苯硼酸反應效果良好(3ab-3ag, 84%-99%, 92%-96% ee),而鹵素、酯基等吸電子基反應活性相對較低,需適當延長反應時間以提高產率(3aq-3at, 55%-89%, 83%-90% ee)。該反應也可兼容各類活性官能團、雜芳基硼酸與烯基硼酸等(3ah-3ap, 3au-3az, 25%-99%, 81%-95% ee)。同時,通過X射線衍射分析確定了3aj和3as的絕對構型,其他產物的立體構型可類比得知。
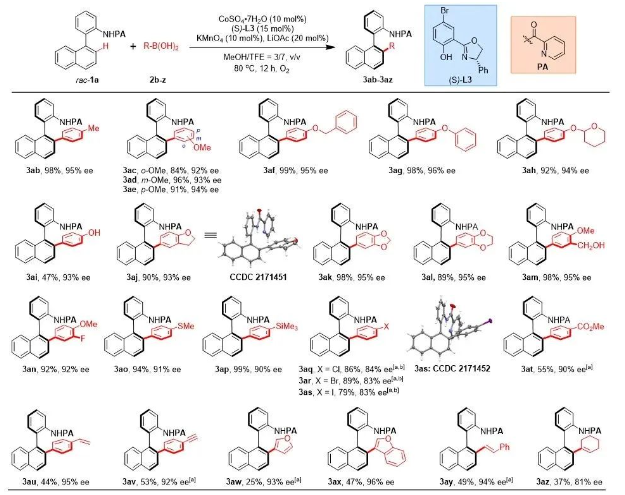
圖2. 芳基硼酸底物范圍考察。
圖片來源:Angew. Chem. Int. Ed.
隨后,作者也考察了聯芳基苯胺1的適用范圍(圖3)。當導向基鄰位存在甲基取代時(3bd, N.R.),該反應不能進行,而其它位點則可兼容各類供、吸電子取代基,均以優秀的產率和ee值得到目標產物(3cd-3kd , 71%-96%, 92%-99% ee),雜環類聯芳基苯胺底物也可兼容。值得注意的是,當底物中6號位存在位阻基團,如甲基或酯基取代時(rac-1m, rac-1n),可實現動力學拆分,以中等的ee值得到芳基化產物,同時回收手性原料。
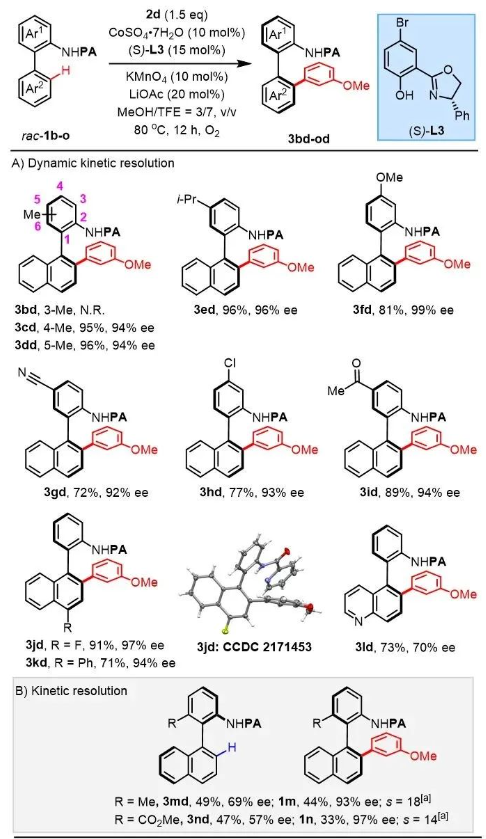
圖3. 聯芳基苯胺衍生物范圍考察。
圖片來源:Angew. Chem. Int. Ed.
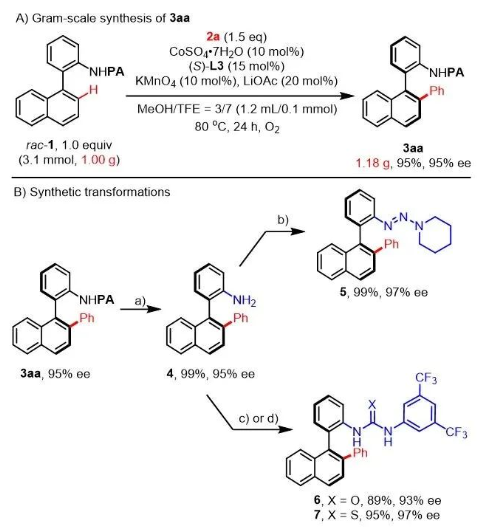
圖4. 克級規模制備與產物轉化。
圖片來源:Angew. Chem. Int. Ed.
為研究反應機理,作者進行了自由基捕獲實驗,向體系中加入兩當量TEMPO作為自由基捕獲劑后,該反應完全被抑制,據此推測反應中可能存在單電子轉移過程(圖5A)。結合此前的機理研究(Angew. Chem. Int. Ed., 2022, 61, e202202892),作者提出了該反應可能的反應機理:首先二價鈷與salox在氧化劑作用下原位生成手性三價鈷絡合物Int-1,隨后與底物結合,得到兩種非對映異構體Int-2與Int-3,其中,Int-3由于底物萘環與配體苯酚環之間存在π-π堆疊而成為優勢異構體。隨后Int 3發生碳氫活化得到六元環鈷絡合物Int-4,此時底物中導向基上的吡啶環與配體噁唑啉的苯環之間的π-π相互作用也有助于穩定Int-4中聯芳結構的軸向手性。隨后Int-4經芳基自由基單電子氧化,原位生成四價鈷絡合物Int-5后還原消除得到目標芳基化產物,同時再生二價鈷,進入下一輪催化循環(圖5B)。
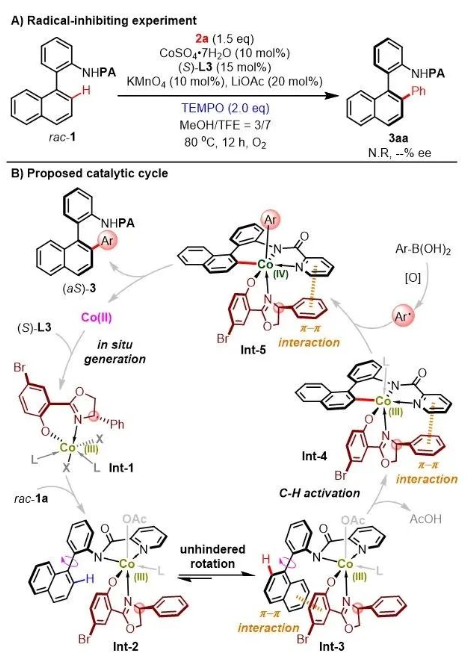
圖5. 機理研究實驗與可能的反應機理。
圖片來源:Angew. Chem. Int. Ed.
綜上,史炳鋒課題組通過簡單鈷鹽/salox催化阻轉選擇性碳氫鍵芳基化反應,高效合成了一系列軸手性聯芳化合物,并通過一系列轉化證明了該方法的實用性。結合機理研究實驗,作者提出了可能的反應機理。
這一成果近期在線發表在Angewandte Chemie International Edition 上,文章的通訊作者是我系史炳鋒教授及姚啟鈞博士,吳勇杰博士為本文的第一作者。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn