

正文
發散性合成,即利用相同的反應底物,通過控制反應中間過程控制其化學選擇性,從而構建出多種不同類型的分子。自由基,因具有較高的反應活性,是進行發散性合成較為理想的物種之一。然而,自由基的高活性也往往導致其反應過程難以精準控制,無法實現較為理想的高化學選擇性。在過去十余年,盡管已有幾例可見光-自由基化學選擇多樣性的報道,但反應條件往往較為苛刻。另外,在自由基途徑的不對稱合成中,高反應性亦導致手性催化劑很難對立體中心的形成實現充分有效的手性控制。因此,自由基途徑的對映選擇性、化學發散性合成是一項極具挑戰的課題。下載化學加APP到你手機,更加方便,更多收獲。
作者起始選擇α-溴代苯乙酮(1a)、苯乙烯(2a)和N-甲基-2-(1H)-喹喔啉酮(3a)作為模板底物進行研究。發現在25℃不加催化劑的條件下進行轉化,就能以81%的收率得到目標產物4a,表明該反應存在很強的外消旋背景反應。當溫度降低至-50°C時,使用手性催化劑SPINOL-CPA (C1)和3.0當量的Na3PO4反應96 h,以68%的產率和93%的ee得到了手性產物4a,由此確定的反應的最佳條件。控制條件表明,無手性催化劑C1、無DPZ、無光照以及在空氣條件下,幾乎檢測不到目標產物;有趣的是,當體系無Na3PO4 時,作者檢測到另一新產物5a。
確定最優條件后,作者對底物范圍進行了考察。首先考差了在α-溴代芳基乙酮的芳環上引入不同類型的吸/供電子基團(1a-j),均能以中等收率以及良好的ee值得到目標產物(88-90% ee);其它類型的自由基源,比如2-bromo-1-(naphthalen-2-yl)ethan-1-one (1k)、2-bromo-1-(thiophen-2-yl)ethan-1-one (1l)、1-((bromomethyl)sulfonyl)-4-methylbenzene (1n) 等均能獲得良好的產率和ee值;換用不同類型的芳基乙烯(1t-zd)亦能獲得較佳的結果;最后考察了具有不同取代基類型的喹喔啉酮(1ze-zm),仍然能夠獲得優異的產率和ee值。值得一提的是,除了喹喔啉酮外,吡嗪類似物(1zn)也可以作為氮雜環參與反應,進一步說明了該策略的普適性。
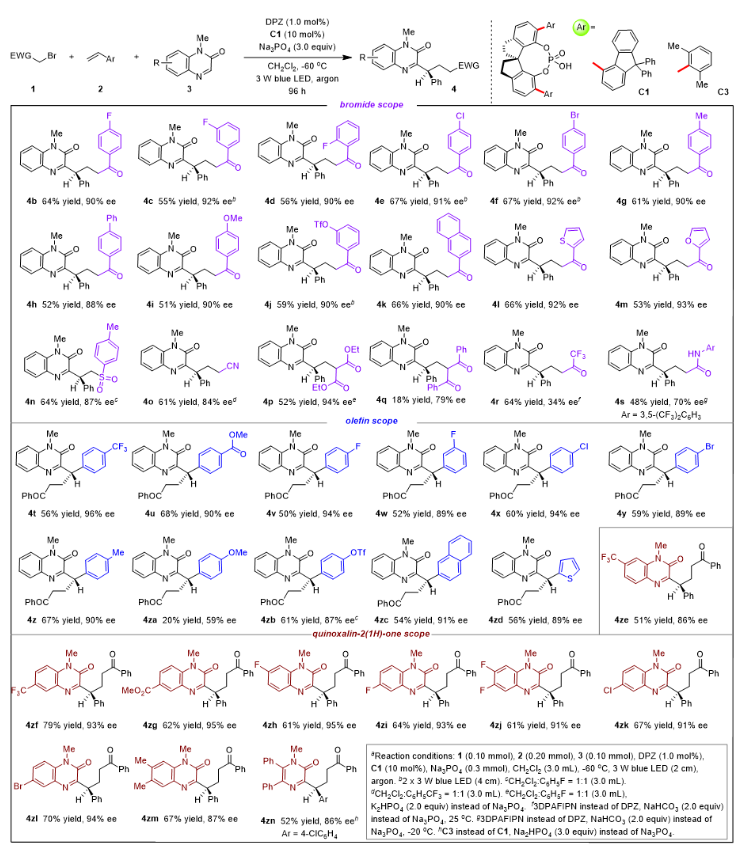
(圖片來源:J. Am. Chem. Soc.)
前面提到,作者發現在沒有Na3PO4的情況下,僅以21%的收率和86%的ee值得到4a。通過分析,發現并確定了二氫喹喔啉-2-酮類雙環化合物5a為主要產物(31% yield, 83% ee, 7.7:1 dr)。考慮到5a分子骨架的生物學重要性,不對稱合成方法的缺乏,以及驗證化學發散合成對于不對稱光催化的可行性的意義,促使作者繼續探索并提高其產率和ee值的可能性。通過反應條件的優化,最終使用Na2HPO4鈉代替Na3PO4,3 ?分子篩作為添加劑時,在標準反應條件下,以47-63%的產率和82-99%的ee值以及>10:1的dr值合成了一系列雙環化合物5a-x。值得注意的是,作者還發現:該部分產物5之所以產率中等的主要原因在于,2-(1H)-喹喔啉酮、芳基烯烴以及體系中產生的溴自由基(Br?)直接發生反應,產生另一副產物(9i),從而影響到該部分產物的收率。
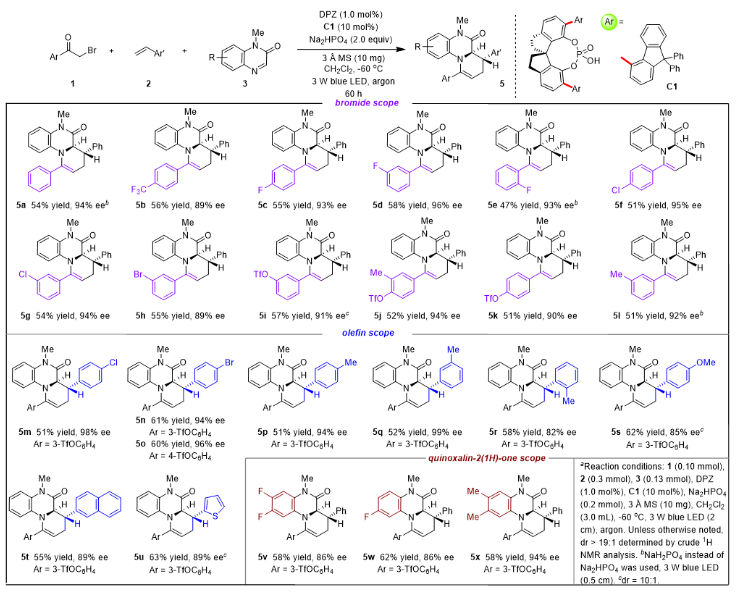
(圖片來源:J. Am. Chem. Soc.)
為了考察此反應方案的實用性,作者也進行了藥物活性分子的合成。通過產物4a,經還原、消除、還原三步簡單反應,即可高產率和手性幾乎保持獲得具有蛋白受體酪氨酸激酶抑制作用的分子(II)。
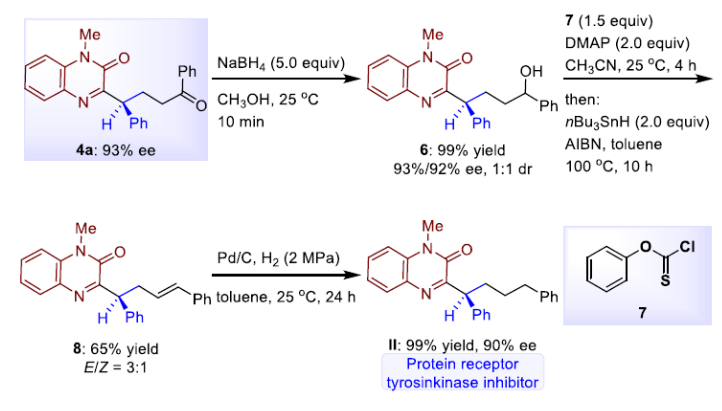
(圖片來源:J. Am. Chem. Soc.)
機理研究部分:作者首先進行了Stern-Volmer實驗,三種底物與激發態的光敏劑(*DPZ)均未檢測到猝滅現象,說明該反應的啟動不是直接的氧化/還原猝滅,可能是體系中產生游離的溴自由基或溴負離子引發的,這一結果與Phipps, Studer, Fu等人所報道的不對稱Minisci反應機理基本一致;產物3a與手性磷酸(C1)的ee線性關系表明,該反應手性的誘導是單分子催化作用的過程;此外,通過實驗現象分析,在形成5i的轉化中,9i作為主要的副產物具有28%的產率和78%的ee值,這表明在反應體系中形成了溴自由基(Br?),即*DPZ對Br?發生單電子轉移產生的Br?;9i具有的78% ee值可以直接說明CPA與底物3中的N原子之間形成氫鍵相互作用的必要性。
作者隨后進行了密度泛函理論(DFT)計算。反應從還原態的DPZ??將溴化物1a通過單電子還原過程產生自由基11a開始(圖1B)。隨后,自由基11a通過過渡態TS1(DG = 8.1 kcal/mol)與苯乙烯2a發生自由基加成過程,得到α -芳基自由基12a,再通過過渡態TS2與復合物CPA-3a自由基加成,此過程能壘僅為1.5 kcal/mol。在使用堿性較強的Na3PO4作為添加劑的條件下,最優路徑是生成的自由基13a可以被溴自由基攫氫從而形成Minisic產物4a,并釋放形成的HBr和催化劑CPA。
另外,受MacMillan研究結果的啟發,在弱堿Na2HPO4作為添加劑的條件下,考慮到副產物生成過程中(例如9i)會伴隨著少量HBr的生成,自由基中間體13a是否可以通過從反應體系中捕獲一個氫質子,從而降低其單電子還原能壘呢?的確,質子化后的II-14a被DPZ??單電子還原為中性中間體II-15a的過程比氫原子轉移過程(I-TS3)更有利,該反應過程放熱47.4 kcal/mol。隨后, II-15a通過構象轉化為更穩定的具有雙重氫鍵作用的中間體II-16a (N-H…O和額外形成的O-H…O作用)。中間體II-16a再經過協同的質子遷移和環加成過渡態II-TS4生成雙環的醇中間體II-17a,該過程反應能壘為6.0 kcal/mol。最后,在Na2HPO4的作用下,Ⅱ-17a脫水最終得到雙環產物5a。因此,在Na2HPO4存在的較低堿性條件下,可以促進自由基13a形成自由基陽離子II-14a,進一步降低單電子還原的能壘,促進生成雙環產物5a。
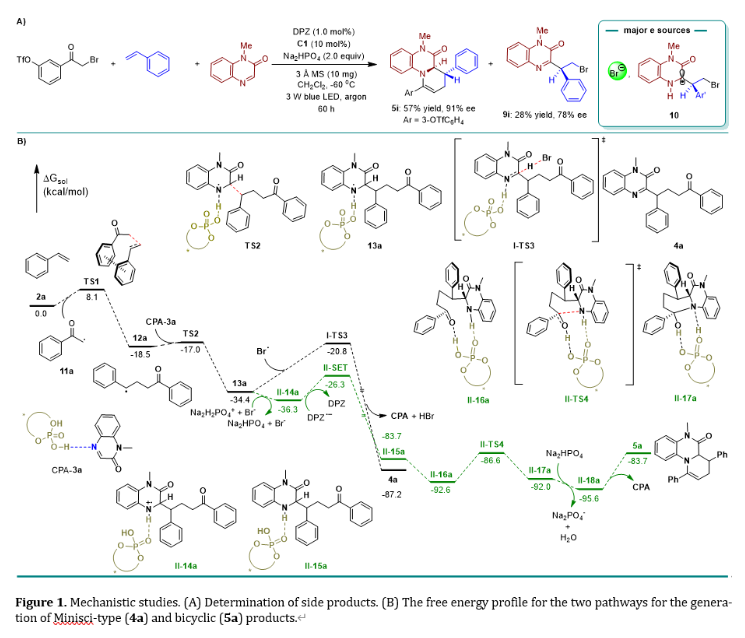
(圖片來源:J. Am. Chem. Soc.)
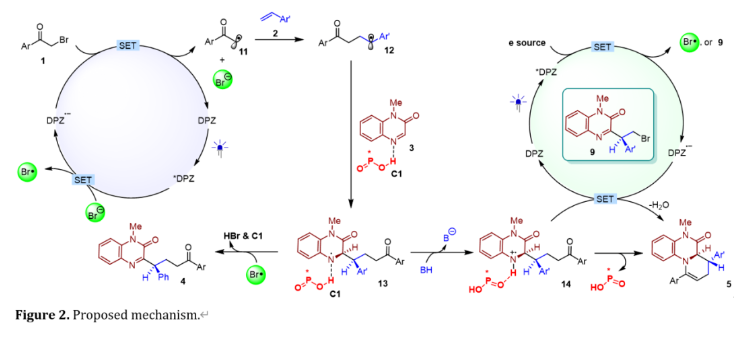
綜上,作者提出了該多組分對映選擇性發散合成反應的可能機理(圖2)。對于產物4的轉化,由*DPZ對溴負離子(Br?)的單電子氧化觸發,生成的DPZ?? (Ered1/2 = ?1.07 V versus SCE in CH3CN) 隨后還原溴化物1 (e.g., 1a: Ep/2 = ?0.81 V versus SCE in CH3CN)完成DPZ的催化循環,并產生自由基11。11與苯乙烯2加成后,生成α -芳基自由基12,隨后,該自由基進攻手性催化劑CPA (C1)活化的底物喹喔啉-2-酮(3)的3位,生成中間體13。此時,在Na3HPO4條件下,產物4更容易通過溴自由基對中間體13的攫氫過程生成,而不是經過連續的單電子氧化和去質子化過程生成。另一方面,13也是形成雙環產物的關鍵中間體5。DFT計算結果表明在Na2HPO4(比Na3PO4更弱的無機堿)存在時,中間體13會容易形成質子化的自由基14,其優先發生單電子還原,隨后環化脫水得到最終產物5。
(圖片來源:J. Am. Chem. Soc.)
總結
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn