



(圖片來源:Nat. Catal.)
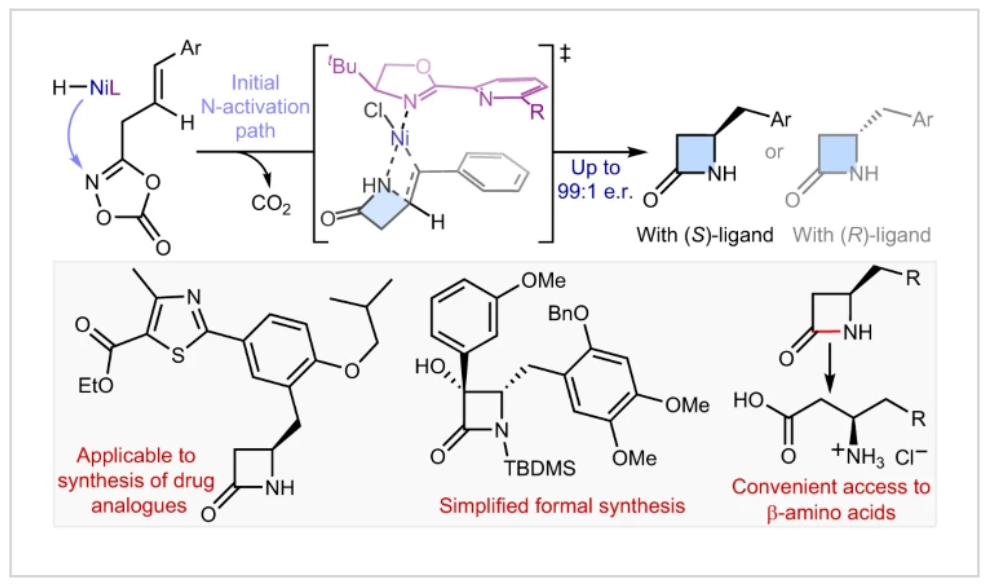
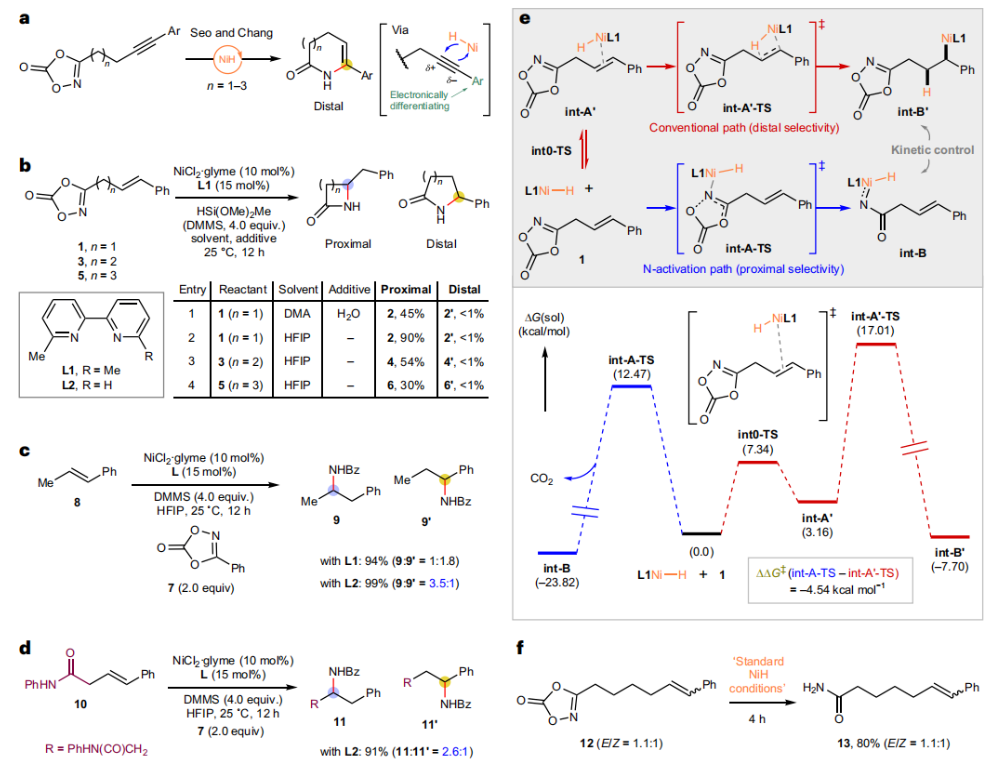
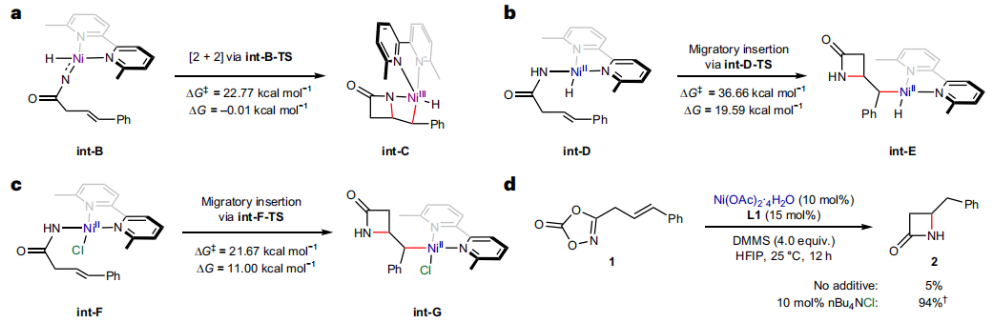
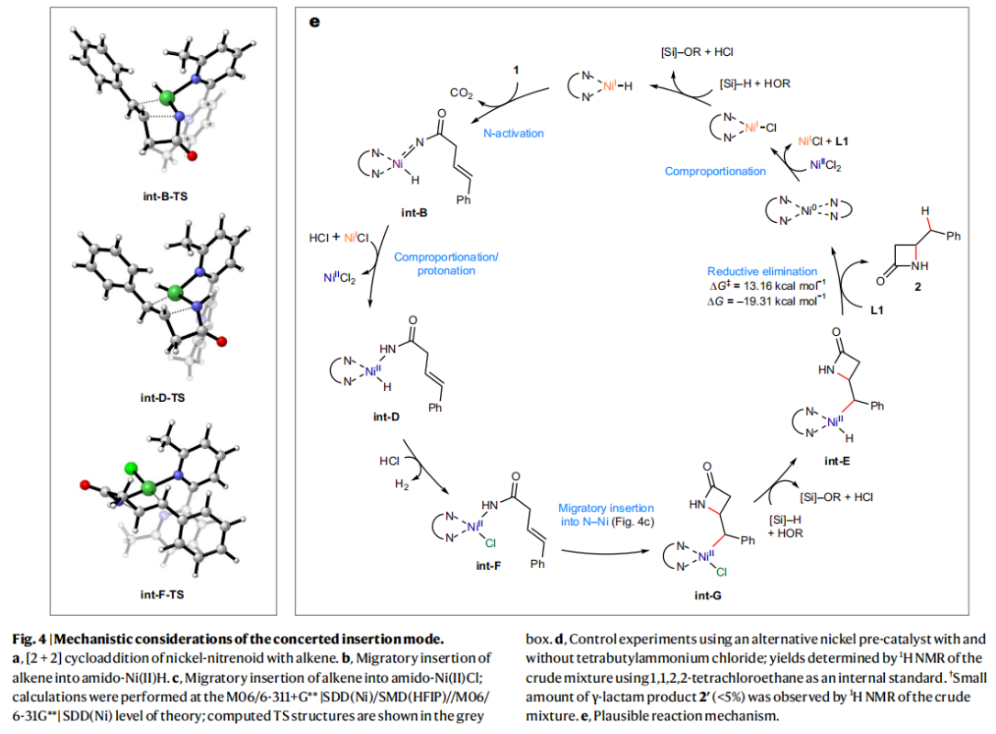
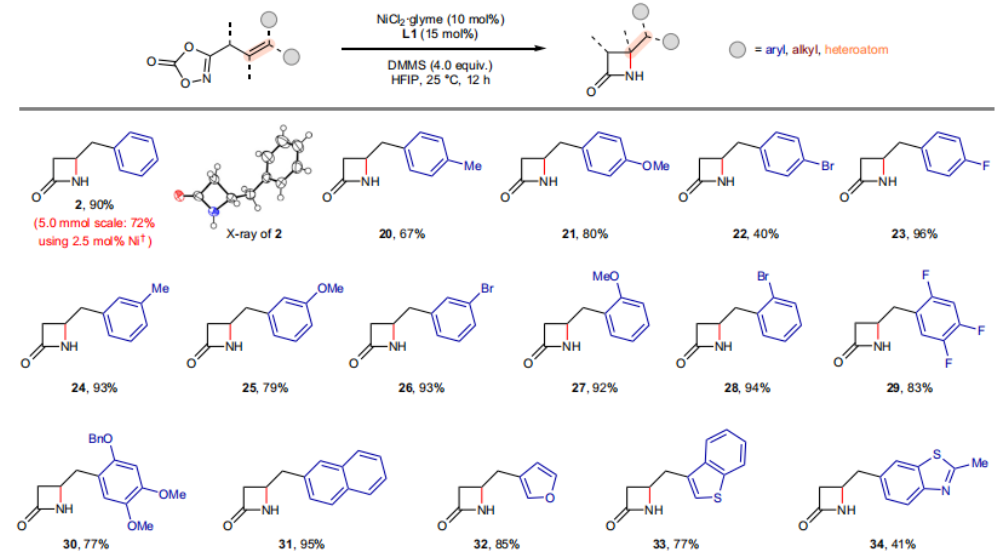
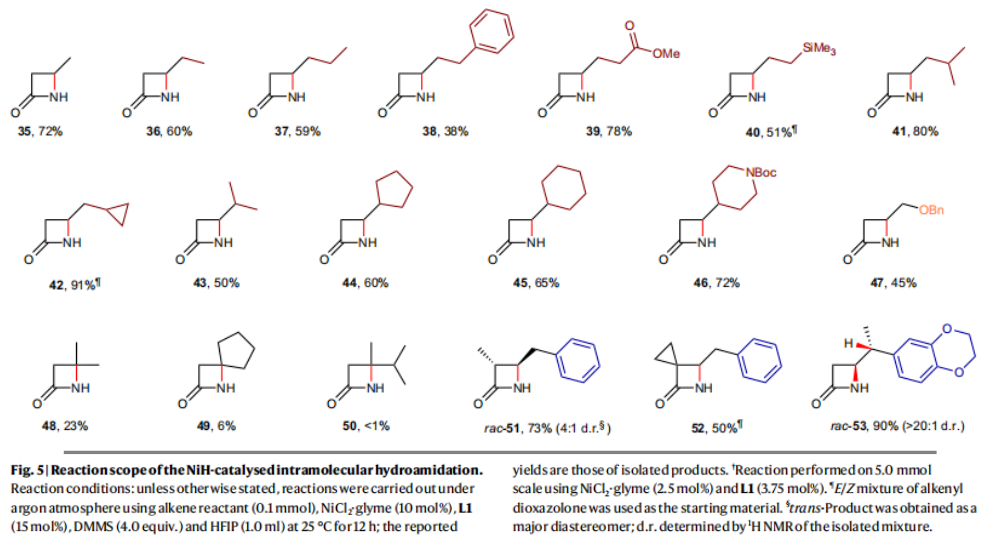
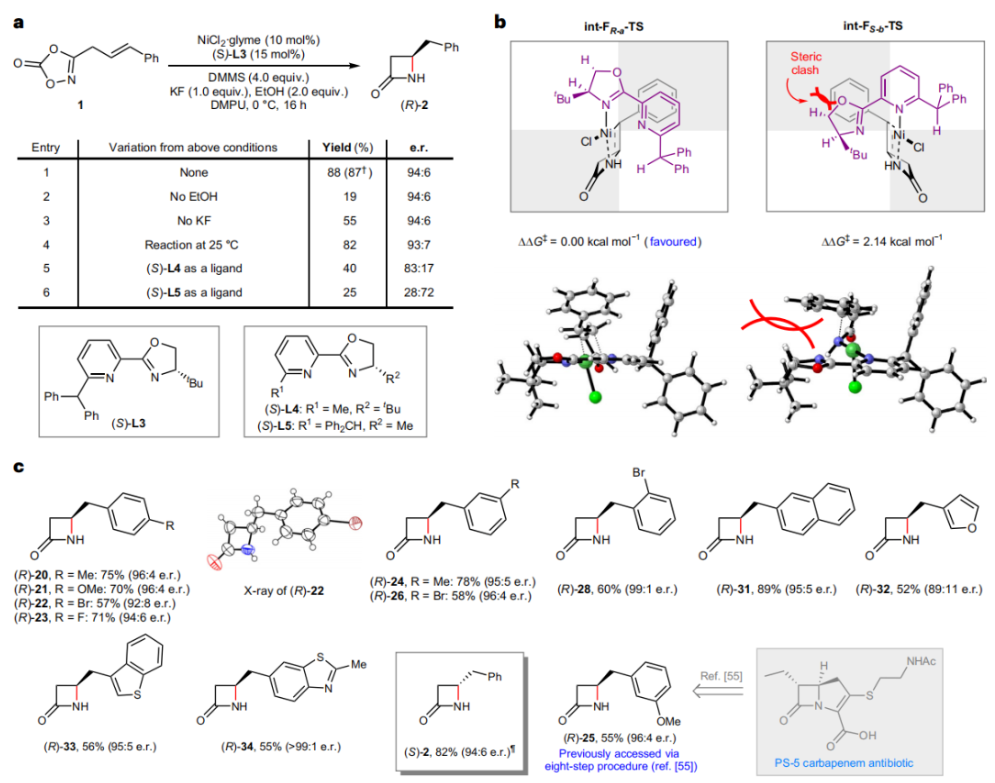
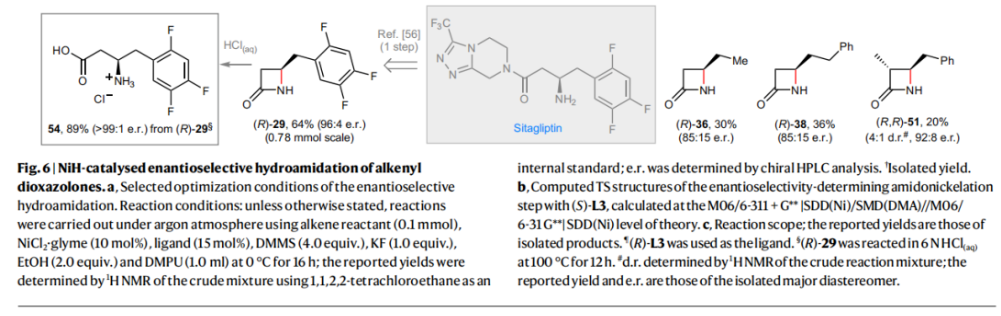
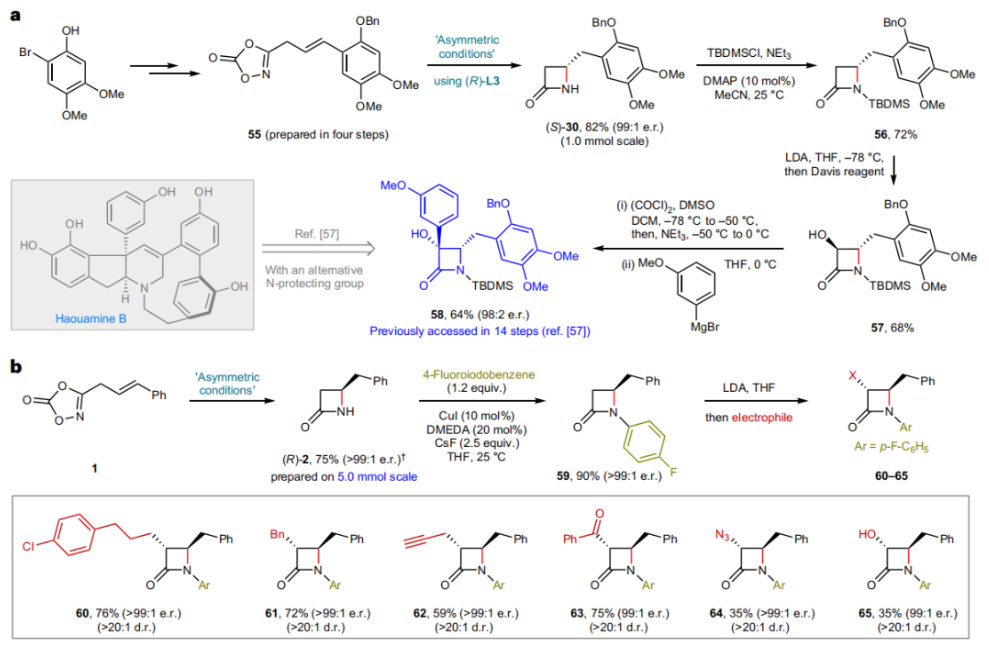
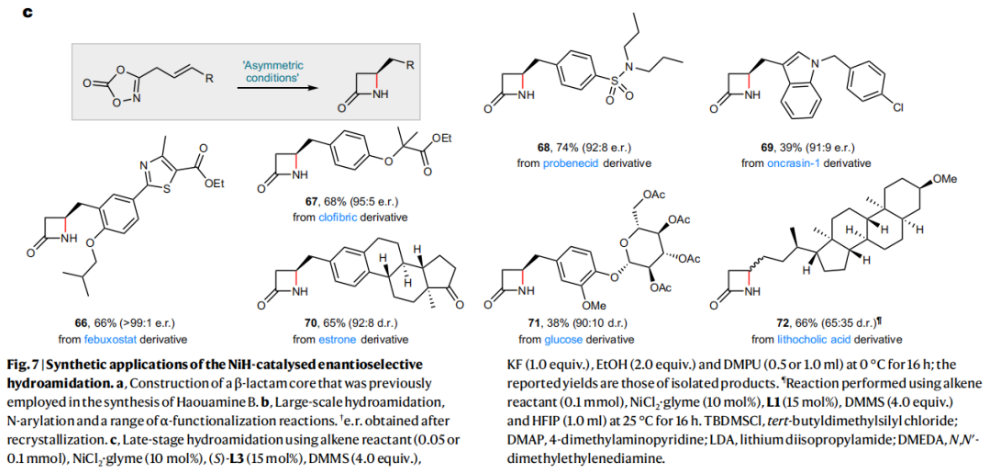
正文 由于β-內(nèi)酰胺在青霉素類和碳青霉烯類抗生素等生物活性化合物中廣泛存在,因此發(fā)展對映體富集的β-內(nèi)酰胺合成方法是至關重要的。雖然β, γ-不飽和酰胺的分子內(nèi)氫-酰胺化為β-內(nèi)酰胺的合成提供一種方便的方法,但由于具有較高張力的四元環(huán)難以形成所引起的區(qū)域選擇性問題,使其在合成中的應用受到極大的限制。最近,Sangwon Seo與Sukbok Chang課題組聯(lián)合發(fā)展了NiH催化策略,高區(qū)域選擇性的實現(xiàn)了烯基二噁唑酮衍生物的分子內(nèi)氫-酰胺化反應,選擇性構建了一系列β-內(nèi)酰胺(Fig. 1)。下載化學加APP到你手機,更加方便,更多收獲。 (圖片來源:Nat. Catal.) 首先,作者選擇烯基二噁唑酮1作為模板底物進行反應探索(Fig. 2)。通過一系列條件篩選,作者發(fā)現(xiàn)當使用NiCl2·glyme (10 mol%), L1 (15 mol%), DMMS(dimethoxy(methyl)silane)(4.0 equiv.),在HFIP中25 °C反應12小時可以以90%的產(chǎn)率專一的得到β-內(nèi)酰胺產(chǎn)物2。此外,當使用延長碳鏈的原料3或5反應時,仍可以分別以54%和30%的產(chǎn)率得到γ-內(nèi)酰胺4和δ-內(nèi)酰胺產(chǎn)物6。通常來講,γ-內(nèi)酰胺2’ 應該為此類轉化的主要產(chǎn)物,而構建β-內(nèi)酰胺產(chǎn)物則相對比較困難。為了深入理解此轉化的區(qū)域選擇性,作者進行了一系列控制實驗和DFT計算并得出如下結論:1)在目前的催化體系中,導向效應是微不足道的;2)與共軛芳基取代基所引起的電子擾動相比,二噁唑酮官能團的誘導效應即使存在,也只是微不足道的;3)作者認為β-內(nèi)酰胺2可能通過一種涉及N-活化的途徑獲得;4)Ni(I)H活化二噁唑酮所需的能量比氫-鎳化過程要低(ΔΔG?= -4.54 kcal mol-1,配體= L1),從而得到NiH中間體(int-B),該中間體隨后實現(xiàn)了近端的C-N鍵構建。 (圖片來源:Nat. Catal.) 基于提出的N-活化為此轉化的主要起始途徑,作者通過控制實驗對后續(xù)的反應過程進行了探索(Fig. 3)。在標準條件下,當使用三取代烯烴14進行氫-酰胺化反應時,氮和氫通過專一的順式加成,以66%的產(chǎn)率,>20:1 dr得到相應的β-內(nèi)酰胺產(chǎn)物rac-15,這與逐步加成機理通常具有較低非對映選擇性相沖突(Fig. 3a)。類似的,當使用Ph2SiD2代替DMMS進行氘代實驗時,無論使用(E)-1還是(Z)-1均可以得到相應的β-內(nèi)酰胺產(chǎn)物rac-2-d1(48%)和rac-2-d2(22%)。此外,當使用Nopinone取代的烯基二噁唑酮 rac-16和環(huán)丙基取代的烯基二噁唑酮18參與反應時,可以分別以78%和67%的產(chǎn)率得到唯一產(chǎn)物rac-17和19,且并未觀察到重排產(chǎn)物生成,由此排除了反應中涉及碳正離子中間體和自由基中間體的可能性(Fig. 3c,d)。 (圖片來源:Nat. Catal.) 基于上述實驗結果和計算結果,作者提出了此轉化可能的反應機理(Fig. 4)。鎳氫物種通過氮活化得到int-B; 隨后int-B通過歸中/質(zhì)子化以及配體取代過程得到int-F; 接下來,int-F經(jīng)歷N-Ni插入雙鍵和配體交換得到烷基-NiH中間體int-E;最后int-E通過還原消除(ΔG? = 13.16 kcal mol?1 , ΔG = ?19.31 kcal mol?1)得到β-內(nèi)酰胺產(chǎn)物2和Ni(0)物種。 (圖片來源:Nat. Catal.) 在深入理解了此轉化不同尋常的區(qū)域選擇性后,作者對此NiH-催化的分子內(nèi)氫-酰胺化反應的底物范圍進行了探索(Fig. 5)。實驗結果表明,一系列(雜)芳基取代的烯烴均可順利兼容此轉化,以41-96%的產(chǎn)率得到相應的產(chǎn)物2-34。此外,此轉化對端炔以及烷基取代的烯烴同樣具有良好的兼容性,以38-91%的產(chǎn)率得到相應的β-內(nèi)酰胺產(chǎn)物35-47, 51-53。當在C-N鍵形成的碳上增加取代基對反應效率不利,僅分別以23%,6%,<1%的產(chǎn)率得到產(chǎn)物48, 49和50。 (圖片來源:Nat. Catal.) 接下來,作者對此轉化的不對稱誘導過程進行了探索(Fig. 6)。當使用NiCl2·glyme (10 mol%), Pyox 配體 (S)-L3 (15 mol%),DMMS (4.0 equiv.), KF (1.0 equiv.), EtOH (2.0 equiv.),在DMPU(N,N’-dimethylpropylene urea)中0 °C反應16小時可以以88%的產(chǎn)率,94:6的er得到(R)-2。此外,作者通過DFT計算對此環(huán)化的不對稱誘導過程進行了計算。最后,作者對此不對稱誘導過程的底物范圍進行了考察。實驗結果表明此體系對不同取代的底物具有良好的適用性,以52-89%的產(chǎn)率,99:1-89:11的er得到相應的產(chǎn)物(R)-20-(R)-24,(R)-26,(R)-28,(R)-31-(R)-34。值得注意的是,利用此策略僅通過4步即可實現(xiàn)(+)-PS-5 碳青霉烯抗生素(carbapenem antibiotic)的形式合成關鍵中間體,而之前文獻報道的過程(Synlett, 1992, 35)則需要8步。此外,利用此策略還可以實現(xiàn)Sitagliptin全合成過程所需的關鍵中間產(chǎn)物(R)-29(64%, 96:4 dr)的合成。 (圖片來源:Nat. Catal.) 最后,作者探索了所發(fā)展的分子內(nèi)對映選擇性氫-酰胺化反應的合成應用(Fig. 7)。首先,作者通過四步合成得到了烯基二噁唑酮衍生物55,并通過所發(fā)展的對映選擇性氫-酰胺化反應,以82%的產(chǎn)率得到(S)-β-內(nèi)酰胺產(chǎn)物(S)-30(1.0 mmol 規(guī)模)。而(S)-30則可以通過N-TBDMS保護、α-羥基化、Swern氧化、格氏試劑加成得到多官能團化的β-內(nèi)酰胺58。利用58則可以利用文獻報道的方法(Angew. Chem. Int. Ed., 2014, 53, 13215)實現(xiàn)Haouamine B的合成(Fig. 7a)。接下來,作者利用1作為起始原料,將反應放大至5.0 mmol規(guī)模時仍可以以75%的產(chǎn)率得到β-內(nèi)酰胺產(chǎn)物(R)-2(>99:1 er)。(R)-2在經(jīng)歷了銅催化的N-芳基化反應后可以以90%的產(chǎn)率得到N-芳基-β-內(nèi)酰胺產(chǎn)物59(>99:1 er)。隨后,在LDA的存在下,59與一系列親電試劑反應,實現(xiàn)了α-位的官能團化,以35-76%的產(chǎn)率得到相應的產(chǎn)物α-烷基化、芐基化、炔基化、苯甲酰基化、疊氮化、羥基化產(chǎn)物60-65,且ee值可以得到保持(Fig. 7b)。最后,作者對一系列復雜生物活性分子的兼容性進行了考察(Fig. 7c)。包括febuxostat (66), clofibric (67), probenecid (68), oncrasin-1 (69), estrone (70) 和glucose (71)在內(nèi)的藥物和天然產(chǎn)物分子均可兼容此不對稱氫-酰胺化反應,以38-74%的產(chǎn)率得到相應的β-內(nèi)酰胺產(chǎn)物66-71。 (圖片來源:Nat. Catal.) 總結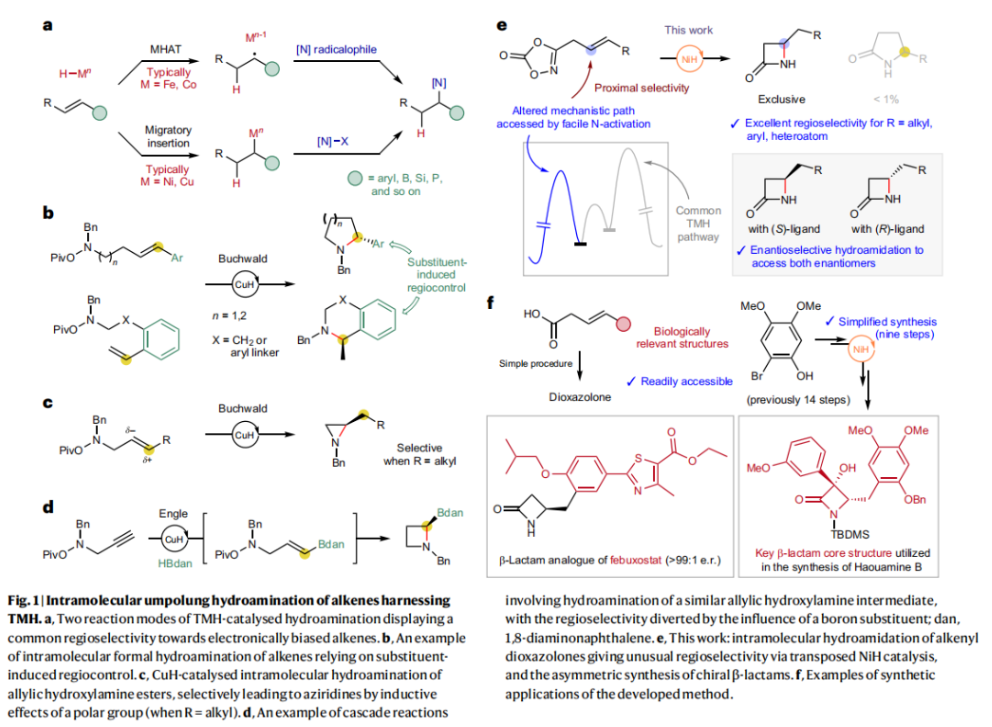


聲明:化學加刊發(fā)或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網(wǎng)聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn