

(圖片來源:J. Am. Chem. Soc.)
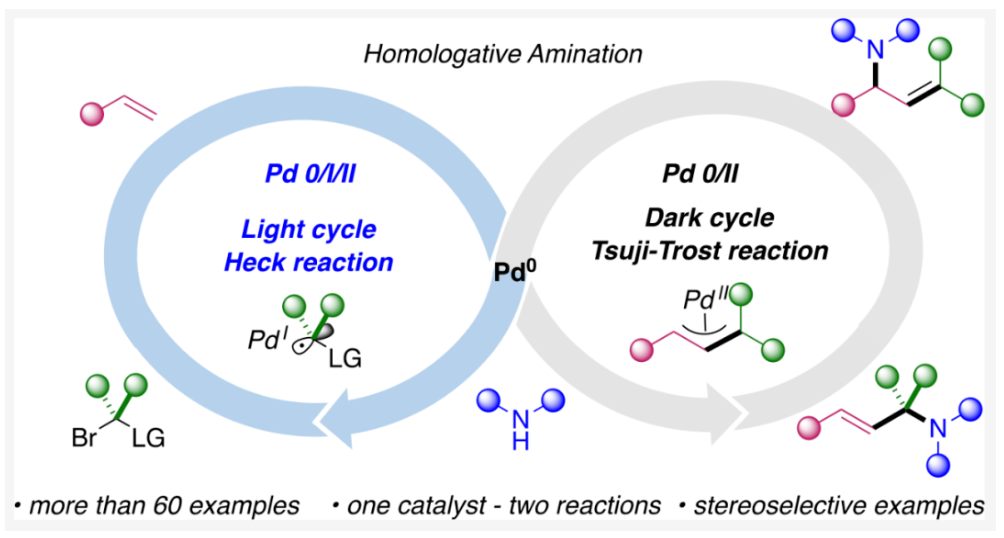
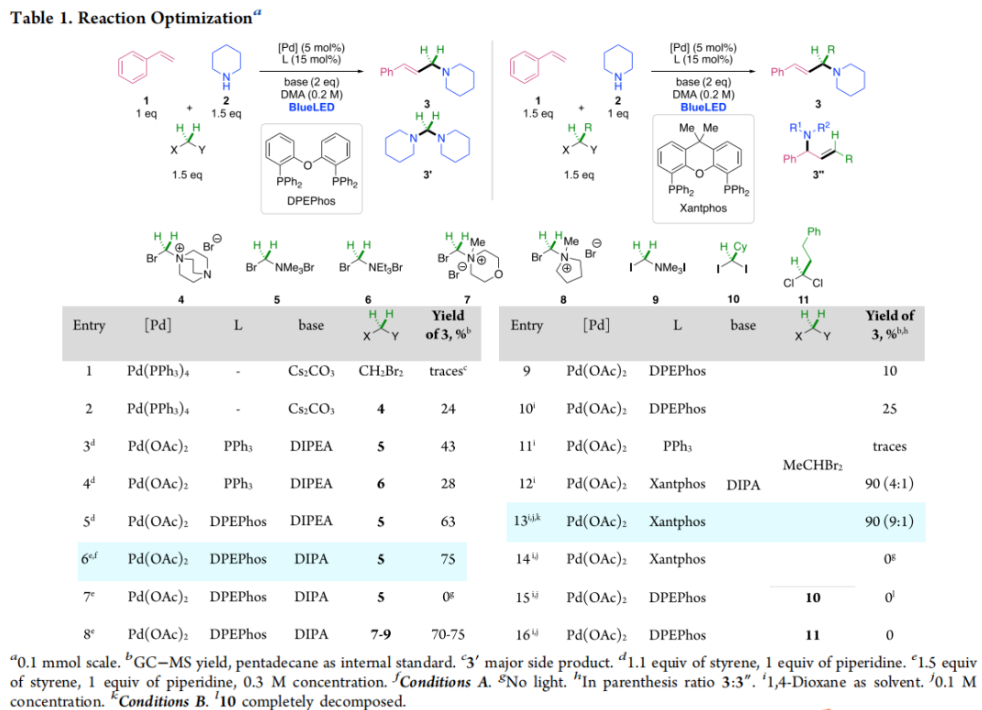
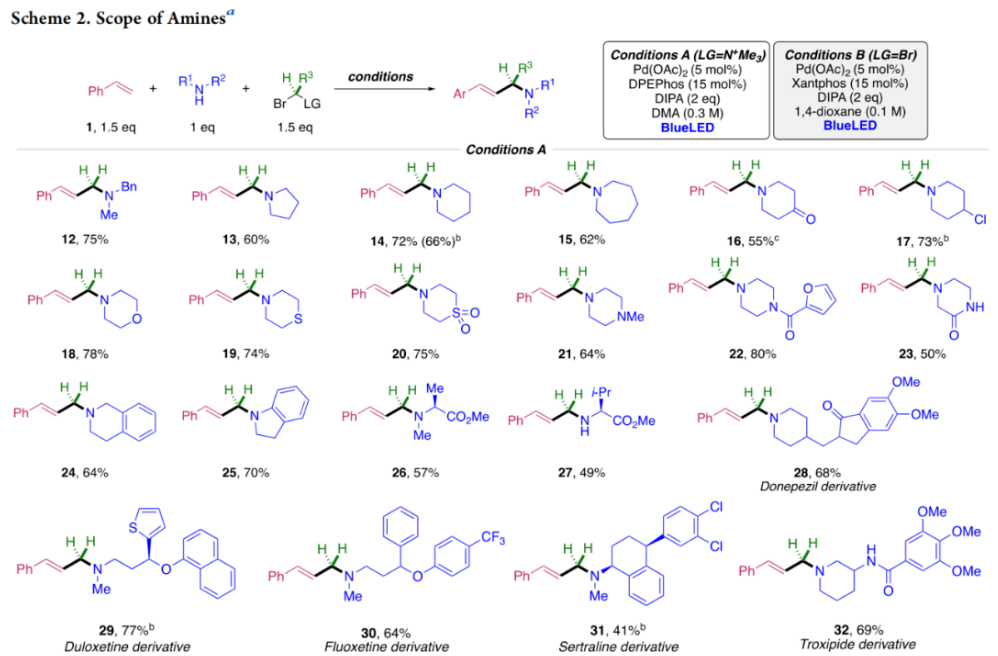
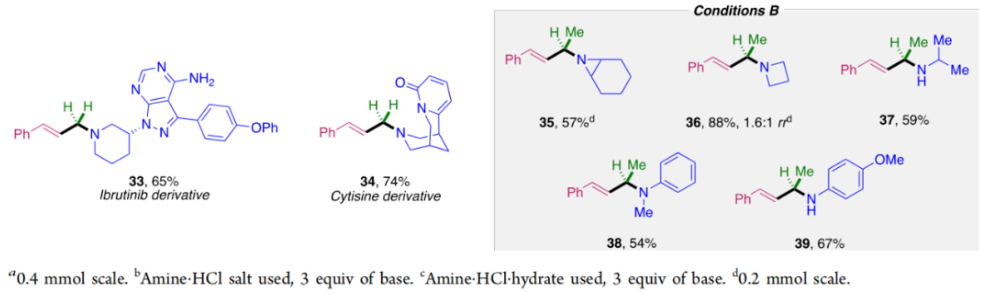
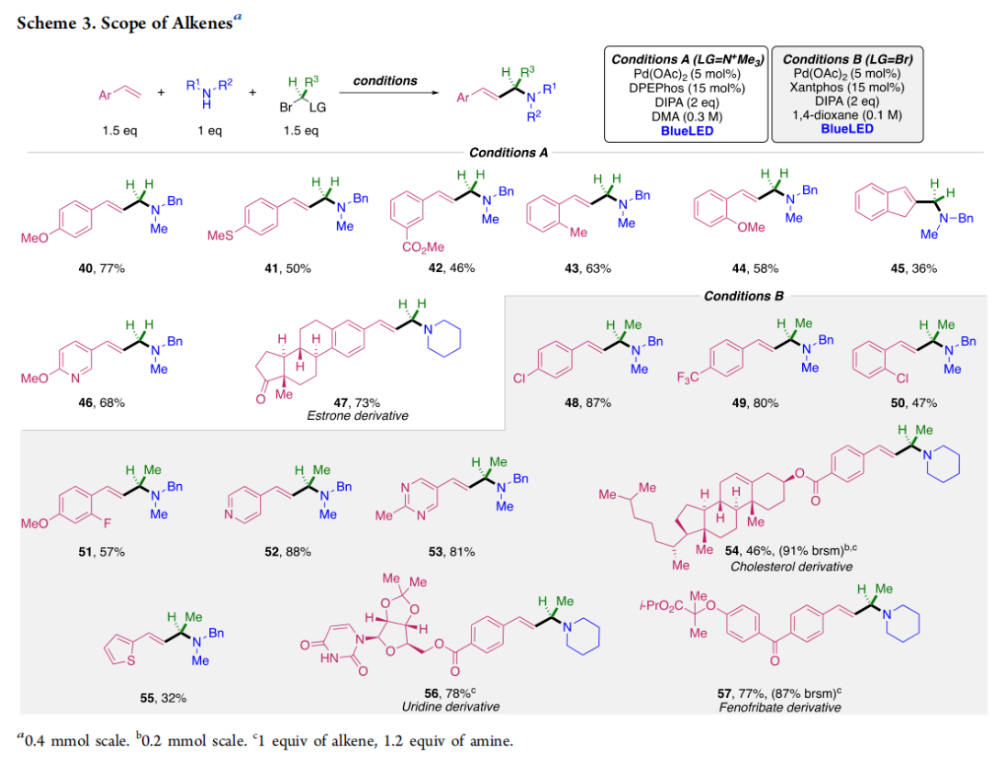
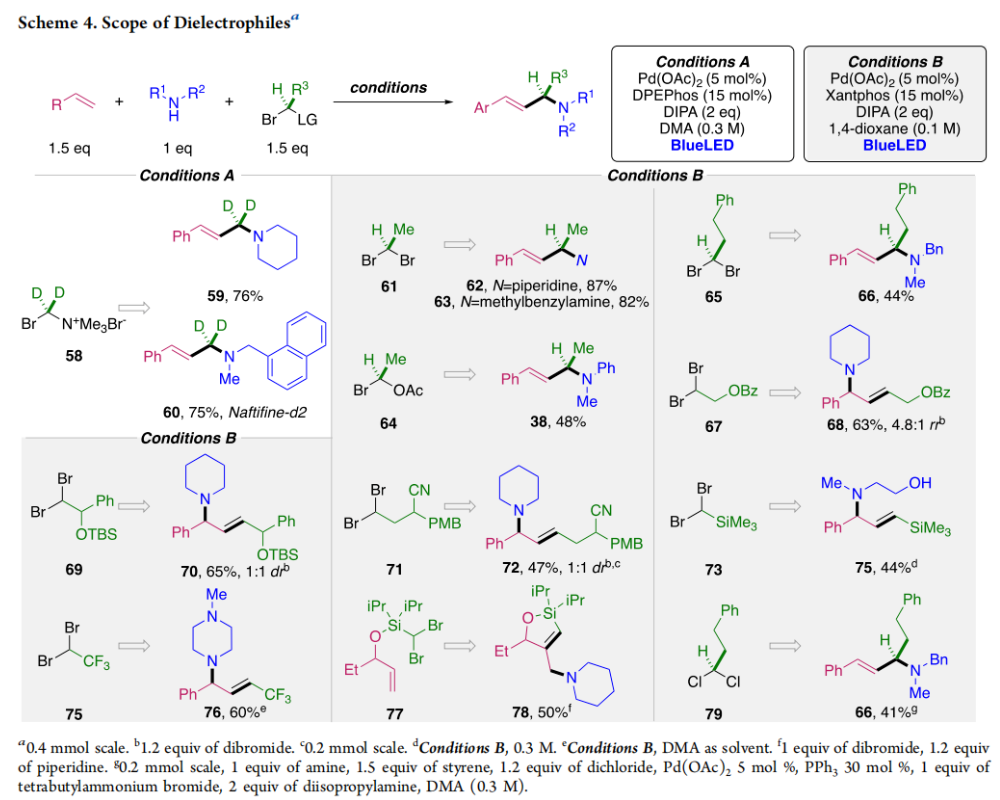
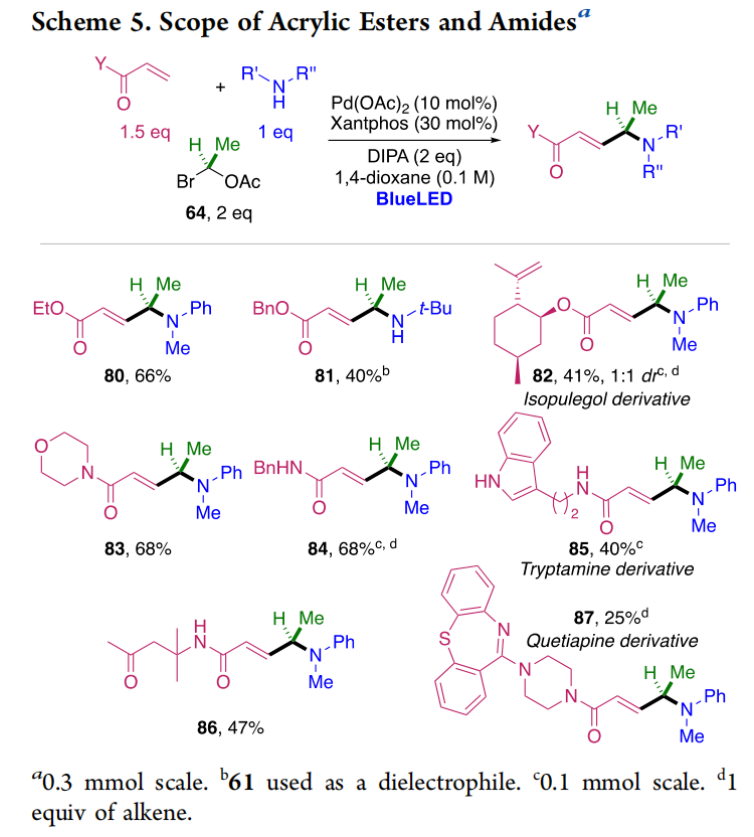
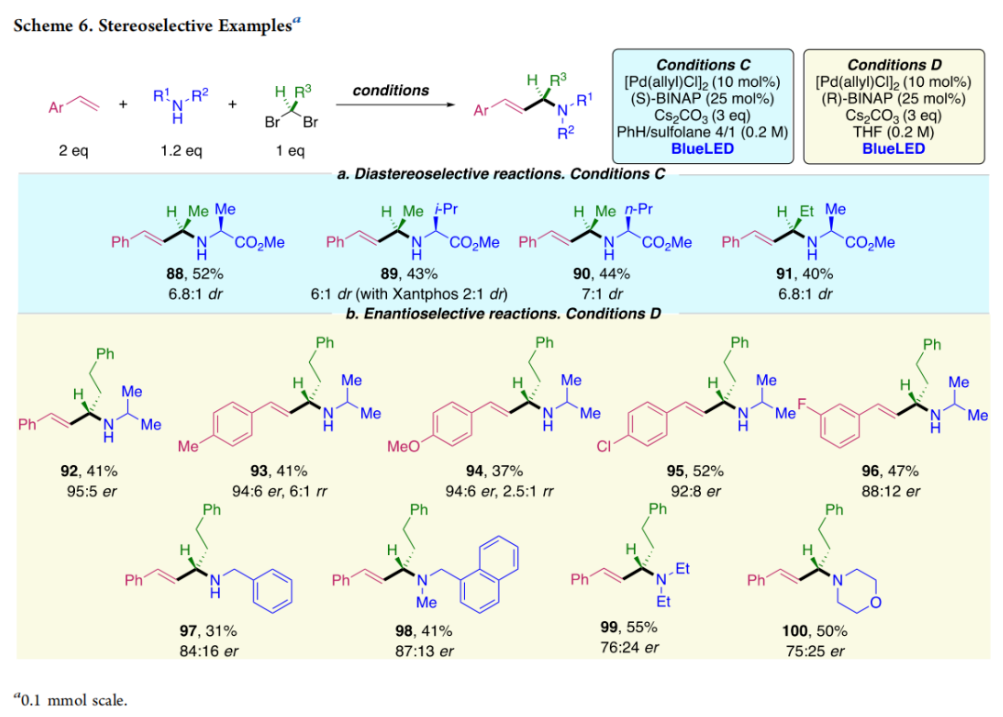
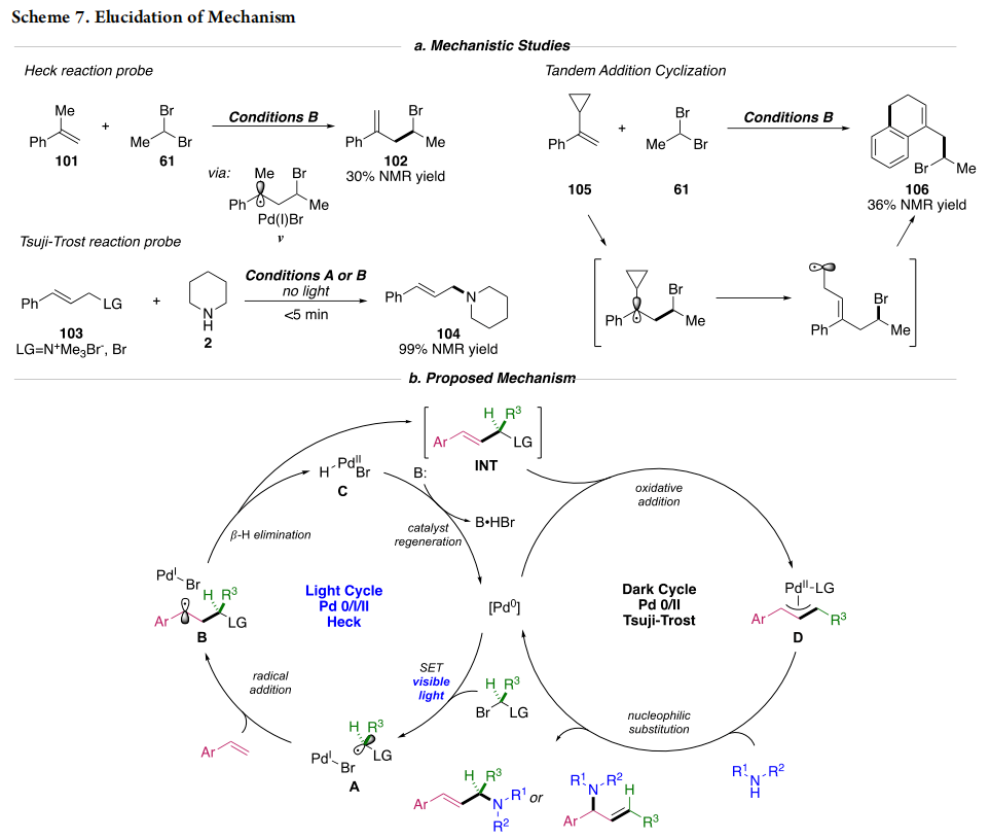
正文 烯丙基胺骨架是生物活性分子以及藥物中的重要結構單元(Scheme 1a)。化學家們通過廣泛的探索實現了利用各種反應前體高效實現烯丙基胺的構建,包括鈀催化的Tsuji-Trost反應、C-H活化反應等(Scheme 1b)。盡管如此,目前所有利用π-烯丙基鈀實現烯丙胺的構建方法均依賴于某一特定的起始原料,即圍繞著烯丙位上連有離去基(I)、二烯部分(II)或烯丙基C-H (III, IV)的烯丙基親電試劑所展開的。而使用不同類型的親電試劑來實現烯丙基胺的合成則可以為化學家提供更多的手段來構建這些重要的骨架。從這個角度來看,直接從不具有烯丙基部分的烯烴來合成烯丙基胺則具有重要的應用價值(Scheme 1c)。2014年,MacMillan課題組發展了光催化的方法,利用預官能團化的烯烴(烯基砜),通過自由基加成/消除策略實現了烯丙基胺的合成(J. Am. Chem. Soc. 2014, 136, 11602)。黃漢民課題組發展了苯乙烯與縮胺醛的Heck-類型C-H烷基化反應實現了烯丙基胺的合成(J. Am. Chem. Soc. 2012, 134, 20613)。雖然這些方法擴大了烯丙基胺前體的范圍,但它們均是兩組分反應,因此不能直接使用簡單易得的伯胺和仲胺作為起始原料。為了克服上述局限性,最近,美國德克薩斯大學達拉斯分校Vladimir Gevorgyan課題組利用烯基(雜)芳烴、伯胺或仲胺、雙親電試劑,在光照下,利用鈀催化實現了溫和的三組分偶聯反應,直接構建了一系列烯丙基胺類化合物(Figure 1d)。下載化學加APP到你手機,更加方便,更多收獲。 (圖片來源:J. Am. Chem. Soc.) 首先,作者選擇苯乙烯1和哌啶2作為模板底物進行反應探索。通過一系列反應參數優化,作者得出當使用1 (1.5 equiv), 2 (1.0 equiv), 5 (1.5 equiv), Pd(OAc)2 (5 mol%), DPEPhos (15 mol%), DIPA (2.0 equiv), 在DMA(0.3 M)中,藍光照射下反應可以以75%的產率得到烯丙基胺產物3(Condition A)。此外,當使用MeCHBr2作雙親電試劑,XantPhos (15 mol%)作配體,在1,4-二氧六環(0.1 M)中反應可以以90%的產率得到烯丙基胺產物3(Condition B)。控制實驗表明藍光的照射對此轉化至關重要。 (圖片來源:J. Am. Chem. Soc.) 在得到了最優反應條件后,作者對此轉化中胺的底物范圍進行了探索(Scheme 2)。實驗結果表明此轉化對一系列不同取代的二級胺和一級胺均具有良好的兼容性,以41-88%的產率得到相應的烯丙基胺產物12-39。值得注意的是,此體系對一系列復雜生物活性分子衍生物,如Donepezil, Duloxetine, Fluoxetine, Setraline, Troxipide, Ibrutinib, Cytisine等仍具有良好的普適性,證明了此轉化的實用性。此外,當使用哌啶鹽酸鹽直接參與反應時,仍可以以66%的產率得到產物14。 (圖片來源:J. Am. Chem. Soc.) 接下來,作者對烯烴的適用范圍進行了考察(Scheme 3)。實驗結果表明,不同取代的烯基芳烴和烯基雜芳烴均可順利參與轉化,以36-88%的產率得到相應的烯丙基胺產物40-57。一般來講,在Condition A下,富電子烯基芳烴的反應活性高于缺電子烯基芳烴;而在Condition B下,缺電子烯基芳烴的反應活性高于富電子烯基芳烴。值得注意的是,此轉化對于具有復雜生物活性分子骨架的烯烴同樣具有良好的普適性。遺憾的是,此體系不能兼容非活化烯烴。 (圖片來源:J. Am. Chem. Soc.) 緊接著,作者對雙親電試劑的普適性進行了考察(Scheme 4)。包括氘代的雙親電試劑58在內的一系列雙親電試劑均可兼容,以44-87%的產率得到相應的烯丙基胺產物。值得注意的是,當使用分子內帶有烯烴的底物77參與反應時,可以實現非活化烯烴的分子內環化,以50%的產率得到環烯丙基胺產物78。此外,此轉化對一系列缺電子烯烴,如丙烯酸酯、丙烯酰胺等同樣具有良好的兼容性,以25-68%的產率得到產物80-87(Scheme 5)。 (圖片來源:J. Am. Chem. Soc.) 當作者應用手性氨基酸作為胺親核試劑時,可以以良好的立體控制實現此轉化,以40-52%的產率,6:1-7:1的dr得到產物88-91(Condition C)。此外,當作者使用手性配體(R)-BINAP誘導,在Condition D條件下可以實現對映選擇性轉化,以37-55%的產率,75:25-95:5 er得到產物92-100(Scheme 6)。 最后,為了深入理解反應機理,作者進行了一系列控制實驗(Scheme 7A)。根據最初的設計,該串聯反應首先經歷烷基Heck反應。然而,作者并沒有檢測到Heck反應產物。作者認為可能是由于隨后的Tsuji-Trost取代反應速率較快,因此難以捕獲這一中間產物。且這一假設通過下面的實驗得到了驗證:當使用α-甲基苯乙烯101反應時,通過在中間體V的小位阻側發生β-H消除,以30%的NMR產率得到高烯丙基溴產物102。而當使用肉桂基親電試劑103與哌啶2即使在無光照條件下也可以在5分鐘內,以接近定量的產率(99%)觀察到產物104的形成。此外,當使用環丙基苯乙烯105與61反應時,通過自由基加成、開環以及環化等過程以36%的NMR產率得到自由基環化產物106。此結果不僅證實了烷基Heck反應的發生,也證實了反應經歷了自由基類型的轉化。上述實驗結果表明此轉化使用相同的鈀催化劑,分別實現了光誘導循環以及熱循環兩個過程。 基于上述實驗結果,作者提出了此轉化可能的反應機理(Scheme 7B)。首先,。取代的區域選擇性主要由π-烯丙基絡合物的取代以及胺的性質所決定。 (圖片來源:J. Am. Chem. Soc.) 總結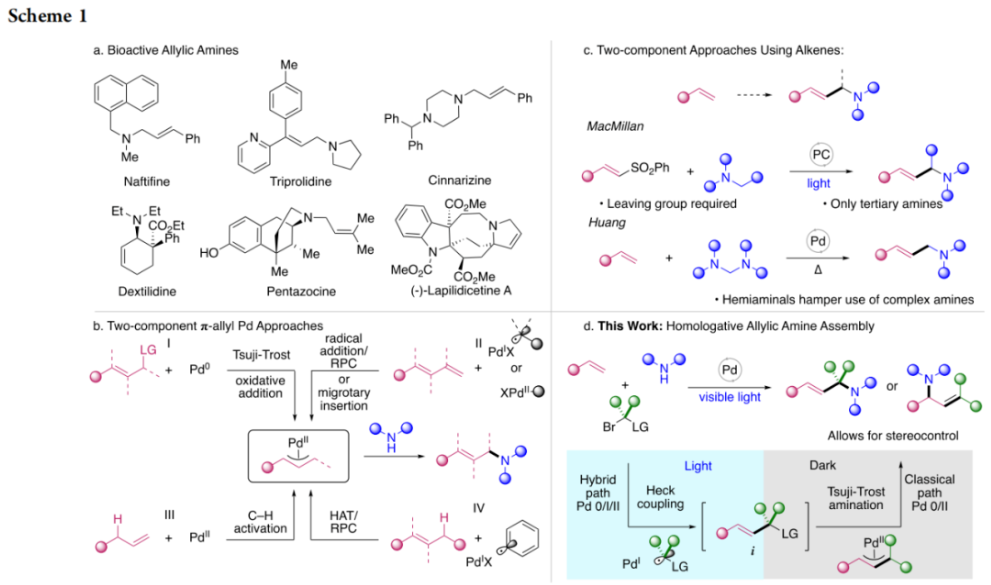
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn