

G-蛋白偶聯受體(G protein-coupled receptor,GPCR)是細胞表面受體家族中最大的一類,調控著人體各種生命活動且與疾病密切相關,有超過30%的藥物作用于 GPCR。而B類GPCRs是一類重要的多肽激素受體,包括胰高血糖素受體(GCGR)、胰高血糖素樣肽-1受體(GLP-1R)、葡萄糖依賴性胰島素釋放多肽受體(GIPR)和甲狀旁腺激素受體1(PTH1R)等在內的共15個激素受體,它們主要通過調節多肽類激素的信號傳導來調控多種生理功能,包括血糖調節、骨代謝、胃腸道功能、神經調節和生長調節等,并涉及許多疾病的發病機制,如糖尿病、骨質疏松癥和癌癥等,因此,B類GPCRs成為治療肥胖、糖尿病和骨質疏松癥、抑郁、心血管疾病、癌癥等多種疾病的重要藥物靶點。然而,由于B類GPCRs的復雜結構和信號傳遞機制,針對這些受體的藥物開發,尤其是小分子激動劑藥物一直面臨挑戰。雖然一些針對B類GPCRs的多肽藥物已成功上市,包括用于治療2型糖尿病藥物GLP-1類似物以及骨質疏松癥藥物PTH和PTHrP類似物等,但是這類多肽類藥物需要皮下注射,使用不便,費用昂貴,且伴有頭痛、惡心等副作用。
與注射肽類藥物不同,小分子藥物可以開發成片劑,并具有更好的藥物特性,因此,小分子激動劑藥物研發在近年來受到科學家的廣泛追捧。然而,針對B類GPCRs的小分子激動劑藥物臨床應用卻一直沒有突破。在這種背景下,中國科學院上海藥物研究所徐華強/趙麗華研究團隊系統地開展B類GPCRs的結構解析和分子機制研究,在過去十多年里,在B類GPCRs激動劑作用機制研究領域取得了一系列突破性進展。
研究團隊早在2008年到2010年期間就解析了多個B類GPCRs的胞外結構域(ECD)晶體結構,闡述了內源性多肽與B類GPCRs的識別作用機制1-3。2016年,研究團隊合作揭示 B 類 GPCRs 激活對 ECD 的需求不同的作用機制4,并闡述GLP-1R的ECD激活內在的激動作用機理,為 GLP-1R 及下游信號轉導激活機制研究奠定基礎5。2017年與王明偉團隊合作在J Biol Chem以封面文章提出了B類GPCRs受體第六跨膜的構象發生改變從而產生自我激活效應的分子機制6。到2019年在全長B類GPCRs激活機制方面又取得突破性進展,研究團隊與浙江大學張巖團隊、上海藥物所王明偉團隊等多方合作在Science上首次報道了1型人源甲狀旁腺激素受體(Parathyroid hormone type 1 receptor, PTH1R)與Gs蛋白復合物的三維結構,揭示了其長效激活狀態下的分子動力學機制,為創制治療骨質疏松癥等疾病的新藥奠定了堅實的基礎7。2020年,研究團隊與張巖團隊合作在Molecular Cell揭示促腎上腺皮質激素釋放因子受體的激活機制8;與王明偉/楊德華研究團隊、張巖團隊合作在Nature Communications首次揭示了GHRHR的配體識別、信號激活及疾病發生的分子機制,為相關新藥的研發奠定了堅實的基礎9。在Cell research上揭示 GLP-2R 獨特的配體識別和受體激活機制,為小腸短小綜合癥(Short bowel syndrome, SBS)和克羅恩氏病(Crohn's disease)的藥物研發提供重要的結構信息10。在Nature Communications報道了VIP1R與多肽配體PACAP27和Gs蛋白復合物的冷凍電鏡結構11。在Cell research上首次解析了完全激動劑小分子化合物與GLP-1R復合物的冷凍電鏡結構,闡述了小分子完全激動劑激活GLP-1R的分子機制12。2021年,研究團隊與王明偉/楊德華研究團隊合作在PNAS上揭示了PTH2R 的配體選擇性及疾病發的分子機制13,在Elife揭示了 GIPR 的配體識別和信號轉導的分子機制,為基于GIPR 藥理學的2型糖尿病的藥物發現提供了重要的結構信息14, 在Nature Communications上揭示了GLP-1R變構激動調節的分子機制15。在PNAS上闡述了B類GPCRs結構性信號偏向轉導機制16。2022年,研究團隊與王明偉/楊德華團隊合作在Nature Communications系統闡明了GLP-1R/GCGR/GIPR雙重和三重激動劑的配體識別和受體激活機制,在原子水平揭示了它們發揮多重藥理效應的關鍵位點,為治療2型糖尿病設計和開發更為有效的新型多重激動劑提供新思路17。研究團隊合作解析B類GPCRs受體家族15個成員中最后一個受體,VIP2R的三維結構18。研究團隊與山東大學于曉團隊、浙江大學張巖團隊合作在Nature Communications上揭示B類GPCRs的G蛋白選擇性偶聯激活機制19,與王明偉/楊德華研究團隊合作在APS上進一步揭示甲狀旁腺激素受體1的兩個內源性多肽激素的分子識別和激活機制20。
2023年7月31日,在B類GPCRs小分子激動劑激活作用機制方面取得突破性進展,該研究團隊在Nature雜志上以“快速通道”方式發表了最新研究成果“Conserved class B GPCR activation by a biased intracellular agonist”。團隊發現了B類GPCRs的新型小分子激動劑結合口袋,由于該結合口袋在B類GPCRs中具有較高的保守性,并且能夠激活多種受體,這為研發針對該口袋的小分子激動劑提供了新的可能性。因此,該藥物口袋的發現為治療糖尿病、肥胖、骨質疏松和其他涉及B類GPCRs的疾病的藥物研發提供了新的方向和途徑,為開發更具選擇性和有效性的藥物打開了新的視野。這種藥物口袋的發現可以為未來的新藥研發提供重要的基礎和潛在機會(圖1)。
通過冷凍電鏡技術,研究團隊獲得了B類GPCRs中最重要的成員之一PTH1R與小分子激動劑PCO371的高分辨率結構,通過結構分析和功能實驗發現B類GPCRs存在類似PCO371結合的保守的小分子結合口袋,揭示了PCO371的新型的結合模式,同時發現PCO37具有G蛋白信號通路偏向性激活作用,為B類GPCR的小分子藥物設計和開發提供了新的見解和新的途徑,通過針對這個保守的口袋進行藥物研發,有可能開發比當前治療方法更具選擇性且副作用更少的藥物。該研究發現的新型小分子激動劑結合口袋,揭示了B類GPCRs激活的獨特機制,為創新療法鋪平了道路,該工作展示了對B類GPCRs的開創性研究及其作為藥物靶點的巨大潛力。
具體地說,PCO371結合在PTH1R與Gs蛋白的胞內界面上,與以前報道的所有GPCR中配體的結合位點完全不同。PCO371作為偏向激動劑,優先通過G蛋白觸發信號傳遞,而非通過阻遏蛋白arrestin。這種偏向性激動劑有助于減少阻遏蛋白arrestin信號通路引起的副作用,提高藥物的安全性和有效性(圖2)。
此外,研究團隊通過結構分析和受體氨基酸序列比對發現,構成PCO371結合口袋的氨基酸殘基在B類GPCRs中具有較高的保守性,使得PCO371能夠激活B類GPCR中的8種受體,并且通過1個或2個點突變就可以使其他受體對PCO371產生反應(圖3)。這些發現揭示了B類GPCRs小分子激動劑的獨特結合位點,這個保守的結合口袋為開發新的治療糖尿病、肥胖、骨質疏松和其他涉及B類GPCRs的疾病的口服藥物提供了令人興奮的機會,為針對2型糖尿病、肥胖癥和骨質疏松癥等疾病的不同類型B類GPCR小分子激動劑藥物的設計和開發提供了新的思路和方法。
該研究由上海藥物所徐華強研究員和趙麗華研究員領導的B類GPCRs研究小組成員通力合作完成。上海藥物所趙麗華研究員、博士研究生何倩以及高峰電鏡中心執行主任袁青寧為該論文的共同第一作者。上海藥物所徐華強研究員、趙麗華研究員為論文的共同通訊作者。參與本次研究的還有上海藥物所碩士研究生顧奕敏、博士研究生何欣恒、單虹博士、李俊睿博士、王凱副研究員、碩士研究生李陽,高峰電鏡中心工作人員胡雯和吳凱以及沈建華研究員。本研究冷凍電鏡數據在上海藥物所高峰電鏡中心收集,該項研究工作得到了國家自然科學基金委員會、國家重點研發計劃、上海市科學技術委員會、中國科學院青年創新促進會、中科院戰略性先導科技專項(B類)和原創新藥研究重點實驗室等項目資助。
論文鏈接:https://www.nature.com/articles/s41586-023-06467-w

圖1右下角的小分子、受體和G蛋白復合物的三維結構是本研究中報道的PCO371-PTH1R-Gs復合物結構,呈現的是一種新型小分子結合口袋,氣球代表B類GPCRs家族的15個成員,本研究中發現的新型小分子結合口袋的主要氨基酸序列在這15個受體中非常保守,宇航員帶著這15個氣球遨游在廣闊的太空,并開啟了對這個新型口袋的小分子藥物研究新時代,未來針對這15個受體靶標的小分子藥物研發將是科學家們探索的新領域,并且這個領域的未來發展將會是星辰大海。本研究揭示了B類GPCRs 15個受體中一個保守且可供藥物作用的口袋,這可能帶來用于治療各種疾病的口服小分子藥物的開發。
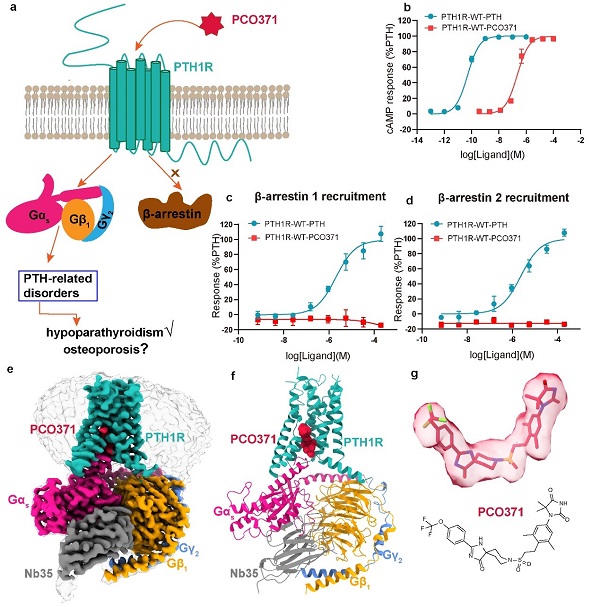
圖2 PCO371偏向激活G蛋白信號通路,但不激活阻遏蛋白arrestin信號通路;PCO371-PTH1R-Gs復合物冷凍電鏡高分辨結構以及呈現的新型配體結合口袋
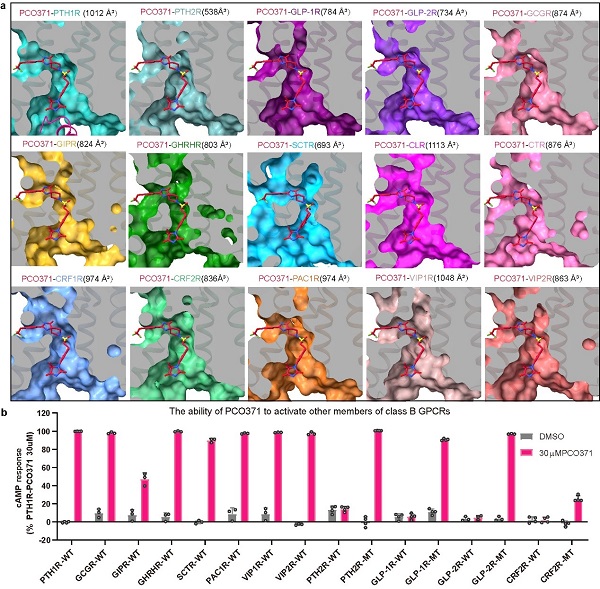
圖3 在B類GPCRs中普遍存在保守的類似PCO371的結合口袋
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn