

1. 電賦能物質轉化:流動電化學實現不活潑烯烴氮雜環丙烷化
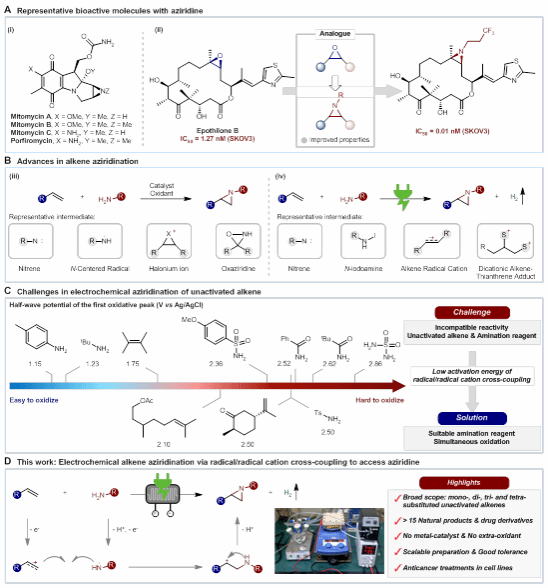
含氮化合物具有獨特的生理活性,其中,氮雜環丙烷是最簡單的含氮雜環,與環氧乙烷互為電子等排體,是烯烴在人體內代謝產物的類似物,具有獨特生物和藥理活性。例如,將Epothilone B中的環氧乙烷替換為氮雜環丙烷后,其對人類乳腺癌細胞系SKOV3的抗癌活性顯著提升(IC50由1.27 nM降低至0.01 nM)。此外,氮雜環丙烷也可以作為中間體合成其他高價值含氮化合物。這一系列特性吸引了合成化學家與藥學家的廣泛關注。基于此,武漢大學雷愛文、孫志軍、陳宜鴻團隊設想:開發新的高效、綠色反應模式實現萜烯的氮雜環丙烷化,并探索這一結構對萜烯生物活性的影響。
烯烴的氮雜環丙烷化,可以從廉價原料烯烴一步構建氮雜環丙烷,是一種理想的合成方式。傳統的氮雜環丙烷合成通常需要貴金屬催化劑與過量的氧化劑,或者對底物進行預活化,同時還面臨著選擇性難以控制,原子經濟性低等問題。隨著近年來綠色合成理念的興起,電化學使用電作為能量輸入,實現了電子作為氧化還原試劑的綠色合成模式。然而目前的電化學烯烴氮雜環丙烷化往往受限于富電子烯烴或單取代烯烴,能適用于萜烯等不活潑烯烴的方法仍然有待進一步研究。其最大的挑戰在于胺化試劑與烯烴的反應性不匹配。
武漢大學高等研究院雷愛文教授、陳宜鴻研究員聯合武漢大學口腔醫院孫志軍教授團隊通過引入不同電性的官能團調控胺源的氧化還原活性,使胺化試劑與烯烴在電化學氧化過程中反應性匹配。這一策略可以有效實現烯烴與胺在陽極同時氧化,通過氮自由基-烯烴自由基陽離子偶聯的方式實現烯烴的氮雜環丙烷化。該方法可以在電化學流動池中實現各種取代類型的不活潑烯烴的氮雜環丙烷化,同時可以兼容萜烯等一系列天然產物及藥物分子,具有兼容性好,可放大等優點。最后,該方法得到的氮雜環丙烷等含氮化合物在肺癌NCI-460及乳腺癌MCF-7細胞系中展示了一定的細胞毒性,支持了產物的潛在藥用價值。
這一成果于7月3日在線發表于National Science Review《國家科學評論》上,高等研究院博士后王盛淳、博士研究生王鵬杰和口腔醫院博士生李樹勁為共同第一作者,武漢大學雷愛文教授、孫志軍教授和陳宜鴻研究員為論文的共同通訊作者。該工作得到了國家自然科學基金重點項目、面上項目、武漢市自然科學基金和湖北省博士后創新人才崗位的支持。
論文原文:https://doi.org/10.1093/nsr/nwad187
2. 仿生B12催化:實用型萜烯烯丙位氟烷基化
現代含氟藥物已占藥物總數量的35%左右。將氟原子或含氟基團引入到藥物分子中,可以改變藥物分子的結構、物理化學性質及藥代動力學性質,是藥物化學結構改造的重要途徑之一。萜烯烯丙位精準氟烷基化反應在保留萜烯骨架的同時可能得到高生理活性的萜烯衍生物,相關報道卻寥寥無幾。雖然近年來在催化烯丙基氟烷基化反應方面取得了少量進展,但通常需要較為昂貴的氟烷基化試劑,例如Togni試劑、Umemoto試劑、TMSCF3和含氟磺酰亞胺等。這些模式通常經歷碳正離子消除過程,雙鍵重構的位點選擇性難以控制。因此,含有多個類似烯丙基C-H鍵復雜分子的精準氟烷基化仍是一大挑戰。
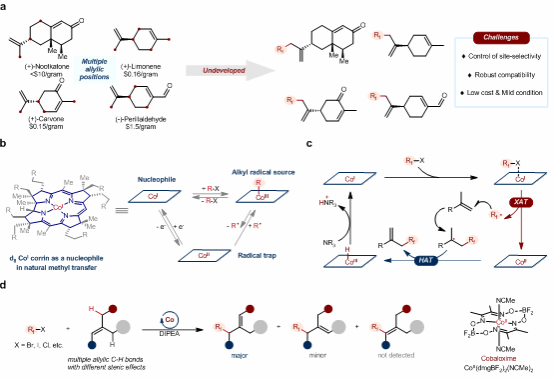
基于前期工作基礎(Nature Catal., 2022, 5, 642),雷愛文教授團隊設想結合維生素B12催化的烷基轉移與鈷促進的氫原子轉移過程來避免碳正離子消除的路徑,從而實現烯丙位的精準氟烷基化。利用親核性的一價鈷與親電性的氟烷基試劑反應產生氟烷基自由基,隨后氟烷基自由基與烯烴反馬氏加成,在鈷肟催化劑的氫原子轉移作用下得到烯丙位氟烷基化產物。基于鈷肟HAT的選擇性,這一策略對于多種萜烯都展示出了單一的區域選擇性。
該策略關鍵在于利用鈷肟催化劑的鹵素原子轉移能力(XAT)和氫原子攫取能力(HAT)來實現位點選擇性的烯丙基氟烷基化反應,具有反應條件溫和、底物適用性好、安全可靠、操作簡便、成本低廉、容易規模放大等優點,并且已經成功擴展到三百克規模的合成,證明了該方法在工業中的應用潛力。該研究為開發新型含氟藥物提供了一種有效的途徑,同時也為氟烷基化反應在藥物化學領域的應用拓展了新的可能性,有望對制藥行業產生重要影響。目前,研究團隊正在進一步探索該方法得到的含氟化合物的生物活性及藥理活性。
這一成果于7月21日發表在Nature Synthesis《自然·合成》上,高等研究院博士后王盛淳和博士研究生任德敏為共同第一作者,雷愛文教授為通訊作者。該工作得到了國家自然科學基金重點項目、面上項目、武漢市自然科學基金和湖北省博士后創新人才崗位的支持。同時得到了上海光源、武漢大學超算中心、浙江九洲藥業、清華大學楊海軍及國儀量子范瑩瑩等相關技術和場地支持,武漢大學郭勉教授和陸慶全教授提供了建設性建議。
論文原文:https://www.nature.com/articles/s44160-023-00365-9
據悉,雷愛文教授深耕綠色氧化偶聯十五載,迄今為止發表論文490余篇,在Nature Chem. (1篇)、Nature Catal. (3篇)、Nature Synth. (3篇)、Nat. Commun. (18篇)、JACS (32篇)、ACIE (48篇)、Chem (2篇)、Chem. Rev.(4篇)、Chem. Soc. Rev.(3篇)、Acc. Chem. Res.(2篇) 等影響因子大于12的雜志上發表論文130余篇,總被引用超37000余次,H 因子為105。2016-2023年連續入選Thomson Reuters和Elsevier的全球“高被引科學家”。
雷愛文課題組網站:http://aiwenlei.whu.edu.cn/
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn