



放射醫(yī)學(xué)與輻射防護國家重點實驗室史海斌教授課題組與蘇州大學(xué)附屬第二醫(yī)院范國華教授合作在酶控siRNA藥物遞送克服腫瘤乏氧抗腫瘤光動力治療方面取得新進展,相關(guān)成果以“Furin Enzyme-Responsive siRNA Delivery System for Efficient Anti-Hypoxia Assisted Cancer Photodynamic Therapy”為題于7月6日在線發(fā)表在國際知名雜志CCS. Chemistry.上,論文鏈接:https://www.chinesechemsoc.org/doi/10.31635/ccschem.023.202302777。
傳統(tǒng)基因干擾療法(RNAi)通過沉默靶基因的表達被證明是一種非常有前途的治療癌癥和其它疾病的手段。然而由于其存在遞送效率低、穩(wěn)定性差、基因沉默效率不高、系統(tǒng)毒性大等問題,嚴重制約了其更廣泛的臨床應(yīng)用。因此,發(fā)展高效穩(wěn)定的siRNA遞送系統(tǒng)對于實現(xiàn)腫瘤等重大疾病的精準診治意義重大。由于多肽分子具有合成簡單、免疫原性低、生物相容性好、親和力高和成本低等特點,是一種極具潛力的siRNA 遞送載體。此外,改善腫瘤乏氧微環(huán)境是提升腫瘤治療敏感性的有效途徑。故研發(fā)精準高效的Hif-1α siRNA腫瘤遞送系統(tǒng)面臨著較大的挑戰(zhàn)。
在前期工作中,史海斌課題組在智能響應(yīng)性腫瘤診療策略研究方面開展了大量工作(Angew. Chem. Int. Ed., 2023, e202218969;Nat. Commun., 2022, 13, 1685;J. Am. Chem. Soc., 2022, 144, 23061;Angew. Chem. Int. Ed., 2021, 60, 23805;J. Am. Chem. Soc., 2020, 142, 21502;J. Am. Chem. Soc., 2019, 141, 3265;Adv. Mater.,2017, 29, 1604894)。在最新研究進展中,針對上述難題,蘇州大學(xué)蘇州醫(yī)學(xué)院史海斌教授與蘇州大學(xué)附屬第二醫(yī)院范國華教授等合作以RVRRKC多肽為骨架,通過共價鍵將P18和DOTA-Gd引入,構(gòu)建了可與Hif-1α siRNA自組裝形成尺寸約為220 nm納米顆粒的siRNA遞送載體RVRR-P18-Gd。該系統(tǒng)主要由三部分組成:正電性的弗林酶多肽底物 Arg-Val-Arg-Arg (RVRR)用于吸附siRNA,螯合Gd (III) 的DOTA用于磁共振成像,和紅紫素18 (P18)為光敏劑。首先,RVRR-P18-Gd分子通過靜電吸附與Hif-1α siRNA在緩沖液中自組裝成穩(wěn)定的納米顆粒,有效提高siRNA的體內(nèi)穩(wěn)定性并延長了其循環(huán)周期。然后,腫瘤過表達弗林蛋白酶調(diào)控Hif-1α siRNA在腫瘤區(qū)域選擇性釋放,抑制癌細胞中Hif-1α的表達,增強其光動力治療的敏感性,實現(xiàn)對小鼠HCT116腫瘤生長的有效抑制。該研究工作發(fā)展了一種抗乏氧腫瘤光動力治療的普適性方法,為實現(xiàn)腫瘤精準診療提供了有用方案。
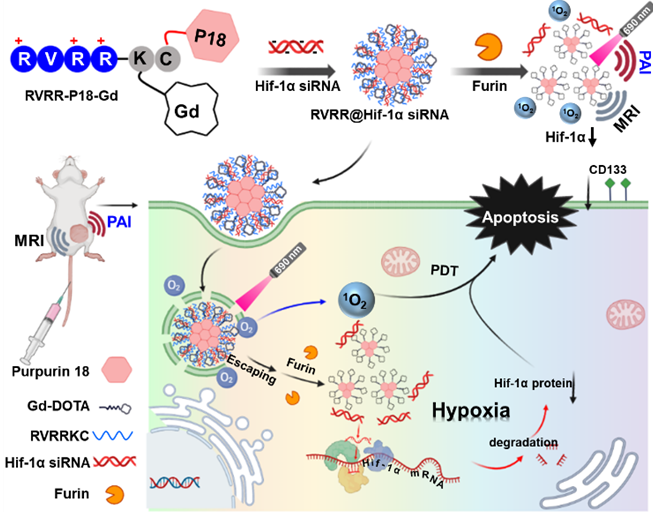
圖1.弗林蛋白酶介導(dǎo)的Hif-1α siRNA腫瘤精準遞送用于抗乏氧腫瘤光動力治療
首先,將RVRR@Hif-1α siRNA與弗林蛋白酶共孵育,發(fā)現(xiàn)納米藥物在6小時后逐漸解組裝成小尺寸的納米顆粒 (~25 nm),同時伴隨著弗林蛋白酶濃度依賴的Hif-1α siRNA緩釋,表明該體系可用于Furin介導(dǎo)的Hif-1α siRNA藥物可控遞送,這為后續(xù)開展體內(nèi)外腫瘤治療研究奠定了基礎(chǔ)。隨后我們在細胞層面利用RVRR@Hif-1α siRNA開展了siRNA的遞送與腫瘤治療研究,通過活(綠色)死(紅色)細胞染色和MTT實驗,證實RVRR@Hif-1α siRNA具有優(yōu)異的殺死癌細胞能力。由于Hif-1α siRNA腫瘤細胞的選擇性釋放使結(jié)腸癌細胞中Hif-1α 蛋白的表達水平大幅下調(diào),同時引起了下游腫瘤干細胞指標 CD133的明顯降低,這些實驗結(jié)果直接證實了降低腫瘤乏氧微環(huán)境可有效提高腫瘤細胞治療的敏感性。進一步構(gòu)建了小鼠皮下HCT116腫瘤模型,通過尾靜脈注射RVRR@Hif-1α siRNA,結(jié)合光動力治療,開展了活體結(jié)直腸癌腫瘤的成像與治療研究。研究結(jié)果顯示,大部分小鼠的腫瘤得到有效治愈。總之,本工作研發(fā)了一種集腫瘤成像與治療一體化的新型酶控siRNA 遞送系統(tǒng),顯著增強了腫瘤的光動力治療敏感性,實現(xiàn)了結(jié)直腸癌腫瘤的精準高效光動力治療。該研究不僅發(fā)展了一種腫瘤基因遞送新方法,還為增強腫瘤治療敏感性進而提升治療效率提供了有效工具。
本論文第一作者為蘇州大學(xué)已畢業(yè)博士研究生現(xiàn)在德克薩斯大學(xué)西南醫(yī)學(xué)中心從事博士后研究的葉舒岳。放射醫(yī)學(xué)與輻射防護國家重點實驗室史海斌教授和蘇州大學(xué)附屬第二醫(yī)院范國華教授為本論文的通訊作者,蘇州大學(xué)為該論文第一單位。該工作得到國家自然科學(xué)基金重大研究計劃、國家自然科學(xué)基金面上及放射醫(yī)學(xué)與輻射防護國家重點實驗室開放課題等項目的共同資助。
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn