



環(huán)丁烷結(jié)構(gòu)廣泛存在于具有顯著生物活性的天然產(chǎn)物中,引入這種小環(huán)是制備生物活性分子的有力策略。但是在現(xiàn)有的報(bào)道中,很難實(shí)現(xiàn)對(duì)環(huán)丁烷上多個(gè)立體中心的構(gòu)建,這可能是由于缺乏立體控制合成方法造成的。不對(duì)稱制備四元環(huán)最常用的策略是[2+2]環(huán)加成和骨架重排(即環(huán)的擴(kuò)張或收縮),但對(duì)已有的環(huán)丁烷或環(huán)丁烯進(jìn)行不對(duì)稱官能團(tuán)化還有待發(fā)展。
圖1. 含環(huán)丁烷結(jié)構(gòu)的生物活性分子(圖片來源:Angew. Chem. Int. Ed.)
Tortosa課題組報(bào)道了銅催化的去對(duì)稱化反應(yīng)實(shí)現(xiàn)了環(huán)丁基硼酸鹽的不對(duì)稱合成。這種方法可以生成1,2,3-三取代環(huán)丁烷,很容易地進(jìn)行進(jìn)一步的修飾。該課題組還報(bào)道了不對(duì)稱Pt-催化螺環(huán)環(huán)丁烯的二硼化反應(yīng)和Cu-催化螺環(huán)環(huán)丁烯的單硼化反應(yīng)生成非手性三取代螺環(huán)丁烷。Buchwald課題組開發(fā)了CuH催化的1-取代環(huán)丁烯不對(duì)稱氫胺化反應(yīng),得到對(duì)映體富集的反式-1,2-二取代氨基環(huán)丁烷,Rh-催化的環(huán)丁烯不對(duì)稱氫酰化也有報(bào)道,這兩個(gè)反應(yīng)都被認(rèn)為經(jīng)過了一個(gè)關(guān)鍵的不對(duì)稱氫金屬化過程。
α,β-不飽和酮的1,4-加成是
作者此前報(bào)道了一系列環(huán)丁烯的不對(duì)稱芳基化,這些芳基化通過一個(gè)共同的不對(duì)稱碳金屬化步驟進(jìn)行初始碳硼化后,經(jīng)過不同的反應(yīng)途徑(取決于環(huán)上的取代基和反應(yīng)條件)可以產(chǎn)生各種不同的產(chǎn)物。對(duì)于某些底物,作者觀察到β-氫消除途徑緊隨氫金屬化,這一過程可被用于產(chǎn)生遠(yuǎn)程消除反應(yīng)。作為本研究的一部分,作者還觀察到具有螺環(huán)的環(huán)丁烯在3位發(fā)生了區(qū)域選擇性還原型Heck反應(yīng),生成非手性環(huán)丁烷。
Rh-促進(jìn)β-雜原子消除的能力使作者考慮如何打破螺環(huán)環(huán)丁烯的對(duì)稱性。作者特別想知道含有螺環(huán)縮酮的環(huán)丁烯是否會(huì)發(fā)生高度區(qū)域和
圖2. 研究背景(圖片來源:Angew. Chem. Int. Ed.)
首先,作者以1a為模型底物進(jìn)行了底物篩選。最終發(fā)現(xiàn)當(dāng)反應(yīng)體系組成為2a(2當(dāng)量)、CsOH(1當(dāng)量)、[RhCl(coe)2]2(2.5% mol)、L1(6.0% mol)和THF(0.2 M)作溶劑時(shí)反應(yīng)效果最佳,產(chǎn)率為85%,ee為95%。
圖3. 條件篩選(圖片來源:Angew. Chem. Int. Ed.)
隨后,作者進(jìn)行了底物拓展。首先是對(duì)芳基硼酸酯適用范圍的探索,間位和對(duì)位取代的硼酸酯都能以理想的產(chǎn)率和ee值得到對(duì)應(yīng)的烯醇產(chǎn)物,且官能團(tuán)兼容性較好,如鹵素 (3ac, 3ai, 3aj-l, 3am, 3aq),烷氧(硫)基(3ab, 3af, 3as),乙酰基和酯基(3ag, 3at),氨基甲酸保護(hù)的胺基(3ar)和硅基(3ap),產(chǎn)率為75%-93%,ee值為91%-98%。鄰位取代硼酸在過渡金屬催化的1,4-加成反應(yīng)中往往極具挑戰(zhàn)性,通常具有較低的產(chǎn)率和對(duì)映選擇性。在該反應(yīng)中,2-氟苯硼酸可以得到良好的結(jié)果(3am, 產(chǎn)率53%,93% ee),空間位阻更大的2-甲基苯硼酸ee只有58%,但使用配體L4時(shí)對(duì)映體選擇性可提高到70% ee (3ao)。作者又對(duì)乙烯硼酸進(jìn)行測(cè)試,相應(yīng)產(chǎn)物雖然產(chǎn)率尚可,但ee較低。另外,雜芳基硼酸并不適用于這一體系。
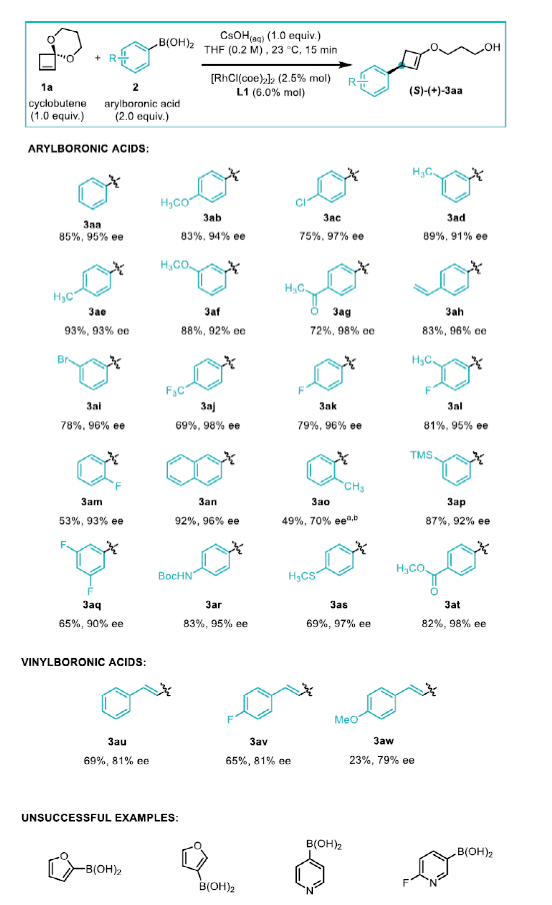
圖4. 底物拓展一(圖片來源:Angew. Chem. Int. Ed.)
此外,作者對(duì)另外三種具有不同取代基和不同環(huán)尺寸的螺環(huán)環(huán)丁烯進(jìn)行了拓展。這些縮酮也獲得了良好的結(jié)果(1b-d)。1b和1c的產(chǎn)物具有較高的對(duì)映選擇性。另一方面,當(dāng)使用五元縮酮環(huán)丁烯1d時(shí),ee值較低。
圖5. 底物拓展二(圖片來源:Angew. Chem. Int. Ed.)
結(jié)合此前的研究,作者提出了以下機(jī)理: I與2發(fā)生轉(zhuǎn)金屬化反應(yīng),生成中間體II。然后,II和烯烴1a通過碳金屬化反應(yīng)生成中間體III。碳金屬化步驟的區(qū)域選擇性可能不受酮的任何電子效應(yīng)控制,而完全受空間位阻控制。然后,III經(jīng)過β-羥基消除開環(huán),得到IV。I最終通過IV水解再生,同時(shí)生成產(chǎn)物3a。中間體III也可以發(fā)生副反應(yīng),得到4a。VI經(jīng)1,4-Rh遷移氧化加成到芳基環(huán)的鄰位。對(duì)于一些吸電子的芳基取代基,這種氧化加成的速率大大增加,產(chǎn)生少量的副產(chǎn)物4a(例如3ak, 3ar)。
圖6. 反應(yīng)機(jī)理(圖片來源:Angew. Chem. Int. Ed.)
為體現(xiàn)該反應(yīng)的應(yīng)用價(jià)值,作者對(duì)3aa進(jìn)行了進(jìn)一步轉(zhuǎn)化。3aa水解生成3-苯基環(huán)丁酮(5),表明1a是環(huán)丁酮與芳基硼酸1,4-加成的穩(wěn)定替代品。加熱環(huán)丁烯3aa會(huì)發(fā)生電環(huán)化開環(huán)反應(yīng),生成富電子的二烯6,產(chǎn)率為77%。產(chǎn)物末端的羥基可以繼續(xù)用作后續(xù)的官能團(tuán)化。例如,與酞酰亞胺的Mitsunobu型取代可以得到7。烷基烯醚可與NBS進(jìn)行α-官能團(tuán)化反應(yīng)生成溴酮10。TBDMS保護(hù)的8經(jīng)硼氫化氧化后得到具有3個(gè)相鄰立體中心的環(huán)丁烷9。
圖7. 反應(yīng)應(yīng)用(圖片來源:Angew. Chem. Int. Ed.)
總結(jié)
Stephen P. Fletcher課題組開發(fā)了一種高效、高選擇性的銠催化環(huán)丁烯縮酮的不對(duì)稱芳基化反應(yīng)。該反應(yīng)采用不對(duì)稱碳金屬化和β-氧消除相結(jié)合的方法,從非手性酮合成手性烯醇醚。該反應(yīng)是環(huán)丁酮不對(duì)稱加成反應(yīng)的替代途徑。使用手性二烯配體在室溫下反應(yīng)迅速,產(chǎn)物可以進(jìn)一步修飾以獲得更復(fù)雜的環(huán)丁烷。
文獻(xiàn)詳情:
David Egea-Arrebola, F. Wieland Goetzke, Stephen P. Fletcher*. Rhodium-Catalyzed Asymmetric Arylation of Cyclobutenone Ketals. Angew. Chem. Int. Ed. 2023, https://doi.org/10.1002/anie.202217381
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請(qǐng)作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn