- 首頁
- 資訊
PNAS:北大李龍組與宋晨組合作揭示ATP水解推動蛋白質轉運的分子機理
來源:北京大學 2023-02-03
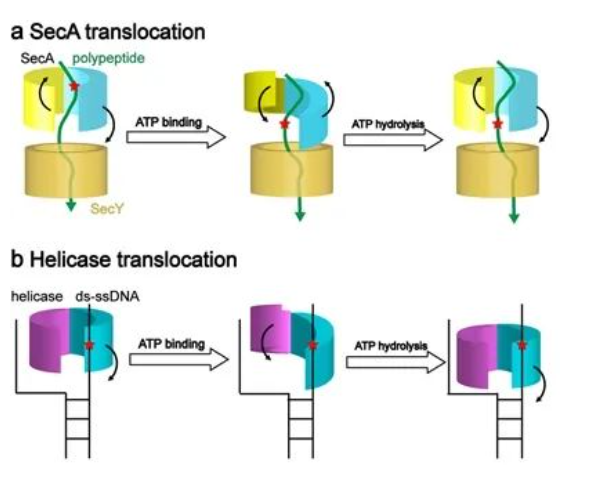
導讀:2023年1月4 日,北京大學生命科學學院李龍研究員組與前沿交叉學科研究院定量生物學中心宋晨研究員組合作,在PNAS期刊發表題為“Structural basis of SecA-mediated protein translocation”的研究論文。該研究發現SecA ATPase推動的蛋白轉運與解旋酶推動的核酸轉運在分子水平上有高度的相似性。
蛋白質跨膜轉運是生物生命活動中一種必不可少的過程。蛋白質通過定向轉運,從細胞質運輸到細胞外。細菌中最重要的蛋白質跨膜轉運系統是Sec系統,絕大多數分泌型蛋白質被高度保守的SecA ATP水解酶識別并推動,經過SecY通道穿越細胞膜。經過30多年的研究,人們對Sec系統介導的蛋白質跨膜轉運過程有了較為全面的了解,但是對SecA通過ATP水解驅動蛋白穿膜的分子機理仍然存在很大爭議。研究瓶頸主要在于缺乏不同核苷酸結合狀態下的活性SecA-SecY復合物的結構,特別是在ADP狀態下的結構。此前僅有ATP類似物結合狀態下的SecA-SecY復合物的結構[1]。ADP結合狀態下的SecA-SecY復合物非常不穩定,多年來領域內廣泛認為難以解析其結構。李龍組經過幾年的探索,最終通過二硫鍵交聯和納米脂盤等多種技術在體外穩定SecA-SecY-蛋白底物復合物與ADP結合的狀態,利用單顆粒冷凍電鏡(cryo-EM)技術獲得其高分辨結構。通過與ATP類似物結合的結構比較,發現蛋白底物在SecA-SecY復合物中可以被ATP水解驅動。這是人們第一次直接觀察到ATP水解過程中SecA、SecY和蛋白底物在不同中間狀態下的構象。結構分析顯示,在結合ATP后,SecA的核苷酸結合結構域由開放狀態轉變為關閉狀態,該構象變化傳遞至SecA的“夾子”結構單元,推動蛋白底物移向SecY通道。生化突變研究驗證了SecA的“夾子”在蛋白質轉運中的重要性。之后,分子動力學模擬確認SecA“夾子”兩側與蛋白底物的相互作用在ATP水解過程中發生強度交替變化,從而產生使蛋白底物穿膜的單一方向驅動力。這一分子過程與核酸解旋酶的“蠕蟲運動”模型有高度的相似之處(圖1)。本研究揭示了SecA在ATP水解循環中推動蛋白底物通過SecY通道的分子機制,解決了領域內長期存在的爭論,發現了蛋白質和核酸轉運之間的相似性,為開發新型抗生素提供了新的潛在作用靶點。李龍和宋晨為通訊作者。生命科學學院2017級博士生董林琳為第一作者。北大-清華生命科學聯合中心2019級博士生楊嵩為第二作者,負責了分子動力學模擬工作。北京大學生命科學學院2019級博士生陳靜霞、2022級博士生吳曉飛和前實驗員孫東杰也參與了這一工作。高寧教授和李寧寧副研究員對本研究的結構計算部分提供了重要指導。該工作得到了北京大學冷凍電鏡平臺、高性能計算中心、生科院儀器中心、膜生物學國家重點實驗室、以及北大-清華生命科學聯合中心的大力支持。標注:[1] 北大生科.Nature Communications | 李龍研究組和高寧研究組合作解析SecA-SecY蛋白轉運機制的底物嵌合結構.http://www.bio.pku.edu.cn/homes/Index/news_cont/22/14629.html,2019-07-02.
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn